温带4种针叶树种春、秋季节树干维持呼吸的日动态
许 飞, 王传宽
东北林业大学生态研究中心, 哈尔滨 150040
温带4种针叶树种春、秋季节树干维持呼吸的日动态
许 飞, 王传宽*
东北林业大学生态研究中心, 哈尔滨 150040
揭示树干维持呼吸(RM)的时间变化特征及其调控因子有助于理解树木碳代谢过程及其对环境变化的响应和构建森林碳循环机理模型。采用红外气体分析法原位测定东北东部山区4个针叶树种(红松、红皮云杉、樟子松和兴安落叶松)的春、秋季节RM日动态及其影响因子。结果表明:秋季和春季4个树种RM日变化多随树干温度(TW)而变化,但RM峰值大小和出现时间以及日变化幅度因树种和季节而异。TW解释了RM(除春季樟子松外)变异性的50%以上,但RM对TW响应滞后1.5 h(春季樟子松为3 h)。将RM标准化到TW为10 ℃(R10)时发现,秋季R10波动在0.54 μmol CO2m-2s-1(兴安落叶松)—0.78 μmol CO2m-2s-1(红皮云杉)之间,而春季R10则波动在0.87 μmol CO2m-2s-1(红松)—1.10 μmol CO2m-2s-1(樟子松)之间,前者平均低于后者约40%。然而,各树种秋季和春季RM的Q10值差异不显著(P> 0.05),波动在1.52(樟子松)—1.82(红皮云杉)之间。秋季和春季所有树种的R10与树木胸径(DBH)之间均呈显著的正相关关系(P<0.05),而Q10与DBH则多呈负相关关系(P< 0.05),表明DBH可作为估测这些针叶树种RM的参数之一。
树干维持呼吸; 日变化; 胸径;Q10; 针叶树
树干作为树木生物量的主体,不仅是森林生态系统的一个长期稳定的碳汇[1],而且因树干内活细胞终年均有维持呼吸(RM)而成为一个不容忽视的碳源[2]。树干呼吸占树木自养呼吸的15%—45%[3- 5],能消耗森林总初级生产力(GPP)的8%—13%[4, 6- 7];特别是在中高纬度地区,非生长季RM对生态系统呼吸和GPP的贡献量可能大于生长季[7]。因此,揭示树干RM的日变化特征及其调控因子是理解树木代谢呼吸碳分配及其对环境变化的响应和构建森林碳循环机理模型的重要内容。
树干呼吸是一个复杂的生理和物理扩散过程,受树木生理因子[8- 11]和环境因子[12- 14]的综合影响,由此不同树种的树干呼吸在不同季节表现出明显而分异的时间动态格局,诸如单峰曲线[15]、双峰曲线[5]、无峰曲线[7]和S型曲线[16]等。许多研究报道,温度是决定树干呼吸日变化的主要因子[6, 12],因而多数森林碳循环模型均采用温度关系模型(如Q10模型)模拟估算木质组织呼吸通量。然而,也有研究指出,温度变化并不能完全解释树干呼吸的日变化规律,如树干呼吸对温度的响应存在明显的滞后现象(即“时滞效应”)[17- 18]、相同温度下白天测定的树干呼吸低于夜间[10, 18]等,这可能与形成层活动[8]、树干对CO2透性日变化[9]、液流速度日变化[10]、树干含水量[19]和呼吸底物[20]等因子有关。因此,即使同一个树种的同一株树木个体,在非生长季的春季和秋季其RM也会因其生理状况的差异而表现出不同的日变化格局。
为了建立合理的森林碳循环模型、深入了解树干呼吸对环境变化的响应[17],很多学者通常将树干呼吸划分为维持细胞正常生命活动的维持呼吸和提供能量合成新组织的生长呼吸(RG)两个功能性组分,并探索了相关的区分方法[8, 21]。其中,基于非生长季树干呼吸测定的成熟组织法是目前应用最广泛的原位非破坏性直接区分两个组分的方法[21- 22]。此方法的一个关键假设是生长季前(春季)或后(秋冬季)测定的RM及其对温度的响应在一年中不同时段是不变的[22]。然而,这个假设对于不同的树种、季节是否成立尚需大量的原位实测来验证[22]。
我国东北温带森林因其面积大、碳储量高以及对全球变化响应敏感而在区域碳循环和气候系统中起着重要的作用[23]。然而,目前该地区森林碳循环研究还不系统,其中木质组织呼吸作用释放CO2的估算还存在很大的不确定性[15, 24]。以往对该地区主要树种树干呼吸的研究多集中在生长季[11, 15- 16, 25],而对非生长季RM日变化的研究很少,这在一定程度上阻碍了东北地区木质组织呼吸碳损失的精确估算。为此,以东北东部温带森林中4个主要针叶树种——红松(Pinuskoraiensis)、红皮云杉(Piceakoraiensis)、樟子松(Pinussylvestrisvar.mongolica)和兴安落叶松(Larixgmelinii)为研究对象,分别在非生长季开始(秋季)和结束(春季)测定其树干RM的日变化特征及其影响因子,旨在深入了解树木碳代谢过程及其驱动机制,减少森林碳收支估测中的不确定性,为构建温带森林碳循环机理模型提供基础数据。
1 研究方法1.1 研究地概况和试验设计
研究地设在黑龙江帽儿山森林生态站(45°24′ N, 127°40′ E)。平均海拔400 m,平均坡度10°—15°,地带性土壤为暗棕色森林土。该地区气候属大陆性季风气候,夏季短促湿热、冬季寒冷干燥。年均降水量和蒸发量分别为629 mm和864 mm;年均气温、1月份和7月份的平均气温分别为3.1 ℃、-18.5 ℃和+22.0 ℃;无霜期为120—140 d。现有植被是原地带性植被—阔叶红松林经干扰后形成的天然次生林和人工林,代表着东北东部山区典型的森林类型。
测定树种为常绿针叶树红松、红皮云杉、樟子松和落叶针叶树兴安落叶松。根据林分内各树种林木的径级分布情况,按照均匀取样的原则,每个树种随机选取生长良好的样树12株。样树的胸径(DBH)变化范围(均值)分别为:红松7.9—29.5 cm(18.6 cm)、红皮云杉10.3—41.7 cm(25.3 cm)、樟子松13.6—32.9 cm(22.4 cm)、兴安落叶松11.5—45.6 cm(25.8 cm)。
1.2RM测定
采用红外气体分析法原位测定RM[12]。2009年4—5月期间,在样树树干北面的DBH处(约离地1.3 m)安装高约5.0—6.0 cm、内径10.4 cm的PVC呼吸环。先将呼吸环的一端打磨成与树干表面相吻合的弧形,再利用100%中性硅酮防水胶将其固定在已除去松脱的树皮等表面杂物的树干表面上,并同步测定呼吸环所覆盖的树干表面积(S);呼吸环完全固定后,采用注水法测定其体积(V)[16],用于计算RM。整个测定期间呼吸环位置保持不变,以便连续测定。
于2011年10—11月(树木停止生长后的秋季)和2012年4月下旬—5月上旬(树木开始恢复(快速)生长前的春季),选择晴天利用LI- 6400便携式CO2/H2O分析系统(IRGA,Li-Cor Inc., Lincoln, NE, USA)每隔1.5 h连续24 h测定RM的昼夜变化。因为秋季树干生长已经停止[26],所以此时没有RG;另根据Zweifel等[27]对生长的定义:次年树木生长的开始时间为其树干生长累积增量超过去年树干生长累积增量的最高点,本研究发现春季4个针叶树种的树干胸围累积增量均低于其去年的最大值,所以假设2个测定时期(秋季和春季)测得的树干表面CO2释放通量仅是RM或者主要以RM为主(即RG所占比例较小)[17]。测定前,检查并确保呼吸环不漏气;测定时,将LI- 6400-09同化室扣在呼吸环上,采用自动测定设置,每10 s记录一个CO2浓度值、连续取样2 min,然后根据同化室中CO2浓度随时间的变化曲线计算单位树干表面积释放的CO2通量(RM,μmol CO2m-2s-1)。同步利用连接在IRGA上的温度计测定呼吸环上方约3 cm处、树皮下约1 cm深处的树干温度(TW,℃)。
1.3 数据分析
计算RM:
(1)
采用指数模型拟合RM与TW之间的关系,即:
RM=R10e[b×(TW-10)]
(2)
式中,R10是TW为10 ℃时的RM(μmol CO2m-2s-1),b为回归系数。RM和TW之间响应的时间间隔称为时滞(h),拟合以上指数方程最优的TW称为时滞温度(TW-TL,℃)[28]。通过下式确定RM的Q10:
Q10= e10b
(3)
采用协方差分析(ANCOVA)比较同一季节不同树种日平均RM(以TW为协变量)之间的差异,并作Duncan显著性差异检验;采用配对样本t检验比较同一树种不同季节的日平均RM和TW的差异;采用t检验比较同一季节不同树种日平均TW以及各树种白天和夜间平均RM之间的差异;利用线性回归方程拟合R10与DBH、DBH与Q10之间的关系。所有的数据均采用SPSS统计软件进行分析。
2 结果
2.1RM的日变化
秋季和春季4个树种RM的日变化总体上与TW的日变化基本吻合,呈现显著的单峰(红松、红皮云杉、秋季樟子松和春季兴安落叶松)或双峰(秋季兴安落叶松和春季樟子松)曲线,但其峰值大小、峰值出现时间和日变化幅度因树种和季节而异(图1)。秋季,红松(0.67 μmol CO2m-2s-1)、红皮云杉(0.86 μmol CO2m-2s-1)和兴安落叶松(0.59 μmol CO2m-2s-1)的RM最大值均出现在15:30左右,而樟子松的RM最大值(0.71 μmol CO2m-2s-1)则出现在17:00左右;兴安落叶松在06:30左右对应于其TW变化,其RM出现一个次高峰值(0.50 μmol CO2m-2s-1);红松RM与TW的日高峰值出现时间一致,而其余3个树种的RM日高峰值均滞后于TW日高峰值约1.5 h。春季,红松(1.34 μmol CO2m-2s-1)和红皮云杉(1.73 μmol CO2m-2s-1)的RM最大值出现在15:30左右,而樟子松(1.54 μmol CO2m-2s-1)和兴安落叶松(1.60 μmol CO2m-2s-1)的则出现在17:00左右;樟子松在05:00左右也出现一个次高峰值(1.24 μmol CO2m-2s-1);4个树种RM日高峰值出现时间均滞后于TW日高峰值约1.5 h。RM最小值出现时间不一,大多树种出现在05:00—08:00,而秋季兴安落叶松却出现在00:30左右。
所有树种秋季RM和TW(除樟子松外)的日变化幅度均低于春季(图1)。秋季4个树种RM和TW的日变化幅度分别波动在0.25 μmol CO2m-2s-1(兴安落叶松)—0.43 μmol CO2m-2s-1(红皮云杉)和8.68 ℃(兴安落叶松)—10.74 ℃(红皮云杉)之间;而春季则分别波动在0.62 μmol CO2m-2s-1(红松)—0.94 μmol CO2m-2s-1(红皮云杉)和6.97 ℃(樟子松)—13.23 ℃(红皮云杉)之间。

图1 4个树种秋季和春季树干维持呼吸速率(RM)和树干温度(TW)的日变化
2.2 秋季与春季、白天与夜间的RM比较
秋季各树种的日平均RM显著低于春季的日平均值(P< 0.05),分别波动在0.45 μmol CO2m-2s-1(兴安落叶松)—0.63 μmol CO2m-2s-1(红皮云杉)和1.03 μmol CO2m-2s-1(红松)—1.24 μmol CO2m-2s-1(樟子松)之间,前者仅为后者的47%。相应的,秋季日平均TW(7.15 ℃)也显著地低于春季日平均值(12.94 ℃;P< 0.05)。然而,不论秋季还是春季,同一季节4个树种的RM日平均值之间的差异显著(P< 0.05),但相应的TW日平均值之间的差异不显著(P> 0.05)(图2)。除秋季兴安落叶松(0.50 vs. 0.42 μmol CO2m-2s-1)之外,无论秋季还是春季,各树种白天与夜间的平均RM差异均不显著(P> 0.05;秋季:红松(0.50 vs. 0.53 μmol CO2m-2s-1)、红皮云杉(0.61 vs. 0.65 μmol CO2m-2s-1)、樟子松(0.55 vs. 0.56 μmol CO2m-2s-1);春季:红松(1.06 vs. 1.00 μmol CO2m-2s-1)、红皮云杉(1.26 vs. 1.01 μmol CO2m-2s-1)、樟子松(1.20 vs. 1.29 μmol CO2m-2s-1)、兴安落叶松(1.23 vs. 1.08 μmol CO2m-2s-1))。

图2 4个树种秋季和春季树干维持呼吸速率(RM)和树干温度(TW)日平均值(±标准误,n = 16)比较
2.3RM与TW的关系
所有树种的RM与TW之间均存在显著的指数函数关系(P< 0.05),但指数模型的R2随树种、季节和时段而变化(图3)。4个树种白天和夜间RM与TW关系的R2以红松最高(0.90和0.99)、樟子松最低(0.58和0.49);且夜间RM-TW拟合模型的R2明显高于白天,前者平均高于后者14%。在日时间尺度上,4个树种的TW分别解释了秋季和春季RM变异性的57%(兴安落叶松)—71%(红松)和21%(樟子松)—84%(红皮云杉),而且春季TW对RM的解释率平均高于秋季24%(除樟子松外)(图3)。然而,RM对TW响应存在明显的滞后性。RM与测定RM前1.5 h(其中春季樟子松为3 h)的TW(TW-1.5/3)的回归关系更为密切,R2波动在0.84(樟子松)—0.98(红松)之间(图3),因此,本文之后的分析和讨论部分均选用RM-TW-1.5/3回归模型。
同一树种秋季和春季的Q10值差异不显著(P> 0.05;图4),波动在1.52(樟子松)—1.82(红皮云杉)之间。除樟子松(1.55)之外,同一季节红皮云杉、兴安落叶松和红松的Q10值差异不显著(P> 0.05),其平均值分别为1.79、1.74和1.68(图4)。夜间Q10值普遍高于白天和全天(图4)。
所有树种的春季R10均显著高于秋季(P< 0.05),分别波动在0.87 μmol CO2m-2s-1(红松)—1.10 μmol CO2m-2s-1(樟子松)和0.54 μmol CO2m-2s-1(兴安落叶松)—0.78 μmol CO2m-2s-1(红皮云杉)之间,前者平均是后者的1.62倍(图4d)。春秋季平均值的大小排序为:樟子松(0.87 μmol CO2m-2s-1)>红皮云杉(0.86 μmol CO2m-2s-1)>兴安落叶松(0.79 μmol CO2m-2s-1)>红松(0.71 μmol CO2m-2s-1)(图4e)。夜间的R10均普遍高于白天和全天(图4f)。
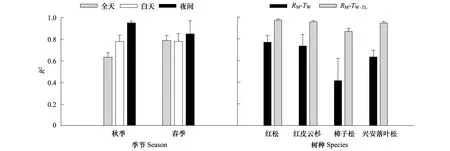
图3 4个树种秋季和春季不同时段(全天n = 3,白天n = 4,夜间秋季和春季分别为n = 3和4)的树干维持呼吸速率—树干温度(RM-TW)回归方程和RM-树干时滞温度(RM-TW-TL)与RM-TW回归方程的决定系数(R2)
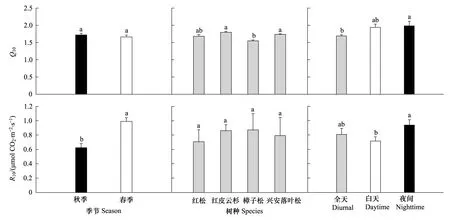
图4 不同季节(n = 4)、不同树种(n = 2)和不同时段(全天n = 8,白天n = 8,夜间n = 7)的树干维持呼吸速率(RM)的Q10值和标准化到10 ℃的RM(R10)比较。Q10(Q10 = e10b)和R10由RM-树干时滞温度(RM-TW-TL)回归方程得到
2.4RM与DBH的关系
秋季和春季4个树种的R10与DBH均呈显著的线性关系(P< 0.05),但其线性回归方程的R2和斜率因树种和季节而异(图5)。除红皮云杉之外,其它树种秋季R10-DBH回归方程的R2均高于春季,前者平均高于后者32%。然而,各树种秋季R10-DBH回归方程的斜率均明显低于春季,但同一季节4个树种回归方程的斜率差异不显著(P> 0.05)。

图5 4个树种秋季和春季标准化到10 ℃的树干维持呼吸速率(R10)与胸径(DBH)的关系
除秋季兴安落叶松之外,其它树种的Q10值均表现出随DBH增加而减小的趋势,但是两者之间的回归关系因树种和季节而异(图6)。秋季和春季的红松、春季红皮云杉和春季兴安落叶松的Q10值与DBH均呈显著的负线性关系(P< 0.05),而其线性回归方程的斜率差异不显著(P> 0.05)。秋季和春季的樟子松和秋季红皮云杉的Q10值与DBH之间的关系不显著(P> 0.05),而秋季兴安落叶松的Q10值和DBH之间则呈显著的正相关关系(P< 0.05)。

图6 4个树种秋季和春季Q10与胸径(DBH)的关系
3 讨论
3.1RM的时间动态
本研究中的4个温带针叶树种春秋季的RM日变化大体随TW变化,但其日变化曲线峰值的出现时间和大小以及变化幅度随树种和季节而变(图1),反映了树木在不同季节中新陈代谢活动强度对温度变化的响应及其生理调整的差异,这与以往的研究结果相符[7, 15- 16]。然而,TW仅解释了RM日变化21%—84%的变异(图3),而且同一季节4个树种的日平均RM差异显著、日平均TW差异却不显著(图2)。这一方面说明温度仍然是调控RM时间动态变化最主要的环境因子[29];另一方面表明除了温度以外,还有其他生物(如树种[11]、形成层活动[8]、树干的活细胞数量和氮含量[21]、树干对CO2透性[9]和树干液流[10]等)和非生物(如土壤含水量[13- 14]等)因子在共同调控RM。另外,虽然本研究中同一季节4个针叶树种的日平均RM差异显著(图2),但均处于已报道的香脂冷杉(Abiesbalsamea)[18]、欧洲赤松(Pinusdensiflora)[28]等其它温带针叶树种的范围内。除樟子松之外,春季TW解释各树种RM的变异率(R2)平均高于秋季24%(图3),说明温度对RM的影响强度随季节而变化。在土壤含水量较高的春季,温度对RM的限制作用较大;而在土壤含水量较低的秋季,土壤水分则可能也是其限制因子之一,从而降低温度对RM的解释能力[13]。此外,树干对CO2透性的季节变化也可能影响RM对温度的响应[9]。
由于实验条件有限(如仪器较少、劳动力不足等原因),以往一些研究只测定白天的RM,进而推算树木树干RM年通量[16, 30- 31]。本研究结果显示,秋季和春季4个针叶树种夜间与白天的RM均值差异不显著,但在相同温度下夜间的RM(R10)显著高于白天(图4)。这表明树木树干RM年通量的精确估算还须考虑RM的昼夜变化,否则会造成RM通量的低估。
夜间R10显著高于白天(图4),可能与树干含水量和底物供应等有关。夜间树木的蒸腾作用基本停止,其液流很小或者没有[10],所以此时的树干水分状况好于白天,树干活组织细胞的膨压增加,进而增加了树干维持代谢,导致夜间树干氧化呼吸速率高于白天[10]。另外,Edwards和McLaughlin[20]发现,树干呼吸与韧皮部还原糖浓度有密切关系,而夜间韧皮部还原糖浓度明显高于白天的浓度,因此,夜间的树干呼吸底物供应较丰富。
3.2RM的温度响应
本研究发现,秋季和春季4个针叶树种的RM对TW的响应均表现出显著的滞后现象;即使是同一个树种(樟子松),其秋季(1.5 h)和春季(3 h)的时滞也不同(图1,图3)。这表明不同树种或同一树种不同季节的RM对TW响应存在时滞效应。Ryan等[17]发现4个针叶树种的RM滞后于边材温度0—5 h,而滞后时间长短与树皮厚薄有关。Lavigne 等[18]在研究香脂冷杉的RM时发现,将RM与1.75 h前的TW回归可消除RM和TW之间的时滞。Maier[22]报道火炬松(Pinustaeda)RM的时滞为0—4 h。
有关引起RM对温度响应的时滞效应的解释不少,但其中的主导驱动机理还不明确。主要解释包括:(1)树干解剖结构对CO2径向扩散的阻碍作用[32]。树干内活细胞呼吸产生的CO2释放到大气的过程中受到树干物理结构(木质部、形成层、韧皮部和树皮等)的层层阻挡,只有当两者之间的CO2浓度梯度达到足以驱动树干活组织代谢产生的CO2向外扩散时,树干表面CO2通量才能被测到,而这个过程也需要花费一定的时间[32]。Steppe等[9]也认为不同树种树干各层结构对CO2透性的日变化是引起RM日变化的重要原因之一。所以通过控制实验和解剖树干组织等相结合的方法量化不同季节不同树种(或个体)的树干CO2径向扩散阻碍可能有助于消除时滞效应。(2)树干某一位置、某一深度测得的TW不能代表整个呼吸测定部位的温度[33],因此时滞效应大小和时滞长短与所测定的TW有关。Kim等[28]发现欧洲赤松的RM和1.5—2 cm深的TW间存在3—6 h的时滞;而本研究发现4个针叶树种的RM与树皮下1 cm深TW间的时滞为1.5—3 h(图3)。因此,采用多位置或多深度测定的TW的均值代表被测树干呼吸部位的温度,或者采用遮阴(如用防辐射膜覆盖等)等阻碍阳光直射、以防止被测树干呼吸部位的温度梯度发生大的变化等的方式[10],可能大大提高温度对树干呼吸速率的解释能力。(3)树木蒸腾作用拉动的树干液流可带走部分树干代谢呼吸释放出的CO2[34]。本研究虽然没有同步测定树干液流与RM的关系,但我们发现树木蒸腾作用强、树干液流高的白天R10显著低于蒸腾作用较弱的夜间(图4),而且夜间时段RM-TW回归方程的R2平均比白天高14%(图3)。以往许多研究也得到了同样的结果[10, 18]。这些结果间接地说明RM测定值与树干液流有关;因此,有人认为夜间测得的树干表面CO2通量可能更接近真实的RM通量[10]。可见,利用夜间树干液流停止流动或相对较低时树干呼吸与TW间的回归关系估算全天或全年的树干呼吸通量可能产生较小的偏差。
RM对温度响应的时滞效应对于精确估算木质组织呼吸年通量很重要。Lavigne等[18]和Acosta和Brossaud[35]等均指出,如果不考虑这种时滞效应、仅采用白天测定的树干呼吸模拟夜间呼吸,则会低估夜间呼吸速率约11%—20%。本研究也得到了相似的结果,即采用白天测定值拟合夜间呼吸,将平均低估夜间呼吸速率约18%。因此,在数据测定、碳平衡模型构建和模拟以及不同研究结果的比较整合时,应充分考虑树干呼吸对温度的时滞响应[18],以减少木质组织年碳通量估测的不确定性。
采用成熟组织法区分RM和RG时假设:生长季前(春季)后(秋冬季)测定的RM及其对温度的响应(即R10和Q10)在一年中恒定[22]。本研究发现,Q10值不随树种(除樟子松外)和所测定的春秋季而变,波动在1.52—1.82之间(图4),处于以往报道的非生长季针叶树种Q10值的范围内(1.3—2.5)[17- 18]。然而,秋季R10显著低于春季,平均低40%(图4),这可能与两个季节形成层区域的代谢活动有关[8]。秋季树干活细胞即将或已进入休眠状态,其新陈代谢活动减弱,所以R10较小;而春季树干活细胞代谢活动复苏,树木生长需要大量的能量和底物,因而碳代谢能力增强,R10增加。以上结果表明在应用成熟组织法时应该谨慎,因为测定时间(秋季或春季)能显著影响RM的准确估测[22]。Maier[22]采用秋季测定的RM估算的年通量比采用春季测定值估算的低44%。Lavigne等[8]提出,在春季形成层细胞膨胀至木质部开始快速生长前的时段(即晚春的2—3周内),形成层细胞的生理条件可代表生长季期间RM的新陈代谢状态,因此是应用成熟组织法的最合适测定时段。
3.3RM及其Q10与DBH之间的关系
树干呼吸作用除了与温度等因子密切相关之外,还受树干活细胞数量和树干氮含量等生理因素的影响[21]。本研究结果表明,4个温带针叶树种秋季和春季的R10均与其DBH呈显著的正相关关系(图5),且DBH解释了R1050%以上的变异(除春季樟子松外)。这表明DBH可作为预测温带森林中某些树种不同季节树干呼吸速率的一个重要参数[11, 15]。在一定生长年限内,树木边材宽度随DBH增加而变宽[36];边材越宽,意味着具有生理活性的活细胞数量越多,且活细胞数量与氮含量也正相关[21],因而RM亦随之增大。由于春季树干活细胞的生理活性高于秋季[8],所以春季R10-DBH回归关系的斜率也表现出高于秋季的趋势(图5)。然而,同一测定时期不同树种R10-DBH回归关系的斜率差异不显著可能表明不同树种处于生长缓慢(春季)或者停止(秋季)状态时其生理活性细胞的呼吸代谢强度相似。
本研究中4个针叶树种春秋季的Q10值多与其DBH呈负相关关系(图6),与以往的研究结果相符[30, 37]。这可能是小径级树木比大径级树木的热量交换快[30]、树体大小和树皮厚度差异导致树干径向CO2扩散受阻程度[21]和扩散距离不同[38]等的缘故。然而,其中3个树种(红松、红皮云杉和兴安落叶松)Q10-DBH关系的斜率差异不显著(图6),这可能意味着共存于同一气候(如寒冷)条件下的针叶树种其RM对温度的敏感性随树木大小的变化是一致的。值得注意的是,秋季兴安落叶松的Q10值与DBH呈显著的正相关关系(图6),虽然这种现象在以往的研究中也有所发现[16, 21],但并不清楚其原因。据推测可能与不同季节不同个体的树干径向解剖结构特征和生理状态差异[9]、呼吸底物的数量和质量[39]等有关,需要深入研究。
4 结论
4个温带针叶树种春秋季的RM日变化大体随TW变化,但其日变化曲线峰值出现时间和大小以及变化幅度随树种和季节而变。TW是RM日变化的主要驱动因子,但RM对TW的响应存在显著的时滞效应,其时滞长短与树种和测定时间有关。不同季节、不同树种的Q10值相对稳定,但相同温度下秋季RM显著低于春季。因此,在数据测定、碳平衡模型构建和模拟、不同研究结果的比较整合以及木质组织呼吸释放CO2的年通量估算等方面,应充分考虑树干呼吸的时间动态及其对温度的时滞效应。不同树种春秋季RM与其DBH均存在显著的线性关系,强调了DBH可作为树干呼吸估测变量的重要性和实用性。
致谢:感谢帽儿山森林生态站提供的野外支持。
[1] Lavigne M B, Ryan M G. Growth and maintenance respiration rates of aspen, black spruce and jack pine stems at northern and southern BOREAS sites. Tree Physiology, 1997, 17(8/9): 543- 551.
[2] Edwards N T, Tschaplinski T J, Norby R J. Stem respiration increases in CO2-enriched sweetgum trees. New Phytologist, 2002, 155(2): 239- 248.
[3] Ryan M G, Linder S, Vose J M, Hubbard R M. Dark respiration of pines. Ecological Bulletins, 1994, 43: 50- 63.
[4] Maier C A, Albaugh T J, Allen H L, Dougherty P M. Respiratory carbon use and carbon storage in mid-rotation loblolly pine (PinustaedaL.) plantations: the effect of site resources on the stand carbon balance. Global Change Biology, 2004, 10(8): 1335- 1350.
[5] 肖复明, 汪思龙, 杜天真, 陈龙池, 于小军. 湖南会同林区杉木人工林呼吸量测定. 生态学报, 2005, 25(10): 2514- 2519.
[6] Ryan M G, Hubbard R M, Clark D A, Sanford R L. Woody-tissue respiration forSimaroubaamaraandMinquartiaguianensis, two tropical wet forest trees with different growth habits. Oecologia, 1994, 100(3): 213- 220.
[7] Zha T S, Kellomäki S, Wang K Y, Ryyppö A, Niinistö S. Seasonal and annual stem respiration of Scots pine trees under boreal conditions. Annals of Botany, 2004, 94(6): 889- 896.
[8] Lavigne M B, Little C H A, Riding R T. Changes in stem respiration rate during cambial reactivation can be used to refine estimates of growth and maintenance respiration. New Phytologist, 2004, 162(1): 81- 93.
[9] Steppe K, Saveyn A, McGuire M A, Lemeur R, Teskey R O. Resistance to radial CO2diffusion contributes to between-tree variation in CO2efflux ofPopulusdeltoidesstems. Functional Plant Biology, 2007, 34(9): 785- 792.
[10] Saveyn A, Steppe K, McGuire M A, Lemeur R, Teskey R O. Stem respiration and carbon dioxide efflux of youngPopulusdeltoidestrees in relation to temperature and xylem carbon dioxide concentration. Oecologia, 2008, 154(4): 637- 649.
[11] 许飞, 王传宽, 王兴昌. 东北东部 14 个温带树种树干呼吸的种内种间变异. 生态学报, 2011, 31(13): 3581- 3589.
[12] Xu M, DeBiase T A, Qi Y. A simple technique to measure stem respiration using a horizontally oriented soil chamber. Canadian Journal of Forest Research, 2000, 30(10): 1555- 1560.
[13] 魏国军, 盛浩, 杨智杰, 袁一丁, 杨玉盛. 亚热带4种行道树树干表面CO2释放速率昼夜动态. 亚热带资源与环境学报, 2009, 4(1): 23- 31.
[14] Stahl C, Burban B, Goret J-Y, Bonal D. Seasonal variations in stem CO2efflux in the Neotropical rainforest of French Guiana. Annals of Forest Science, 2011, 68(4): 771- 782.
[15] 石新立, 王传宽, 许飞, 王兴昌. 四个温带树种树干呼吸的时间动态及其影响因子. 生态学报, 2010, 30(15): 3994- 4003.
[16] 王淼, 姬兰柱, 李秋荣, 肖冬梅, 刘海良. 长白山地区红松树干呼吸的研究. 应用生态学报, 2005, 16(1): 7- 13.
[17] Ryan M G, Gower S T, Hubbard R M, Waring R H, Gholz H L, Cropper W P, Running S W. Woody tissue maintenance respiration of four conifers in contrasting climates. Oecologia, 1995, 101(2): 133- 140.
[18] Lavigne M B, Franklin S E, Hunt E R. Estimating stem maintenance respiration rates of dissimilar balsam fir stands. Tree Physiology, 1996, 16(8): 687- 695.
[19] Saveyn A, Steppe K, Lemeur R. Daytime depression in tree stem CO2efflux rates: is it caused by low stem turgor pressure? Annals of Botany, 2007, 99(3): 477- 485.
[20] Edwards N T, McLaughlin S B. Temperature-independent diel variations of respiration rates inQuercusalbaandLiriodendrontulipifera. Oikos, 1978, 31: 200- 206.
[21] Ceschia É, Damesin C, Lebaube S, Pontailler J-Y, Dufrêne É. Spatial and seasonal variations in stem respiration of beech trees (Fagussylvatica). Annals of Forest Science, 2002, 59(8): 801- 812.
[22] Maier C A. Stem growth and respiration in loblolly pine plantations differing in soil resource availability. Tree Physiology, 2001, 21(16): 1183- 1193.
[23] 王传宽, 杨金艳. 北方森林土壤呼吸和木质残体分解释放出的CO2通量. 生态学报, 2005, 25(3): 633- 638.
[24] 王淼, 武耀祥, 武静莲. 长白山红松针阔叶混交林主要树种树干呼吸速率. 应用生态学报, 2008, 19(5): 956- 960.
[25] Wang W J, Yang F J, Zu Y G, Wang H M, Takagi K, Sasa K, Koike T. Stem respiration of a larch (Larixgmelini) plantation in Northeast China. Acta Botanica Sinica, 2003, 45(12): 1387- 1397.
[26] 周晓峰, 王义弘, 赵惠勋. 几个主要用材树种的生长节律(一). 东北林学院学报, 1981, (2): 49- 60.
[27] Zweifel R, Eugster W, Etzold S, Dobbertin M, Buchmann N, Häsler R. Link between continuous stem radius changes and net ecosystem productivity of a subalpine Norway spruce forest in the Swiss Alps. New Phytologist, 2010, 187(3): 819- 830.
[28] Kim M H, Nakane K, Lee J T, Bang H S, Na Y E. Stem/branch maintenance respiration of Japanese red pine stand. Forest Ecology and Management, 2007, 243(2/3): 283- 290.
[29] Wieser G, Bahn M. Seasonal and spatial variation of woody tissue respiration in aPinuscembratree at the alpine timberline in the central Austrian Alps. Trees, 2004, 18(5): 576- 580.
[30] Damesin C, Ceschia E, Goff N L, Ottorini J-M, Dufrêne E. Stem and branch respiration of beech: from tree measurements to estimations at the stand level. New Phytologist, 2002, 153(1): 159- 172.
[31] Brito P, Morales D, Wieser G, Jiménez M S. Spatial and seasonal variations in stem CO2efflux ofPinuscanariensisat their upper distribution limit. Trees, 2010, 24(3): 523- 531.
[32] Eklund L. Endogenous levels of oxygen, carbon dioxide and ethylene in stems of Norway spruce trees during one growing season. Trees, 1990, 4(3): 150- 154.
[33] Stockfors J. Temperature variations and distribution of living cells within tree stems: implications for stem respiration modeling and scale-up. Tree Physiology, 2000, 20(15): 1057- 1062.
[34] Martin T A, Teskey R O, Dougherty P M. Movement of respiratory CO2in stems of loblolly pine (PinustaedaL.) seedlings. Tree Physiology, 1994, 14(5): 481- 495.
[35] Acosta M, Brossaud J. Stem and branch respiration in a Norway spruce forest stand. Journal of Forest Science, 2001, 47(3): 136- 140.
[36] Wang X C, Wang C K, Zhang Q Z, Quan X K. Heartwood and sapwood allometry of seven Chinese temperate tree species. Annals of Forest Science, 2010, 67(4): 410- 1- 410- 10.
[37] Yang J Y, Teskey R O, Wang C K. Stem CO2efflux of ten species in temperate forests in Northeastern China. Trees, 2012, 26(4): 1225- 1235.
[38] Hölttä T, Kolari P. Interpretation of stem CO2efflux measurements. Tree Physiology, 2009, 29(11): 1447- 1456.
[39] Davidson E A, Janssens I A, Luo Y Q. On the variability of respiration in terrestrial ecosystems: moving beyondQ10. Global Change Biology, 2006, 12(2): 154- 164.
Diurnal dynamics in stem maintenance respiration in spring and autumn for four temperate coniferous tree species in northeastern China
XU Fei, WANG Chuankuan*
CenterforEcologicalResearch,NortheastForestryUniversity,Harbin150040,China
Exploring diurnal variations and controlling factors of stem maintenance respiration (RM) is important for understanding tree carbon metabolism and its response to environmental changes and developing forest carbon cycling models. In this study, we used an infrared gas analyzer (LI- 6400 IRGA) toinsitumeasure the diurnal dynamics inRMfor four temperate coniferous tree species in northeastern China. The tree species included three evergreen (i.e., Korean pine (Pinuskoraiensis), Korean spruce (Piceakoraiensis), and Mongolian pine (Pinussylvestrisvar.mongolica)) and one deciduous (Dahurian larch (Larixgmelinii)) species. Twelve replicate trees with various diameters at breast height (DBH) were randomly sampled for each tree species. TheRMfor each sampled tree was measured every 1.5 h around the clock before the growth started in spring (late April-early May) and after the growth ceased in autumn (October-November). A polyvinyl chloride (PVC) collar was installed at breast height of the stem on the northern direction of each sampled tree for measuring theRM. Stem temperature at the 1 cm depth beneath the bark (TW) was simultaneously measured 3 cm above the collar with a digital thermometer. The results showed that the diurnal variation inRMlargely followed the change inTWfor all the tree species in both autumn and spring with a “unimodal” or “bimodal” pattern, but the daily maximum value, occurring time and amplitude ofRMvaried with tree species and seasons.TWexplained more than 50% variations inRMfor all the species except for Mongolian pine in spring, which suggested thatTWbe a key environmental factor regulating theRM. However,RMlagged behindTWby 1.5 h (3 h for Mongolian pine in spring). NormalizedRMat 10 ℃ (R10) was significantly lower in autumn than that in spring for each species, ranging from 0.54 μmol CO2m-2s-1for Dahurian larch to 0.78 μmol CO2m-2s-1for Korean spruce in autumn and from 0.87 μmol CO2m-2s-1for Korean pine to 1.10 μmol CO2m-2s-1for Mongolian pine in spring, respectively. The meanR10was about 40% lower in autumn than in spring. There was no significant difference inQ10value ofRMbetween autumn and spring for each species (P> 0.05), ranging between 1.52 for Mongolian pine and 1.82 for Korean spruce. TheR10was significantly positively correlated with DBH for all the species in both seasons, while theQ10was negatively with DBH (allP< 0.05). This suggested that DBH can be used as a proxy for predicting theRMfor these temperate tree species.
stem maintenance respiration; diurnal dynamics; diameter at breast height;Q10; coniferous species
国家“十二五”科技支撑项目(2011BAD37B01); 教育部长江学者和创新团队发展计划(IRT1054)
2013- 10- 11;
2014- 08- 13
10.5846/stxb201310112443
*通讯作者Corresponding author.E-mail: wangck-cf@nefu.edu.cn
许飞, 王传宽.温带4种针叶树种春、秋季节树干维持呼吸的日动态.生态学报,2015,35(10):3233- 3243.
Xu F, Wang C K.Diurnal dynamics in stem maintenance respiration in spring and autumn for four temperate coniferous tree species in northeastern China.Acta Ecologica Sinica,2015,35(10):3233- 3243.

