应用血管性血友病因子抗原评估中心性肥胖患者不良心血管事件的风险
欧阳淑娟,崔明
(湖南省肿瘤医院1.输血科,2.检验科;湖南 长沙 410013)
·临床论著·
应用血管性血友病因子抗原评估中心性肥胖患者不良心血管事件的风险
欧阳淑娟1,崔明2
(湖南省肿瘤医院1.输血科,2.检验科;湖南 长沙 410013)
目的探讨中心性肥胖患者血浆中血管性血友病因子抗原含量(vWF:Ag)的变化特征以及对心血管不良事件风险的评估价值。方法对该院就诊的155例中心性肥胖患者进行回顾性队列研究。男107例,女48例;选择72例非中心性肥胖患者为肥胖对照组,选择50例体检健康者为健康对照组。采用IL ACL TOP 700型血液凝固仪测定vWF:Ag。采用ROC曲线评价vWF:Ag的诊断性能。用Kaplan-Meier曲线进行生存分析,用Cox比例回归模型分析预后影响。结果中心性肥胖患者血浆vWF:Ag水平高于非中心性肥胖患者,vWF:Ag诊断中心性肥胖患者不良心血管事件的临界值为205%时,曲线下面积为0.864(95%CI 0.769~0.959),高于临界值的患者在1年内的不良心血管事件累计概率显著增高,Cox比例风险模型多因素分析显示vWF:Ag是中心性肥胖患者1年内不良心血管事件的风险因素。结论中心性肥胖患者血浆vWF:Ag水平显著增高,并与患者心血管不良事件风险密切相关,可作为早期评估患者高凝状态和不良预后的生物标志物。
von Willebrand因子;肥胖症;心血管疾病;ROC曲线;Kaplan-Meiers评估;比例危险度模型
中心性肥胖又叫腹型肥胖,由于脂肪在腹部蓄积而成。中心性肥胖是代谢综合征的标志性特征,并对动脉血栓的形成产生重要影响[1],近年来的研究显示,中心性肥胖患者多表现出促凝和低纤溶的状态,并对血小板和血管内皮细胞产生负面影响[2-3],因此对中心性肥胖患者进行抗血小板与抗凝治疗逐渐为临床所关注,同时对肥胖患者血栓风险的评估亦成为研究的重点[4]。本研究对中心性肥胖患者血浆中的血管性血友病因子抗原(von Willebrand factor antigen,vWF:Ag)进行检测,分析其血浆水平变化特征以及对患者远期心血管不良事件的评估价值。
1 资料与方法
1.1 研究对象
对2010年2月-2012年2月于我院体检中心查体的155例中心性肥胖患者进行回顾性队列研究。男107例,女48例;平均(43±14)岁;男性腰围≥102 cm,女性腰围≥88 cm,腰围/臀围为男性>1.0,女性>0.9;选择72例非中心性肥胖患者为肥胖对照组。男50例,女22例;平均(42±15)岁,男性体质指数(BMI)>30,女性BMI>29。排除标准:遗传性易栓症、全身性感染及甲状腺功能紊乱,近3个月内发生静脉或动脉栓塞、外科手术和创伤,抗凝治疗,恶性肿瘤及病史,放、化疗,肝肾器质性疾病和妊娠。选择与研究对象年龄、性别比例匹配的体检健康者50例为健康对照组。男35例,女15例;平均(42±11)岁。对中心性肥胖患者进行1年随访,以不良心血管事件发生为终点事件,截止时间为2013年2月28日。有15例中心性肥胖患者在随访期内发生不良心血管事件。其中,不稳定型心绞痛4例,非ST段抬高型心肌梗死11例。诊断参照2007年美国心脏学会(American college of cardiology,ACC)和美国心脏病协会(American heart association,AHA)制定的标准[5]。3组间性别(χ2=0.012)、年龄(F=1. 350)比较差异无统计学意义。
1.2 方法
采集患者静脉血标本,以0.105 mol/L(3.2%)枸橼酸钠进行抗凝(1∶9),送检后放置于室温(18~25℃)下待检,于采集后2 h内测定。将标本以3000 r/min(2 664×g)离心15 min,取上层乏血小板血浆进行测定。采用IL ACL TOP 700型血液凝固仪测定由于凝集造成的透射光变化以获得血管性血友病因子抗原含量(von Willebrand factor antigen,vWF:Ag)。采用Roche Modular DPP全自动生化分析系统测定血糖(glucose,Glu)、三酰甘油(triglyeride,TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)。
1.3 统计学方法
用SPSS 17.0统计软件对数据进行分析。正态分布计数数据以均数±标准差(x±s)表示,多组间比较采用方差分析,组间多重比较采用q检验。分类资料采用χ2检验。采用ROC曲线评价vWF:Ag的诊断性能。用Kaplan-Meier曲线进行生存分析。用Cox比例回归模型评价vWF:Ag与其他因素对患者预后的影响。P<0.05为差异有统计学意义。
2 结果
2.1 临床基本资料
3组间BMI、收缩压、舒张压、Glu、TG、LDL-C和HDL-C比较差异均有统计学意义(P<0.05或P< 0.01),见表1。
表1 研究对象的临床基本资料(±s)
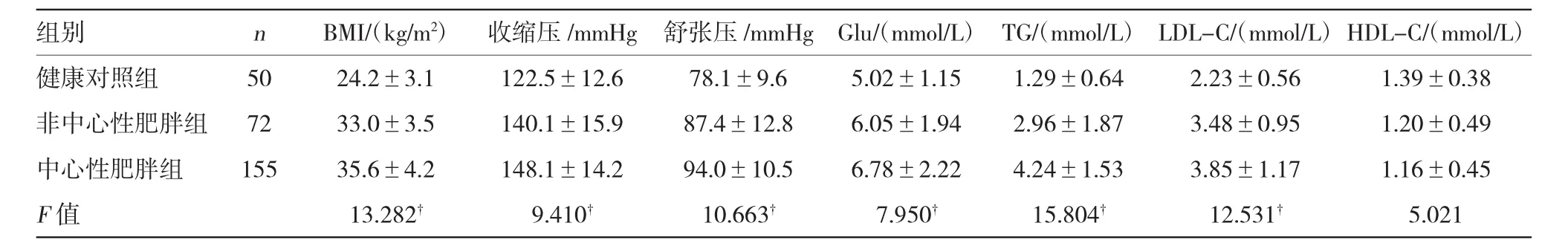
表1 研究对象的临床基本资料(±s)
注:覮P<0.05,1 mmHg=0.133 kPa
组别nBMI/(kg/m2)收缩压/mmHg舒张压/mmHgGlu/(mmol/L)TG/(mmol/L)LDL-C/(mmol/L)HDL-C/(mmol/L)健康对照组5024.2±3.1122.5±12.678.1±9.65.02±1.151.29±0.642.23±0.561.39±0.38非中心性肥胖组7233.0±3.5140.1±15.987.4±12.86.05±1.942.96±1.873.48±0.951.20±0.49中心性肥胖组15535.6±4.2148.1±14.294.0±10.56.78±2.224.24±1.533.85±1.171.16±0.45 F值13.282覮9.410覮10.663覮7.950覮15.804覮12.531覮5.021
2.2 3组间血浆vWF:Ag测定情况
对照组、非中心性肥胖组、中心性肥胖组血浆vWF:Ag分别为(110±31)%、(167±62)%及(193± 54)%,差异有统计学意义(F=11.933,P<0.01),非中心性肥胖组高于对照组,中心性肥胖组高于非中心性肥胖组,差异均有统计学意义(均P<0.05)。
2.3 vWF:Ag诊断中心性肥胖患者不良心血管事件的ROC曲线图
vWF:Ag诊断中心性肥胖患者不良心血管事件的临界值为205%时,敏感度为87.5%,特异度为70.3%,曲线下面积为0.864(95%CI 0.769~0.959)。见图1。
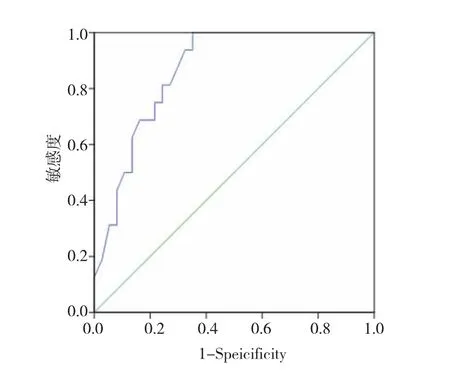
图1 vWF:Ag诊断中心性肥胖患者不良心血管事件的ROC曲线图
2.4 vWF:Ag水平高于临界值的中心性肥胖患者的生存分析
与血浆vWF:Ag水平低于临界值(205%)的患者比较,高于临界值的患者在1年内的不良心血管事件累计概率显著增高(Log-rank χ2=7.091,P= 0.008),见图2。
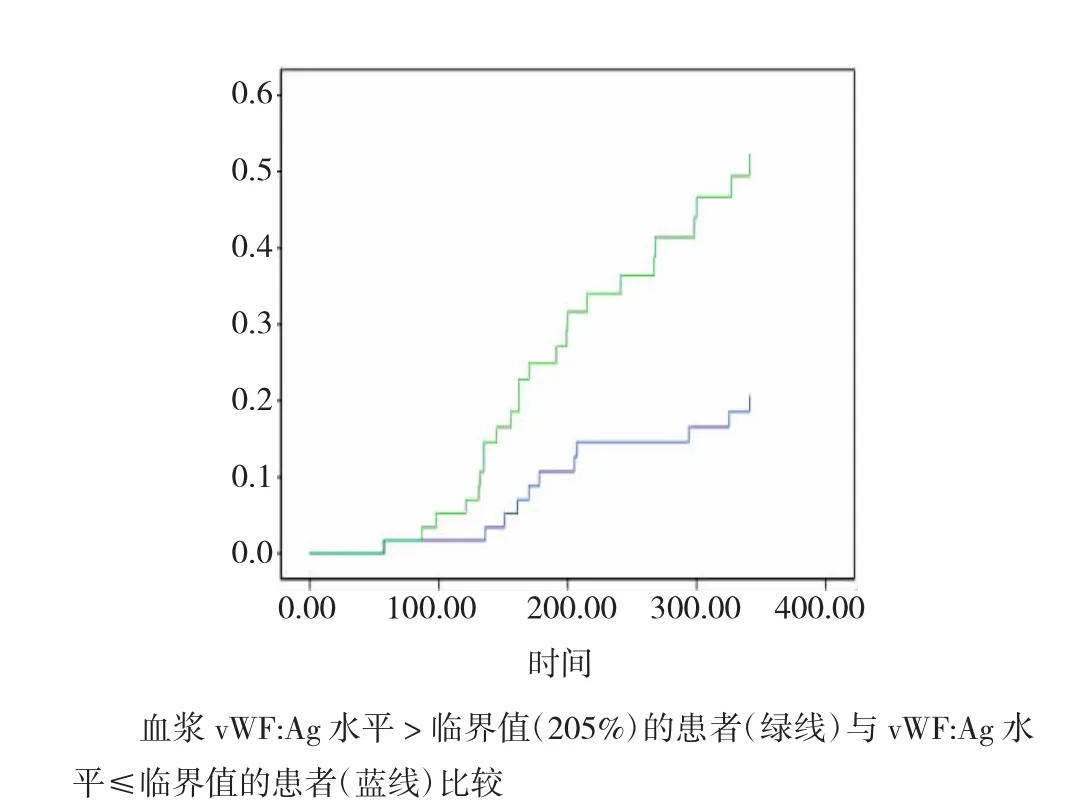
图2 中心性肥胖组患者不良心血管事件累积风险
2.5 vWF:Ag水平评估肥胖患者不良心血管事件风险Cox比例回归模型
评价vWF:Ag与其他因素对患者预后的影响,单因素筛选分析结果,见表2。
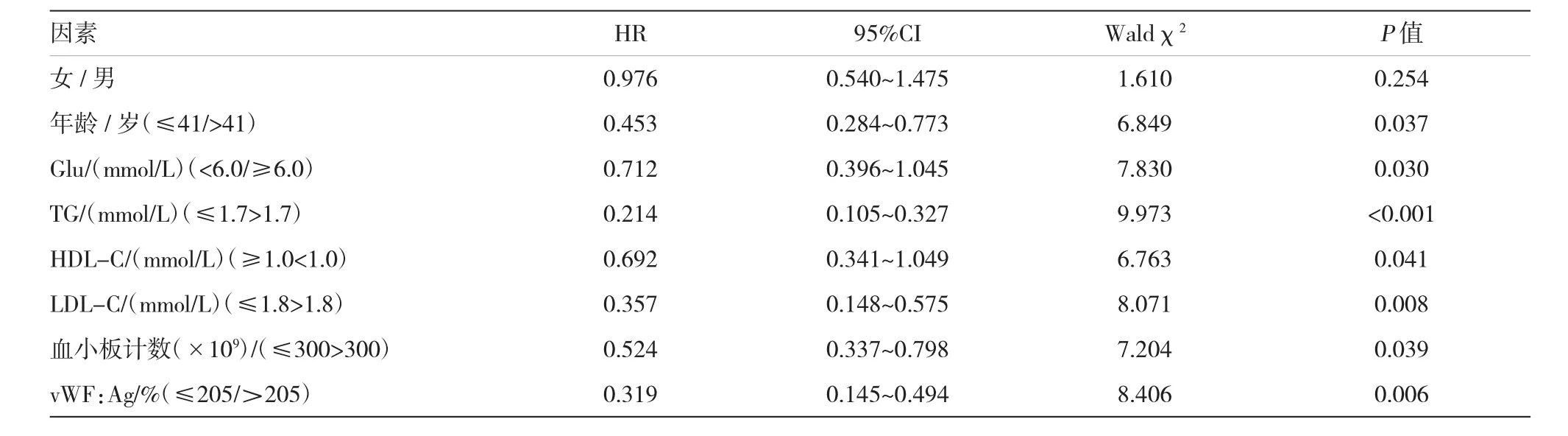
表2 中心性肥胖患者的Cox回归模型单变量分析
对经单因素筛选分析后P<0.05的因素进行Cox比例风险模型多因素分析,结果显示,年龄、三酰甘油、LDL-C、血小板计数和vWF:Ag是中心性肥胖患者1年内不良心血管事件的风险因素,见表3。
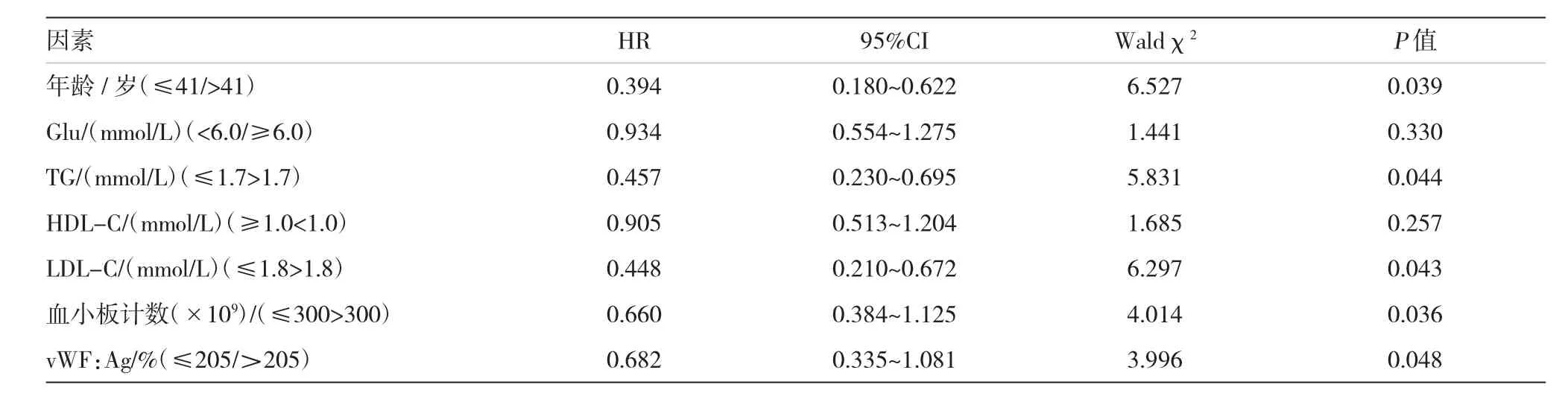
表3 中心性肥胖患者的多元Cox回归模型分析
2.6 vWF:Ag水平与临床病理因素关联性分析
血浆vWF:Ag水平与性别和HDL-C无关联性(P>0.05),与其他临床病理因素均有关联性(P<0.05或P<0.01),见表4。
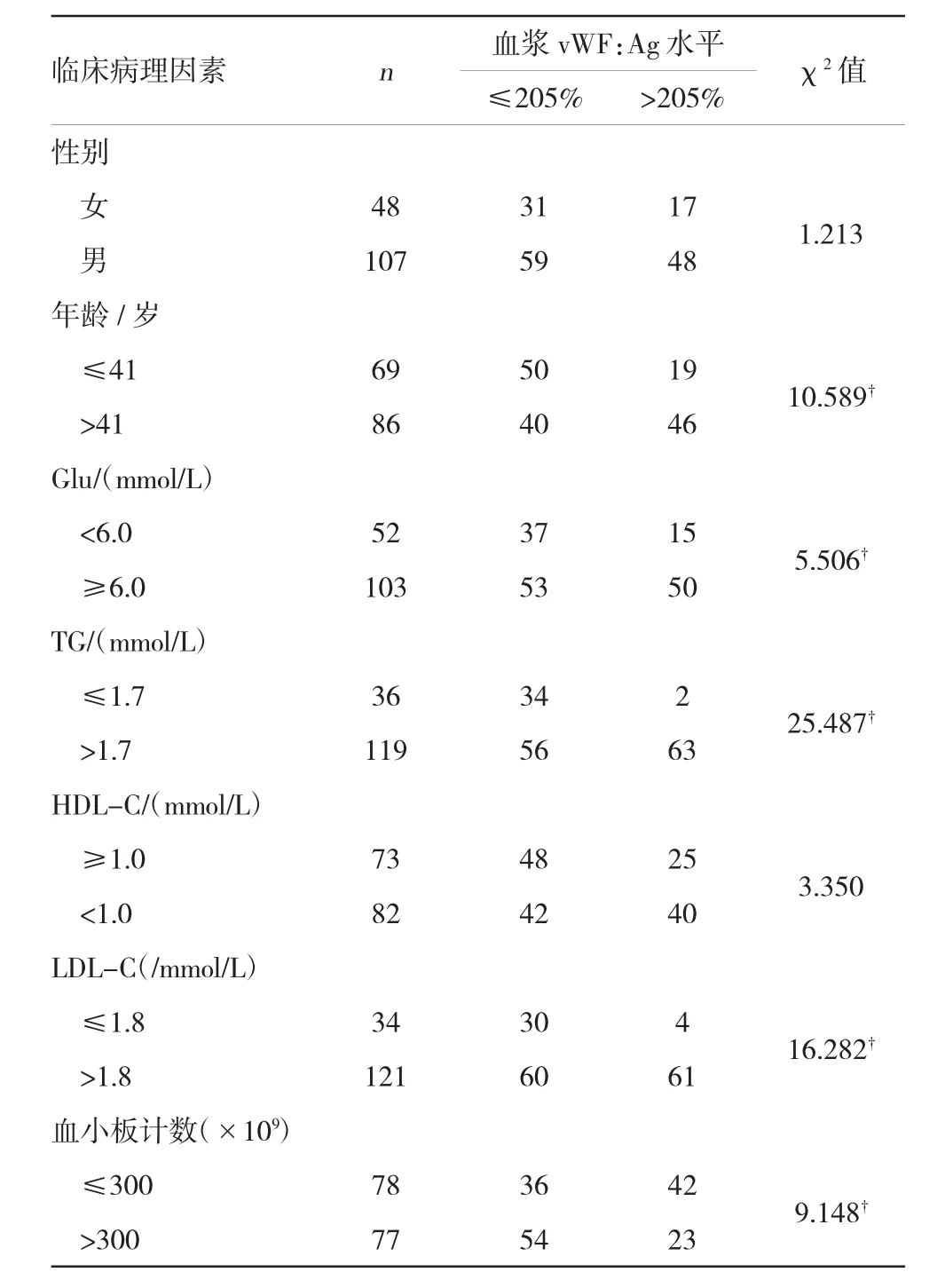
表4 中心性肥胖患者vWF:Ag水平与临床病理因素分析
3 讨论
vWF主要由血管内皮细胞合成释放,是介导血小板黏附聚集的关键因子,同时还具有保护凝血因子Ⅷ(FⅧ)并支持其活化的功能,当血管内皮细胞受损和功能紊乱时,血浆vWF:Ag水平显著增高并参与凝血系统活化[6]。
中心性肥胖与糖耐量受损,血脂异常和高血压均属于代谢综合征的重要特征,近期的研究发现,肥胖可在早期即造成血管内皮细胞的功能障碍[7-8],血浆vWF:Ag持续处于高水平的中心性肥胖患者多发生不良心血管事件。本研究结果显示,2个肥胖患者组vWF:Ag水平均高于健康对照组,其中中心性肥胖患者的血浆vWF:Ag水平高于非中心性肥胖患者,表明中心性肥胖患者血管损伤和功能紊乱程度更为严重,其原因与内皮细胞磷脂酰肌醇-3激酶信号转导通路受损[9]、一氧化氮(NO)生成与内皮素分泌失衡[10]、毛细血管血流量减少以及修复障碍等因素密切相关[11]。近年的研究表明,促进中心性肥胖患者发展为代谢综合征的多种病理过程(血管壁慢性炎性病变、胰岛素抵抗以及脂代谢紊乱)均可对血管内皮细胞产生损害[12-13],并最终反映在血浆vWF:Ag水平的变化上。本研究结果显示,中心性肥胖患者血浆vWF:Ag水平与多种临床病理因素(年龄、葡萄糖、三酰甘油、LDL-C和血小板计数等)均有显著的关联性,则进一步说明了血浆vWF:Ag水平的变化是多种病理因素共同对血管内皮细胞作用的结果。生存分析结果显示,血浆vWF:Ag水平增高的中心性肥胖患者在1年内的不良心血管事件发生概率显著增高。ROC结果显示,血浆vWF:Ag水平为205%(临界值)时,对中心性肥胖患者不良心血管事件具有良好的诊断性能。
KRAJA等[14]研究显示,FⅧ增高与代谢综合征病程发展显著相关,同时肥胖引发的代谢综合征、脂代谢紊乱、氧化应激和慢性炎性反应等均可引发血小板的活性改变[15-16],而vWF则在稳定或活化FⅧ、介导血小板黏附聚集方面产生重要作用,因此在血栓形成的启动阶段起关键作用。本研究表明,vWF:Ag是中心性肥胖患者1年内不良心血管事件的风险因素,提示持续血管损伤引发的高凝状态是导致患者不良临床结局的重要病理性因素,这种高凝状态同样也是构成代谢综合征的重要组成部分,并对患者形成更为致密的血栓凝块具有显著的促进作用[17]。
综上,中心性肥胖时由于血浆vWF:Ag水平因多重风险因素对血管壁的持续损伤而显著增高,并对高凝状态形成产生促进作用,是影响患者病情发展趋势的风险因素,检测血浆vWF:Ag可作为评估患者高凝状态以及远期不良临床结局的敏感方法。
[1]VAZZANA N,SANTILLI F,SESTILI S,et al.Determinants of increased cardiovascular disease in obesity and metabolic syndrome[J].Curr Med Chem,2011,18(34):5267-5280.
[2]ANFOSSI G,RUSSO I,TROVATI M.Platelet dysfunction in central obesity[J].Nutr Metab Cardiovasc Dis,2009,19(6):440-449.
[3]HERN魣NDEZ VERA R,VILAHUR G,FERRER-LORENTE R, et al.Platelets derived from the bone marrow of diabetic animals showdysregulatedendoplasmicreticulumstressproteinsthat contribute to increased thrombosis[J].Arterioscler Thromb Vasc Biol,2012,32(9):2141-2148.
[4]CHARAKIDA M,FINER N.Drug treatment of obesity in cardiovascular disease[J].Am J Cardiovasc Drugs,2012,12(2):93-104.
[5]ANDERSON JL,ADAMS CD,ANTMAN EM,et al.ACC/AHA 2007 guidelines for the management of patients with unstable angina/non-ST-Elevation myocardial infarction:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines(Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non-ST-ElevationMyocardialInfarction)developedin collaboration with the American College of Emergency Physicians, the Society for Cardiovascular Angiography and Interventions,and the Society of Thoracic Surgeons endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation and the Society for Academic Emergency Medicine[J].J Am Coll Cardiol, 2007,50(7):e105-e127.
[6]KRISHNAMOORTHY S,LIM SH,LIP GY.Assessment of endothelial(dys)function in atrial fibrillation[J].Ann Med,2009,41 (8):576-590.
[7]RASK-MADSEN C,LI Q,FREUND B,et al.Loss of insulin signaling in vascular endothelial cells accelerates atherosclerosis in apolipoprotein E null mice[J].Cell Metab,2010,11(5):379-389.
[8]TCHERNOF A,DESPR魪S JP.Pathophysiology of human visceral obesity:an update[J].Physiol Rev,2013,93(1):359-404.
[9]BARON AD,TARSHOBY M,HOOK G,et al.Interaction between insulin sensitivity and muscle perfusion on glucose uptake in human skeletal muscle,evidence for capillary recruitment[J]. Diabetes,2000,49(5):768-774.
[10]LTEIF A,VAISHNAVA P,BARON AD,et al.Endothelin limits insulin action in obese/insulin-resistant humans[J].Diabetes, 2007,56(3):728-734.
[11]KIM JA,MONTAGNANI M,KOH KK,et al.Reciprocal relationshipsbetweenIRandendothelialdysfunction:molecular and pathophysiological mechanisms[J].Circulation,2006,113(15): 1888-1904.
[12]RASK-MADSEN C,LI Q,FREUND B,et al.Loss of insulin signaling in vascular endothelial cells accelerates atherosclerosis in apolipoprotein E null mice[J].Cell Metab,2010,11(5): 379-389.
[13]SANCHEZ C,POGGI M,MORANGE PE,et al.Diet modulates endogenous thrombin generation,a biological estimate of thrombosis risk,independently of the metabolic status[J].Arterioscler Thromb Vasc Biol,2012,32(10):2394-2404.
[14]KRAJA AT,PROVINCE MA,ARNETT D,et al.Do inflammation and procoagulation biomarkers contribute to the metabolic syndrome cluster[J].Nutr Metab,2007,4:28.
[15]ANFOSSI G,RUSSO I,TROVATI M.Platelet dysfunction in centralobesity[J].Nutr Metab Cardiovasc Dis,2009,19(6): 440-449.
[16]SCH魧FER K,KONSTANTINIDES S.Adipokines and thrombosis [J].Clin Exp Pharmacol Physiol,2011,38(12):864-871.
[17]KOTRONEN A,JOUTSI-KORHONEN L,SEVASTIANOVA K, et al.Increased coagulation factor VIII,IX,XI and XII activities in non-alcoholic fatty liver disease[J].Liver Int,2011,31 (2):176-183.
vWF for risk evaluation of adverse cardiovascular events in patients of central obesity
Shu-juan OUYANG1,Ming CUI2
(1.Department of Blood Transfusion;2.Medical Laboratory,Hunan Cancer Hospital, Changsha,Hunan 410013,P.R.China)
【Objective】To investigate the changing characteristics of serum von Willebrand factor antigen(vWF: Ag)and the evaluation value for adverse cardiovascular events in patients of central obesity.【Methods】155 patients with central obesity were selected from 2010 to 2012 for retrospective cohort study,107 males and 48 females in the group,moreover 72 patients with non-central obesity were selected as obesity control,and 50 healthy subjects were selected as healthy control.Using the IL ACL-TOP 700 blood coagulation instrument assay the level of vWF: Ag.Using receiver operating characteristic curve(ROC)to analyze the diagnosis performance of vWF:Ag.Using Kaplan-Meier curve to implement survival analysis.Using Cox regression analysis model to evaluate the effect on prognosis.【Results】Compared the non-central obesity patients,the level of vWF:Ag was increased obviously in the central obesity patients group.The optimum cut-off point with vWF:Ag for adverse cardiovascular events diagnosis was 205%,the area under ROC curve=0.864(95%confidence interval:0.769~0.959),the cumulative risk of adverse cardiovascular events increased significantly within a year in the patients who over the cut-off value,the Cox analysis showed that the level of vWF:Ag was the independent risk factor for adverse cardiovascular events within a year.【Conclusion】The level of vWF:Ag was increased obviously in patients of central obesity,and there was closely related with adverse cardiovascular events,it might be as biomarker for hypercoagulative state and poor prognosis.
von Willebrand factor;obesity;cardiovascular diseases;ROC curve;Kaplan-Meiers estimate;proportional hazards models
1005-8982(2015)34-0039-05
R723.14
A
2015-06-13
崔明,E-mail:ouyanghn@126.com

