先天性长QT综合征2型hERG基因G604S突变真核表达载体的构建和表达*
韩稳琦,霍建华,李国良,蒋永荣,武金娥,孙超峰
西安交通大学第一附属医院心内科 西安 710061
先天性长QT综合征2型hERG基因G604S突变真核表达载体的构建和表达*
韩稳琦,霍建华,李国良,蒋永荣,武金娥,孙超峰#
西安交通大学第一附属医院心内科 西安 710061
关键词先天性长QT综合征;hERG基因;突变;真核表达载体
摘要目的:构建长QT综合征(LQTS)2型hERG 基因G604S突变的真核表达载体G604S-hERG-pcDNA3、G604S-hERG-pEGFP。方法:采用重叠延伸PCR法在pEGM-hERG基础上构建G604S突变体PGEM-hERG-G604S,通过限制性内切酶法和基因重组技术将突变体插入到真核表达载体pcDNA3和pEGFP-C2中并测序验证,用脂质体转染法将G604S-hERG-pEGFP转染至HEK293细胞并观察其荧光表达。结果:构建的含有突变位点的真核表达载体经DNA测序均成功验证hERG基因1 810位点碱基G突变为A,构建的G604S-hERG-pEGFP在HEK293细胞中成功表达绿色荧光。结论:成功构建hERG基因G604S-hERG-pcDNA3和G604S-hERG-pEGFP表达载体。
AbstractAim: To construct eukaryotic expression vectors G604S-hERG-pcDNA3 and G604S-hERG-pEGFP linked to LQT2.Methods: PGEM-hERG-G604S containing G604S fragment was constructed using pEGM-hERG as a template by overlap extension PCR and then validated by DNA sequencing, then hERG-G604S sequence was subcloned into pcDNA3 and pEGFP-C2 vectors using restriction enzymes and gene recombination technology, respectively. After sequencing, G604S-hERG-pcDNA3 and G604S-hERG-pEGFP expression vectors were transfected into HEK293 cells to obtain heterologous expression system.Results: G604S-hERG-pcDNA3 and G604S-hERG-pEGFP eukaryotic expression vectors were constructed successfully, a missense mutation in hERG 1 810 site nucleotide G mutant to A was identified using DNA sequencing,hERG mutant was correctly combined to eukaryotic expression vector pEGFP-C2 and expressing green fluorescent protein confusion mutant G604S in HEK293 cells.Conclusion: The protocol can be used to construct the eukaryotic expression vector G604S-hERG-pcDNA3 and green fluorescent protein expression vector G604S-hERG-pEGFP.
先天性长QT综合征(congenital long QT syndromes,cLQTS)为一种心肌离子通道病,是由于编码心肌离子通道蛋白的基因突变导致心肌细胞复极时间延长而触发的一组临床综合征。LQTS表现为心电图上T波异常,易发生尖端扭转型室性心动过速(torsades de pointes,TdP),从而导致晕厥和猝死等心血管恶性事件[1-2]。目前已证实12种基因与LQTS相关,hERG基因突变是引起中国人LQTS的最主要原因[1]。hERG基因定位于人类染色体7q35~36,编码1 159个氨基酸残基[3],参与形成完整的缓慢激活延迟整流钾电流快成分(Ikr)通道[4]。Ikr通道在心室肌细胞复极、维持心脏动作电位时程(APD)和调节心脏正常节律过程中发挥重要作用[5]。hERG突变使蛋白表达异常,Ikr通道功能降低或丧失,从而使动作电位时程延长,导致2型LQTS(LQT2)。作者所在的实验室在LQTS一家系中发现hERG基因第七外显子处1 810G→A突变,导致蛋白604位甘氨酸(G)→丝氨酸(S)的改变,即G604S突变[6],进而导致LQT2表型。该研究通过构建G604S-hERG-pcDNA3和G604S-hERG-pEGFP真核表达载体,以期阐明此突变的分子生物学特征及为该病的个体化治疗研究提供实验基础。
1材料与方法
1.1主要试剂与仪器质粒pEGM-hERG由BD Anson 博士(University of Wisconsin,USA)惠赠,质粒pMD19-T、限制性内切酶BstE Ⅱ和sdaⅠ、DNA连接酶均购于TaKaRa公司,pEGFP-C2购于Clontech公司,感受态细菌TOP10购自Promega公司,HEK293细胞取自西安交通大学环境与疾病教育部重点实验室。DNA片段回收试剂盒购自Qiagen公司,DMEM培养基购自Gibco公司,DNA ladder购自Fermentas公司,X-treme GENE HP DNA转染试剂、质粒提取试剂盒、SYBR Green Master(ROX)购自Roche公司。引物合成及测序由北京奥科生物技术有限责任公司完成。PTC-200DNA扩增仪为美国MJ公司产品,2000型凝胶成像系统为美国Biotech公司产品。
1.2hERG-G604S突变体的构建 应用重叠延伸PCR法制备hERG-G604S突变体。设计G604S突变体引物:①两条hERG基因外侧端引物,上游序列5’-GCCACGCCAGCACCGGGGCCATGC-3’和下游序列5’-GTGTGGTCTTGAACTTCATGGCCAGGGC-3’。②G604S突变的邻近引物,上游序列5’-CCT GGGCAGCCCCTCCATCAAGGACAAG-3’,下游序列5’-CTTGTCCTTGATGGAGGGGCTGCCCAGG-3’。共进行三步PCR反应,其中前两步分别扩增彼此重叠的DNA片段,片段大小分别为922 bp和486 bp;PCR 反应体系:缓冲液 10 μL,模板 2 μL,正向引物 1 μL,反向引物 1 μL,dNTP Mix 4 μL,STAR DNA 聚合酶 0.5 μL,调整总体积为50 μL。第三步PCR连接5’端和3’端DNA片段,并扩增出突变片段,片段长度为1 408 bp;反应条件:98 ℃ 2 min,98 ℃ 10 s,66 ℃ 20 s,72 ℃ 30 s;5个循环后在反应体系中分别加入1 μL的引物再进行25个循环,反应条件:98 ℃,2 min,98 ℃,10 s,66 ℃ 30 s,72 ℃ 90 s,72 ℃ 10 min,4 ℃ 30 min。将突变片段3’末端加A尾后连接到pMD19-T上,反应条件:PCR产物15 μL,加 A 反应液4 μL,Taq 酶1 μL,72 ℃保温30 min。产物经转化扩增后提质粒(pMD19-hERG-G604S)并行DNA测序。
1.3真核表达载体G604S-hERG-pcDNA3的构建
利用双酶切法将hERG-G604S突变体经基因重组技术插入具有氨苄青霉素抗性的表达载体pcDNA3-hERG中,利用氨苄青霉素抗性对重组子进行筛选,挑取单克隆菌种扩增后提取质粒并测序。使用DNAMAN软件,选用突变两端单一的BstE Ⅱ和sdaⅠ限制性内切酶对pMD19-hERG-G604S及pcDNA3-hERG同时进行酶切,产物进行琼脂糖电泳检测,于紫外线下切取前者的小片段(约1 056 bp)和后者的大片段部分(约8 244 bp),依回收试剂盒步骤回收产物后,利用T4 DNA聚合酶将两者进行连接,构建G604S-hERG-pcDNA3。经转化扩增后提取质粒并测序。
1.4绿色荧光表达载体G604S-hERG-pEGFP的构建利用双酶切法(EcoRⅠ和HindⅢ)切取G604S-hERG-pcDNA3中突变全目的hERG片段并插入具有Kana抗性的表达载体pEGFP-C2中,利用Kana抗性对重组子进行筛选,挑取单克隆菌种扩增后提取质粒并测序。选用EcoRⅠ和HindⅢ限制性内切酶对pMD19-hERG-G604S及pEGFP-C2同时进行酶切,紫外线下切取G604S-hERG-pcDNA3的小片段(约3 480 bp),pEGFP-C2在4 000 bp和5 000 bp之间显示一条带,依回收试剂盒步骤回收产物后利用T4 DNA聚合酶将两者进行连接,构建成G604S-hERG-pEGFP。经转化扩增后提取质粒并测序。
1.5HEK293细胞的培养及转染HEK293细胞用含体积分数10%胎牛血清的DMEM高糖培养基于6孔培养皿中培养,12 h后当细胞贴壁生长至70%~85%时,进行脂质体转染,转染混合物配比:G604S-hERG-pEGFP 4 μg,X-tremeGENE HP转染剂8 μL,转染24 h后活体细胞荧光显微镜下进行检测。
2结果
2.1G604S突变体的构建 第一步PCR产物电泳结果见图1上,可以观察到900 bp附近有一条很亮的条带,与所扩增的片段大小相符;第二步PCR产物电泳结果见图1中,可以观察到500 bp附近有一条很亮的条带,与所扩增的片段大小相符;第三步PCR产物电泳结果见图1下,可见1 200 bp和2 000 bp之间有一条很亮的条带,与连接的上下游片段全长大小相符,表明是第三步重叠PCR的产物。DNA测序(图2)显示hERG基因1 810处的碱基G变为A,而其他序列均无改变,表明突变成功。

图1 hERG-G604S PCR产物电泳图
M:Marker;1:目的基因;上、中、下:分别为第一、二、三步PCR产物。
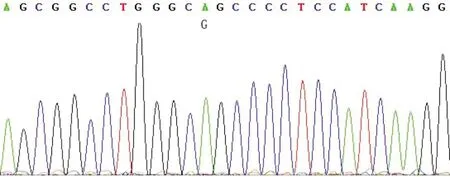
图2 PCR产物测序图
2.2G604S-hERG-pcDNA3的构建pMD19-hERG-G604S的限制性内切酶电泳结果见图3上,为含突变点的DNA片段(大小为1 056 bp)。pcDNA3-hERG的酶切电泳结果见图3下,为大小8 244 bp的目的片段。DNA连结后的测序结果(图4)表明G604S-hERG-pcDNA3的hERG基因1 810处的碱基G突变为A,而无其他序列的改变,表明G604S-hERG-pcDNA3构建成功。

图3 双酶切电泳图
1:目的基因;M:Marker;上:pMD19-hERG-G604S;下:pcDNA3-hERG。

图4 真核表达载体测序图
2.3G604S-hERG-pEGFP的构建pEGFP-C2和G604S-hERG-pcDNA3的酶切电泳结果见图5。pEGFP-C2产物大小在4 000 bp和5 000 bp之间;pcDNA3-hERG被切成两条带,表明酶切成功。连结后的DNA测序结果表明在G604S-hERG-pEGFP上存在突变(图6),转染HEK293细胞可见明显绿色荧光(图7),表明绿色荧光表达载体G604S-hERG-pEGFP构建成功。

图5 pEGFP-C2和G604S-hERG-pcDNA3的双酶切电泳图
M:Marker;1:pEGFP-C2双酶切;2:G604S-hERG-pEGFP双酶切。
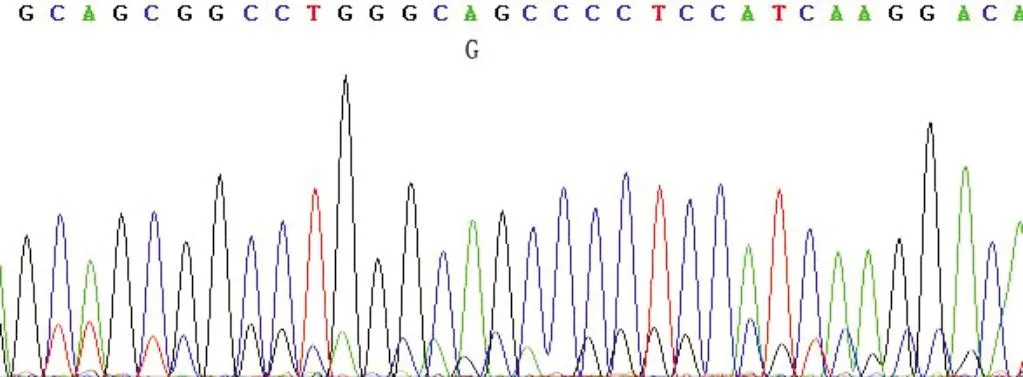
图6 G604S-hERG-pEGFP测序图
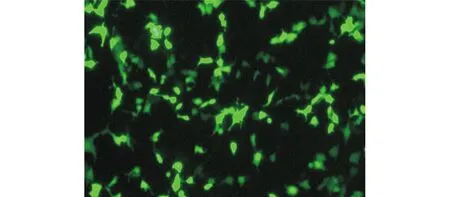
图7 G604S-hERG-pEGFP转染HEK293(×10)
3讨论
cLQTS发病突然,猝死率高。我国以LQT2型为主,占到总LQTS的近1/2,为编码心脏离子通道的hERG基因发生突变,导致膜蛋白功能异常从而致动作电位复极时程延长而表现为晕厥或猝死的一种临床综合征[7]。近年来对该疾病基因型和表现型关系研究的突破性进展及分子细胞生物学技术的迅猛发展,使LQTS成为心脏离子通道研究领域的热点。构建突变基因表达载体是研究突变后离子通道功能及个体化治疗研究的关键环节。
体外定点诱变技术是研究基因突变和蛋白质结构及功能之间复杂关系的重要方法,已广泛应用于基因的表达修饰和调控、结构与功能及蛋白表达等诸多研究领域。重叠延伸PCR法构建突变体目前应用最为广泛,因其不受突变位置及突变类型的限制,不仅能实现基因点突变,而且能实现大片段的插入及缺失突变。此方法最大优点是构建突变简单易成。作者在该实验中,首先通过重叠延伸PCR法构建了含有G604S突变点的hERG基因片段,然后采用双酶切法将突变片段和野生型hERG基因切成黏性末端,最后利用基因重组技术构建G604S-hERG-pcDNA3真核表达载体,通过DNA测序比对证实真核表达载体构建成功。
近年,基因突变相关研究中广泛采用将目的基因插入到pEGFP基因表达载体中,构建成表达绿色荧光融合蛋白的重组质粒,在荧光显微镜下直观目的蛋白的表达、转运和定位的变化。绿色荧光融合蛋白(green fluorescent protein,GFP)是一种新型报告分子,是目前在细胞生物学研究和开发应用中最广泛的蛋白质之一,其敏感性强、性质稳定,且容易检测。增强型GFP(EGFP)是一种相对分子质量较小并优化的GFP,其内源荧光基团在蓝光激发时可高效发射明亮的绿色荧光,是普通GFP效率的30余倍,EGFP与外源蛋白N端或C端均可融合,且不影响目的蛋白的表达和转运,便于观察和检测目的蛋白在活体细胞或组织中的表达、定位及细胞间的转运[8]。Huang等[9]在LQT2的研究中也证实pEGFP对hERG的表达和定位均无影响。该研究利用双酶切法和基因重组技术成功构建了绿色荧光真核表达载体G604S-hERG-pEGFP,为后续hERG-G604突变基因功能检测和分析提供了实验工具。作者采用无内源性Ikr通道蛋白表达的人胚胎肾祖细胞(HEK293细胞)[10],结果显示重组的真核表达载体成功转染入HEK293细胞中,绿色荧光蛋白表达丰富,表明突变的目的基因和EGFP形成的融合蛋白在HEK293细胞中成功表达。
总之,此突变表达载体构建的成功为进一步阐明hERG基因G604S突变导致LQTS发病机制及个体化药物筛选拯救研究奠定了基础。
参考文献
[1]张萍.长QT综合征临床分型及意义[J].中国实用内科杂志,2013,33(1):13
[2]韩雅玲,姚天明.心血管内科新进展及展望[J].解放军医学杂志,2010,35(4):355
[3]Curran ME, Splawski I, Timothy KW, et al. A molecular-basis for cardiac-arrhythmia-hERG mutations cause long QT Syndrome[J].Cell,1995,80(5):795
[4]Abbott GW, Sesti F, Splawski I, et al. MiRP1 forms I-Kr potassium channels with hERG and is associated with car-diac arrhythmia[J].Cell,1999,97(2):175
[5]Sanguinetti MC,Tristani-Firouzi M.hERG potassium channels and cardiac arrhythmia[J].Nature,2006,440(7083):463
[6]Zhang Y,Zhou N,Jiang W,et al.A missense mutation(G604S) in the S5/pore region of HERG causes long QT syndrome in a Chinese family with a high incidence of sudden unexpected death[J].Eur J Pediatr,2007,166(9):927
[7]李翠兰,胡大一.长QT 综合征的基因检测及诊疗进展[J].江西医药,2012,47(5):416
[8]石秦东,张蓬勃,康前雁,等.以 EGFP 为报告基因的增强子鉴定质粒载体的构建及鉴定[J].南方医科大学学报,2007,27(12):1834
[9]Huang N,Lian JF,Huo JH,et al.The EGFP/hERG fusion protein alter the electrophysiological properties of hERG channels in HEK293 cells[J].Cell Biol Int,2011,35(3):193
[10]李宇,崔长琮,赵永辉,等.先天性长QT综合征相关人类HERG基因真核表达载体的构建及其功能表达[J].西安交通大学学报:医学版,2006,27(4):344
*国家自然科学基金资助项目31071923
Construction and expression of congenital LQT2 relating hERG gene G604S mutation eukaryotic expression vector
HANWenqi,HUOJianhua,LIGuoliang,JIANGYongrong,WUJin′e,SUNChaofeng
DepartmentofCardiovascularDiseases,theFirstAffiliatedHospital,Xi′anJiaotongUniversity,Xi′an710061
Key wordscongenital long QT syndrome;hERG gene;mutation;eukaryotic expression vector
doi:10.13705/j.issn.1671-6825.2015.06.007
中图分类号R541
通信作者#,男,1966 年11 月生,博士,教授,研究方向:心脏起搏与电生理,E-mail:csun1@163.com