两种检测方法对71例非综合征型耳聋患者基因检测结果的对比分析
韩锐?李林格?段玲?夏燕?陈俞
[摘要] 目的 使用两种不同的检测方法对71例非综合征型耳聋患者进行耳聋基因的检测,为临床提供更多有意义的突变筛查位点,提高耳聋致病基因的检出率。 方法 收集自2014年7月~2015年12月的71例中重度感应性神经性耳聋患者,使用芯片杂交和多重荧光PCR两种不同的方法对71例非综合征型耳聋患者进行耳聋基因的检测,利用统计学分析软件SPSS17.0进行数据的统计学分析。 结果 两种方法对71例非综合征型耳聋患者耳聋基因的筛查率存在显著差异(P<0.05)。芯片杂交法对71例患者致聋基因检出率为14.08%(10/71),多重荧光PCR方法对71例患者致聋基因的检出率为30.98%(22/71)。两种方法检测的耳聋基因致病突变位点不同,导致检出率的显著差异。 结论 与芯片检测方法相比多重荧光PCR方法中增加的检测位点,对于提高临床耳聋致病基因的筛查率是有意义的。
[关键词] 耳聋;基因;突变;检出率
[中图分类号] R764.43 [文献标识码] A [文章编号] 2095-0616(2016)20-07-05
Contrast analysis of test results of two kinds of detection methods in 71 cases of non-syndromic deafness patients
HAN Rui1 LI linge2 DUAN Ling1 XIA Yan1 CHEN Yu2
1. Prenatal Diagnosis Center, the First Affiliated Hospital of Xinjiang Medical University, Urumqi 830054, China;
2. Department of E.N.T. , the First Affiliated Hospital of Xinjiang Medical University, Urumqi 830054, China
[Abstract] Objective Using two different of methods to test 71 cases of non-syndromic deafness patients about the deafness gene, to provide more meaningful screening for clinic, to improve the deafness gene detection rate. Methods 71 cases of non-syndromic deafness patients from July 2014 to December 2015 were selectrd as the study objects. Chip hybridization and multiple fluorescent PCR two different methods were used to test the 71 cases of non-comprehensive deafness patients about deafness gene, and SPSS17.0 software was used for the data analysis. Results There were significant diffience between the two kinds of methods for 71 cases of non-syndromic deafness patients (P<0.05). The deafness gene detection rate of chip hybridization method was 14.08% (10/71) , and the deafness gene detection rate of multiple fluorescent polymerase chain reaction (PCR) method was 30.98 (22/71) . Deafness gene's mutation site of the two methods was different, which led to a significant difference in detection rate. Conclusion Compared with chip detection method , increasing testing site in multiple fluorescent polymerase chain reaction ( PCR ) is meaningful for improving the clinical deafness gene screening rate .
[Key words] Deafness; Genes; Mutation; Detection rate
耳聾(HL)是人类最常见的致残原因之一,严重影响了人类的生活质量。造成耳聋的原因有很多,创伤和药物或遗传和环境因素共同作用都会导致耳聋的发生[1-2]。全球新生儿耳聋的发病率约为1/1000,50%以上的耳聋是由于遗传因素导致的[2-3]。在遗传性耳聋中,大约有70%的患者除耳聋外不伴有其他症状,称为非综合征型聋,其余30%是伴有其他器官或功能异常的耳聋,称为综合征型耳聋[4]。
目前临床上针对非综合征型耳聋患者耳聋基因突变的检出率低于50%。许多我们暂时无法检出的少见突变导致的非综合征型耳聋,增加了临床病因诊断的难度。
非综合征型耳聋基因定位已超过177个基因座,涉及100多个基因的1000多个突变位点(http:// hereditaryhearingloss.org/,updated in June 2016)。非综合征型耳聋涉及的基因较多,从临床筛查实用性以及检测结果时效性的角度出发,我们无法将所有已知的耳聋基因都进行检测,因此我们就需要选择覆盖人群范围更多,突变频率更高的位点进行检测。大量研究表明,虽然耳聋基因具有较高的基因和位点异质性,但大部分非综合征性耳聋多由少数几个热点基因突变引起,包括GJB2基因、SLC26A4基因和线粒体12S rRNA基因等,这使得遗传性耳聋的筛查成为可能[5-8]。
本研究选取71例非综合症型耳聋患者,采用了两种不同的检测方法对耳聋患者进行了耳聋基因突变位点的检测,方法一:采用了博奥生物有限公司生产的晶芯?HybSetTM基因微阵列芯法,该芯片检测了GJB2、SLC26A4和12S rRNA3个耳聋基因的8个突变位点。方法二:使用天昊生物有限公司的AccuCopy多重基因拷贝数检测技术,该技术检测了GJB2、SLC26A4和12S rRNA3个耳聋基因的124个突变位点。比较两种方法对临床耳聋基因检测的差异和临床意义。
1 资料与方法
1.1 一般资料
本研究收集了自2014年7月~2015年12月之间的71例中重度感应性神经性耳聋患者。其中25例是来自新疆维吾尔自治区喀什市残联的维吾尔族患者,其余46例是新疆医科大学第一附属医院门诊的散发汉族患者。通过填写调查问卷和询问病史的方式掌握课题参与者的病史及家族史资料,并建立详实的病例档案。病例内容包括患者基本信息、耳聋病史、家族史、聋儿出生史、用药史、个人史等。所有参与课题研究的患者都进行耳鼻喉专科检查、纯音听阈测试。对耳聋的分级为:听力正常<20dB nHL;轻度听力损失21~40dB nHL;中度听力损失41~70dB nHL;重度听力损失71~95dB nHL;完全听力损失>95dB nHL,测听频率分别为0.5、1、2、和4kHz[9]。所有的患者都是散发并且无血缘关系,否认环境和外伤因素所致的耳聋,听力检测表现为中重度以上感音神经性聋,认定耳聋患者为非综合征型聋。每一个先证者和他们的家庭成员,都签署了参与此项研究的知情同意书,此项研究经过新疆医科大学第一附属医院人文伦理委员会批准。
1.2 研究方法
对被检测者抽取外周静脉血3~5mL, 采用“天根生化DP319”全血基因组提取试剂盒提取基因组DNA,步骤参照试剂盒提供的使用说明进行。
方法一:采用带有Tag标签序列的基因位点特异性引物对基因组DNA相关基因位点所在的基因片段进行扩增和荧光标记,然后与能够识别相应标签序列的通用基因芯片进行杂交。使用晶芯?HybSetTM基因微阵列芯片扫描仪和相应的遗传性耳聋基因检测芯片判别系统进行GJB2基因、SLC26A4基因、线粒体12 SrRNA基因突变的检测,操作按博奥生物有限公司生产试剂盒说明书进行。
方法二:使用天昊生物有限公司的AccuCopy多重基因拷贝数检测技术对受试者基因组DNA进行耳聋基因的检测。按照天昊生物提供的SNPscan耳聋检测实验操作流程,完成71位受试者基因组DNA的连接反应、多重荧光PCR、PCR产物上机(ABI3130XL)测序过程,获得71位受试者的测序结果,测序的原始数据用GeneMapper 4.0 (美国应用生物系统公司) 分析,最终得到71位受试者GJB2基因、SLC26A4基因、线粒体12 SrRNA基因突变位点的结果。所有的候选突变都通过Sanger测序证实,利用患者和家庭成员之间的样品分离分析鉴定致病性的突变。
1.3 统计学分析
采用SPSS17.0软件对数据进行统计学分析,组间比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两种筛查方法耳聋基因的检出率
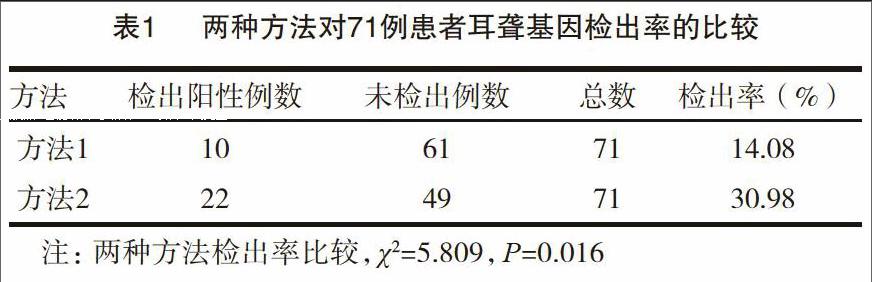
本研究分别用两种耳聋基因筛查方法对71例患者进行了耳聋基因的检测。每种方法的检出率如表1所示。71例耳聋患者博奥芯片的耳聋基因检出率为14.08%(10/71),天昊生物的耳聋基因检出率为30.98%(22/71)。
2.2 两种筛查方法检测出的突变位点
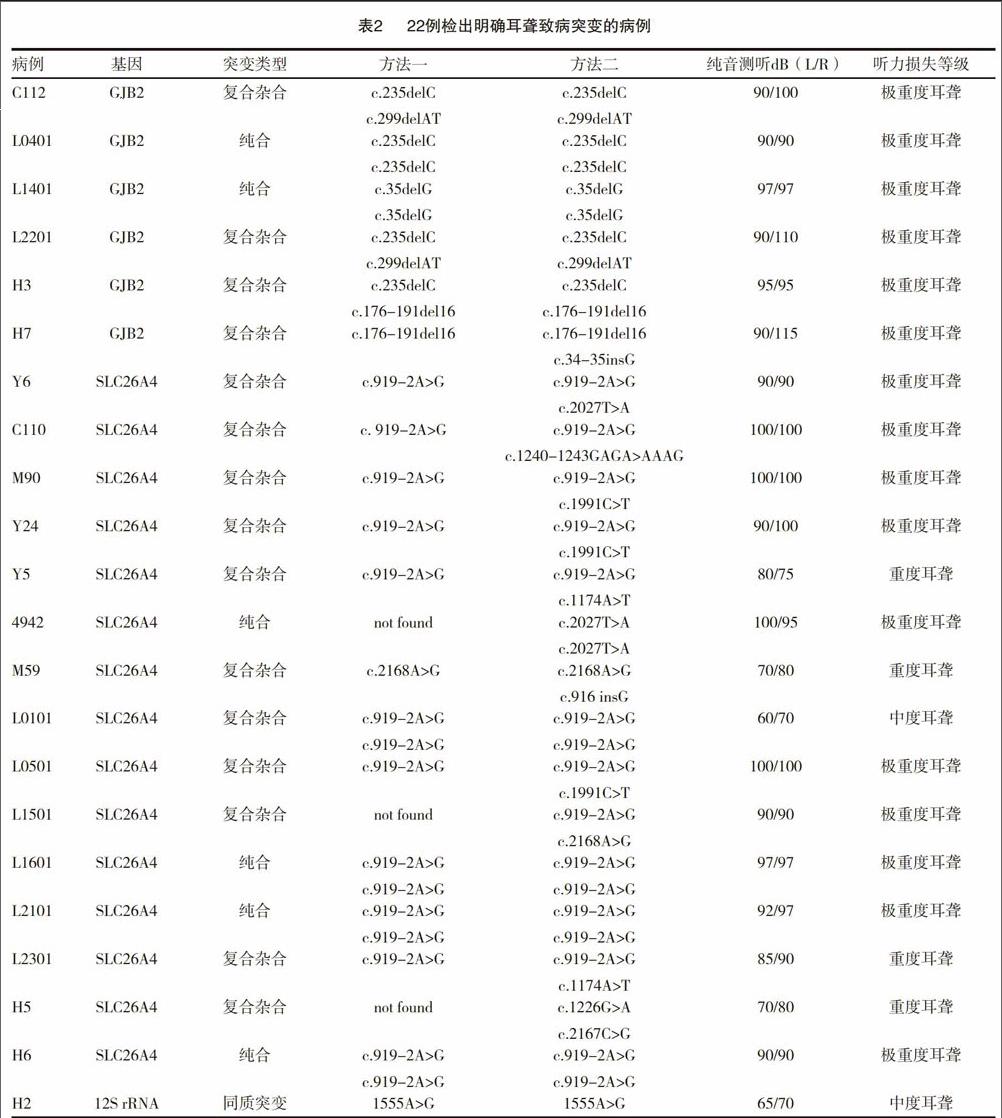
使用统计学分析软件SPSS17.0进行数据的统计学分析,两种方法对71例非综合症型耳聋患者直接致聋基因突变的检出率存在明显差异(P<0.05)。方法一检测了GJB2基因、SLC26A4基因、线粒体12S rRNA基因中8个常见突变位点,检出率为14.08%(10/71)。使用方法二对71例样本重新进检测,检测了GJB2基因、SLC26A4基因以及12S rRNA基因中124个突变位点,检出率为30.98%(22/71)。方法二与方法一比较,对公认的突变异质性较高的SLC26A4基因增加了75個突变位点的检测,对GJB2基因增加了27个突变位点的检测。22例检出明确耳聋致病突变的病例数据见表2。
3 讨论
遗传性耳聋具有较高的遗传异质性。截止到2016年6月,有110个致病基因被克隆,包括DFNA相关基因34个,DFNB相关基因69个,DFN相关基因4个,线粒体相关基因2个;共包含突变2000余种(http://hereditaryhearing loss.)[10]。引起遗传性耳聋的基因按功能分为影响离子动态平衡、毛细胞结构、细胞骨架运动、蛋白酶、转录因子基因调节和线粒体功能等。鉴定遗传性耳聋相关基因对分析内耳的不同分子通路和功能结构非常有帮助。除去遗传学上的异质性,由于基因突变位置和类型的不同,同一基因在表达上也有一定的差异,例如感音神经性耳聋基因能够产生显性或隐性的表型。上述现象的存在,使得遗传性耳聋的基因诊断非常困难。尽管如此,GJB2、SLC26A4和12S rRNA这三个基因及其突变在遗传性耳聋发病中起到至关重要的作用,常作为耳聋基因诊断的首选。GJB2基因突变在世界多数人群中与50%以上的中度至极重度先天性聋相关[11-13];SLC26A4基因突变与4.6%~12.4%的重度以上先天性聋相关[14],在亚洲SLC26A4基因突变中,80%的患者存在前庭导水管扩大和耳蜗Mondini畸形[15-17];12S rRNA基因与0.6%~8.5%应用氨基糖甙类类抗生素致聋相关。针对上述三个致聋基因进行检测,可以最大程度上提高致聋基因的检出率。因此我们在方法2中选择对这三个致聋基因进行更多突变位点的检测,提高遗传性聋的基因突变检出率。
本次研究中使用了两种不同的检测方法对71例双侧感音神经性耳聋患者进行耳聋基因突变的检测,两种方法的基因突变检出率存在显著差异(P<0.05)。方法一的耳聋基因致病突变检出率为14.08% (10/71),方法二的耳聋基因致病突变检出率为30.98%(22/71)。两种检测方法收费一样,但是检出率存在显著差异。针对实验结果我们认为,耳聋基因筛查方法应该选择费用更低,检出率更高,更经济有效的方法进行。方法二与方法一比较,对公认的突变异质性较高的SLC26A4基因增加了75个突变位点的检测,对GJB2基因增加了27个突变位点的检测,正是因为这些检测突变位点的增加才大大提高了耳聋致病基因突变的检出率。明确病因对临床治疗和病人的管理是非常重要的,因此我们认为方法二中增加的检测位点是有临床意义的。
本研究中检测出的22例耳聋患者中,GJB 2基因纯合突变致病的2例,GJB 2基因复合杂合突变致病的4例,SLC26A4基因纯合突变致病的5例,SLC26A4基因复合杂合突变致病的10例,12S rRNA纯合突变1例,该患者在使用氨基糖甙类药物后听力完全损失。由检测结果可以看出SLC26A4基因突变致聋在检测出明确致聋突变中占68%(15/22)。其中SLC26A4 c.919-2A>G(IVS7-2)是最常见的致病突变(11例)此结果与文献报道基本相符[18-20]。此外本研究还检出多个非热点的致病突变位点,如2027T>A(2例)、1240-1243GAGA>AAAG(1例)、1991C>T(3例)、1174A>T(2例)、916 insG (1例)、、1226G>A(1例)、2167C>G (1例)[21-22]。这些错义突变、移码突变、外显子剪切点及附近区域发生的突变等可能导致该基因无法准确翻译表达出功能正常的蛋白,导致前庭导水管扩大及感音神经性耳聋的疾病表现。同时,因为这些相对少见的致病突变类型没有规律的分布于基因各个外显子区段,简单的通过“突变热点”筛查来判断前庭导水管扩大患者致聋基因的方法,很可能造成一部分SLC26A4基因突变致聋的前庭导水管扩大患者的漏診。本次研究中的71例患者就有49例未检测出明确已知耳聋致病基因,我们不能排除某些罕见不在我们检测范围内的突变导致的耳聋。因此,我们建议针对前庭导水管扩大的耳聋患者,如“突变热点”筛查发现单杂合突变时,我们建议对这类患者进行SLC26A4基因全部外显子的测序以寻找另一突变位点,以便明确其致聋原因[23]。
[参考文献]
[1] Fraser GR.The Causes of Profound Deafness in Childhood[J].Ciba Found Symp,1970, 46(15):1438-1450.
[2] Morton NE. Genetic epidemiology of hearing impairment[J]. Ann N Y Acad Sci,1991,630:16-31.
[3] Marazita ML, Ploughman LM, Rawlings B, et al. Genetic epidemiological studies of early-onset deafness in the US school-age population[J]. Am J Med Genet,1993,46(5):486-491.
[4] Van Camp G, Willems P,Smith RJ.Nonsyndromic hearing impairment: unparalleled heterogeneity[J]. Am J Hum Genet,1997,6(4):758-764.
[5] Gardner P, Oitmaa E, Messner A, et al. Simultaneous multigene mutation detdction in patients with sensorineural hearing loss through a novel diagnostic microarray: a new approach for newborn screening follow up [J]. Pediatrics,2006,118(3):985-994.
[6] Siemering K, Manji SS, Hutchison W, et al. Detection of mutations in genes associated with hearing loss using a microarray based approach[J].J Mol Diagn,2006,8(4):483-489.
[7] Hilgert N, Smith RJ, Van Camp G. Function and expression pattern of nonsyndromic deafness genes[J].Curr Mol Med, 2009, 9(5):546-564.
[8] Ouyang XM, Yan D, Yuan HJ, et al. The genetic bases for non-syndromic hearing loss among Chinese[J].J Hum Genet, 2009, 54(3):131-140.
[9] Lutman ME, Coles RR.Asymmetric sensorineural hearing thresholds in the non-noise-exposed UK population: a retrospective analysis[J]. Clin. Otolaryngol,2009,34(3):316-321.
[10] Y Chen,M Tudi,J Sun,et al.Genetic mutations in non-syndromic deafoess patients of Uyghur and Han Chinese ethnicities in Xinjiang, China: a comparative study[J]. J Transl Med,2011, 9:154.
[11] Cohn ES, Kelley PM. Clinical phenotype and mutations in connexin 26 (DFNB1/GJB2,the most common cause of childhood hearing loss[J].Am J Med Genet.1999,89(3):130-136.
[12] P Guilford, S Ben Arab, S Blanchard,et al.A non-syndrome form of neurosensory, recessive deafness maps to the pericentromeric region of chromosome 13q[J]. Nat Genet,1994,6(1):24-28.
[13] M Trabelsi,W Bahri, M Habibi,et al.GJB2 and GJB6 screening in Tunisian patients with autosomal recessive deafiiess[J].Int J Pediatr OtorhinolaryngoL,2013,77(5):714-716.
[14] Du W, Guo Y, Wang C, et al.A systematic review and meta-analysis of common mutations of SLC26A4 gene in Asian populations[J]. Int J Pediatr Otorhinolaiyngol,2013,77(10):1670-1676.
[15] Yuan Y, You Y, Huang D,et al.Comprehensive molecular etiology analysis of nonsyndromic hearing impairment from typical areas in China[J].J Transl Med,2009,7:79.
[16] K Tsukamoto,H Suzuki, D Harada ,et al.Distribution and frequencies of PDS (SLC26A4) mutations in Pendred syndrome and nonsyndromic hearing loss associated with enlarged vestibular aqueduct: a unique spectrum of mutations in Japanese[J]. Eur J Hum Genet,2003,11(12):916-922.
[17] Park HJ, Shaukat S, Liu XZ,et al.global implications for the epidemiology of deafness[J]. J Med Genet,2003,40(4):242-248.
[18] Kelley PM, Harris DJ, Comer BC, et al. Novel mutations in the connexin 26 gene (GJB2) that cause autosomal recessive (DFNB1) hearing loss[J]. Am J Hum Genet,1998,62(4):792-799.
[19] 張国正. 中国人群特异的耳聋相关基因SLC26A4基因新变异致病性鉴定及其致聋机制研究[M]. 河北医科大学,2012.
[20] 戴朴,袁永一,康东洋,等. 1552 例中重度感音神经性聋患SLC26A4基因外显子7和8序列测定及热点突变分析[J]. 中华医学杂志,2007,87(36):2521-2525.
[21] 袁永一,王国建,黄德亮,等. 大前庭水管相关SLC26A4基因热点突变区域筛查方案探讨[J]. 中华耳科学杂志,2010,8(3):292-295.
[22] Wang QJ, Zhao YL, Rao SQ, et al. A distinct spectrum of SLC26A4 mutations in patients with enlarged vestibular aqueduct in China[J]. Clin Genet 2007,72(3):245-254.
[23] 王淑娟,梁鹏飞,王剑,等. 50个聋儿家庭再生育前的基因突变分析研究[J]. 中华耳科学杂志,2015,1:97-100.

