N-乙酰半胱氨酸对犬细小病毒诱导的MDCK细胞凋亡及活性氧的影响
邱先帅,张 浩,肖熹玉,任常宝,唐兆新,*(.华南农业大学兽医学院,广东广州5064;.肇庆大华农生物药品有限公司,广东肇庆5638)
N-乙酰半胱氨酸对犬细小病毒诱导的MDCK细胞凋亡及活性氧的影响
邱先帅1,张浩1,肖熹玉1,任常宝2,唐兆新1,2*
(1.华南农业大学兽医学院,广东广州510642;2.肇庆大华农生物药品有限公司,广东肇庆526238)
摘 要:为探讨N-乙酰半胱氨酸(25μg/mL)对犬细小病毒侵染MDCK细胞的保护作用,采用噻唑兰比色法来检测NAC对染毒MDCK细胞增殖率的影响,流式细胞术检测NAC对染毒MDCK细胞凋亡率及活性氧ROS水平。结果表明,与对照组相比,染毒组细胞增殖显著下降(P<0.05),而NAC组细胞增殖显著高于攻毒组(P<0.05);染毒组细胞凋亡率显著上升,胞内ROS水平显著升高(P<0.05),呈时间-效应关系,但NAC组明显减轻上述情况。NAC可通过降低ROS的产生从而改善染毒的MDCK细胞凋亡,对细胞起到保护作用。
关键词:犬细小病毒;N-乙酰半胱氨酸;增殖率;细胞凋亡;活性氧
近年来,宠物犬的数量逐年递增,对犬细小病毒的防治还是以弱毒苗免疫为主,但其效果越来越差,给犬细小病毒的防治带来一定压力[1]。犬细小病毒(Canine parvovirus,CPV)是细小病毒科,细小病毒属的单链DNA病毒,以出血性肠炎、脱水和心肌炎等为主要症状,该病首次在美国发现,是目前影响养犬业和宠物业健康发展的重要疫病之一,发病率高达100%[2-4]。体外研究表明,CPV 能在体外培养的犬细胞和猫细胞中感染,如犬肾细胞(MDCK)。犬细小病毒侵入细胞后,利用细胞内物质进行自身复制,刺激宿主细胞,使细胞内活性氧含量增加,过量的活性氧对细胞内线粒体造成结构和功能性的氧化损伤,激发细胞凋亡程序,从而引起细胞凋亡[5]。N-乙酰半胱氨酸(N-acetylcysteine,NAC)是一种抗氧化剂,作为半胱氨酸的衍生物,具有较强的抗氧化功能、干扰自由基生成、抗细胞凋亡等作用[6-7],从而起到保护细胞作用。本研究通过建立犬细小病毒侵染MDCK细胞模型,观察NAC对病毒引起的细胞凋亡的抑制作用。
1 材料与方法
1.1材料
1.1.1细胞和病毒 犬细小病毒由肇庆大华农生物药业有限公司保存,MDCK细胞为肇庆大华农生物药业有限公司产品。
1.1.2试剂及相关材料 DMEM培养基、2.5g/L胰酶-EDTA溶液为GIBCO公司产品;胎牛血清为Hyclone公司产品;噻唑兰、维生素C、N-乙酰半胱氨酸为Sigma公司产品;活性氧试剂盒为凯基生物公司产品;Annexin V-FITC/PI试剂盒为美国BD公司产品。
1.2方法
1.2.1细胞培养及攻毒 用含100mL/L胎牛血清的DMEM培养液,在37℃、体积分数为5% CO2的培养箱中培养MDCK细胞,待细胞长满单层后,用2.5g/L胰蛋白酶进行消化,镜下观察,细胞收缩变圆后弃去胰酶,加入培养液轻轻吹打细胞,1∶6进行传代,传3代稳定后进行试验。试验分组:正常对照组,以DMEM+100mL/L FBS完全培养液培养;病毒组,按培养液量的100g/L将犬细小病毒接种于细胞;试验组,以10%接毒量培养24h后换2%维持液事先配好的25μg/mL NAC继续培养。
1.2.2细胞增殖测定 常规消化MDCK细胞,通过细胞计数调至细胞数为1×106个/mL,同步接毒接入96孔细胞培养板,每孔100μL,24h长满单层后,弃去孔内培养液,细胞对照组和病毒组加100μL 2%维持液、试验组加100μL NAC,每个组重复4孔,分别培养24、48h后,加入20μL/孔MTT试剂,孵育4h后弃去,加入150μL/孔二甲基亚砜充分溶解,于490nm波长处测定OD值。
1.2.3MDCK细胞凋亡率的测定 将MDCK细胞常规消化接种于6孔板(1×106个/mL),同步接毒培养24h后,进行试验分组,分别于24h、48h消化收集细胞于离心管中,4℃、1 500r/min离心5min,用4℃PBS洗两次后,按Annexin V-FITC/ PI试剂盒说明书,将细胞重悬于500μL 1×Binding buffer,加入5μL的FITC和5μL的PI轻轻混匀,于室温避光孵育15min,经流式细胞仪进行检测。1.2.4 MDCK细胞活性氧含量的测定 常规方法消化收集细胞于离心管内,4℃、1 500r/min离心5min。按照1∶1 000用无血清培养液稀释DCFH-DA,使终浓度为10μmol/L。去除离心管内细胞培养液,加入1mL稀释好的DCFH-DA,37℃细胞培养箱内孵育20min,用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFHDA,流式细胞仪检测。
1.2.5统计学分析 数据用-x±SD表示,用SPSS统计分析软件进行单因素方差分析。
2 结果
2.1NAC对攻毒的MDCK细胞增殖的影响
如图1所示,犬细小病毒分别染毒24h、48h后,病毒组细胞的OD值显著小于对照组细胞(P<0.05),且呈时间-效应关系,说明染毒后病毒明显抑制MDCK细胞增殖,而添加NAC组的细胞与染毒组相比,OD值显著增高(P<0.05),抑制作用明显改善。
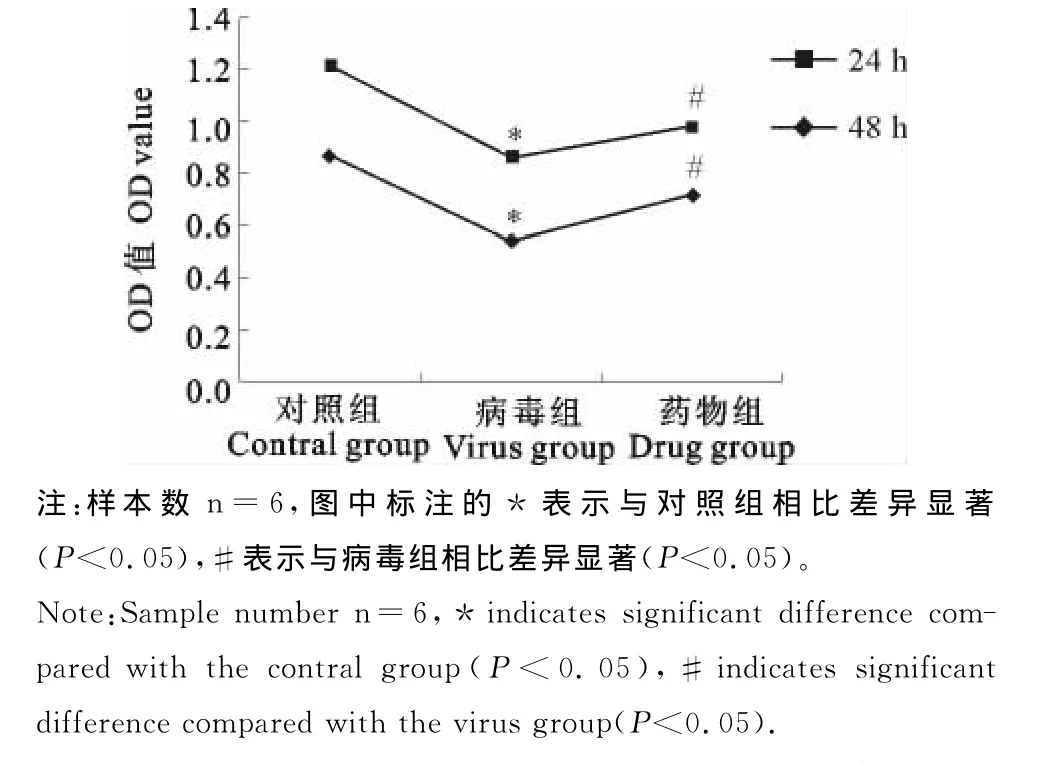
图1 不同试验组对MDCK细胞增殖的影响Fig.1 The effects of different level groups on MDCK cell proliferation
2.2NAC对攻毒的MDCK细胞凋亡率测定
如表1所示,24h后,与对照组相比,病毒组凋亡率明显高于对照组(P<0.05),说明犬细小病毒引起MDCK细胞凋亡,而NAC试验组明显低于病毒组(P<0.05),显著抑制了细胞的凋亡,从而起到保护细胞作用;同样,48h也是如此。各处理组细胞随着时间的延长,凋亡率均明显增加,且呈一定时间-效应关系。

表1 不同试验组对MDCK细胞凋亡测定的影响Table 1 The effects of different level groups on MDCK cell apoptosis assay %
2.3NAC对攻毒的MDCK细胞内ROS水平影响
如表2所示,各处理组的MDCK细胞均随着时间的延长,胞内活性氧水平均逐渐升高,呈一定时间—效应关系。各时间段内,病毒组MDCK细胞内ROS水平明显高于对照组(P<0.05),而NAC试验组细胞内ROS水平和病毒组相比,细胞ROS水平明显降低(P<0.05),说明NAC抑制病毒引起的细胞内活性氧升高。

表2 不同试验组对MDCK细胞内ROS测定的影响Table 2 The effects of different level groups on MDCK cell ROS assay %
3 讨论
细胞凋亡是细胞本身自我调节的、由基因控制、自发性的一种程序性死亡,它可以由自身产生,也可以由一系列生理或病理的刺激诱导产生[8],其中病毒感染是诱导因素之一。它和坏死性死亡是截然不同的两种死亡形式。本试验用MTT对病毒组细胞进行存活率测定发现,攻毒细胞的OD值显著小于对照组,存活率明显下降,此时细胞损伤包括细胞凋亡、细胞死亡、自噬式死亡等,细胞凋亡只是其中一种形式,而NAC试验组的OD值明显比攻毒组高,说明NAC对病毒组细胞的死亡有一定改善。研究表明,越来越多的病毒感染可以使宿主细胞产生凋亡[9]。杜林林等[10]发现,犬细小病毒能诱导肠黏膜细胞凋亡及复方苦芩对其抑制作用。本试验研究发现,病毒组细胞随着时间的延长,凋亡率逐渐升高,与对照组相比呈显著性差异(P<0.05),说明犬细小病毒能够明显诱导MDCK细胞凋亡,而25μg/mL NAC试验组的细胞凋亡率明显比病毒组高(P<0.05),提示一定浓度的NAC具有拮抗病毒诱导细胞凋亡的作用。
有关病毒引起细胞凋亡机制的观点很多,而且在不同的细胞中,引起的细胞凋亡不完全一致[11]。线粒体途径是细胞凋亡的一个重要途径,线粒体是细胞活动最为重要的一个细胞器,它包含了一些与细胞凋亡密切相关的物质,如活性氧自由基(reactive oxygen species,ROS)、细胞色素C等。过多的ROS会导致细胞DNA损伤、线粒体广泛性氧化损伤及影响信号转导,从而引起细胞凋亡[12]。本试验结果表明,24h和48h时,各病毒组与对照组相比,细胞内ROS水平显著升高(P<0.05),且呈现时间-效应关系,而NAC试验组则有明显的抑制ROS升高作用。试验结果发现细胞凋亡率与细胞内ROS水平呈正相关,提示犬细小病毒导致MDCK细胞凋亡过程中ROS发挥了一定作用。
NAC是一种合成抗氧化剂,它是细胞内还原性谷胱甘肽的前体,促进谷胱甘肽的合成。NAC具有抗凋亡作用,能够清除细胞内活性氧自由基,从而干扰凋亡的信号转导[13],越来越多研究[14-16]表明,NAC可抑制多种因素导致的细胞凋亡,如NAC可明显抑制由过氧化氢诱导的骨髓间充质干细胞凋亡,减弱由镉导致大鼠大脑皮质神经细胞凋亡及ROS水平,对活性氧诱导的耳蜗毛细胞凋亡也有明显的抑制作用。本试验研究表明,NAC可使犬细小病毒致MDCK细胞存活率有升高趋势,且差异性显著,也能够明显降低细胞凋亡率及ROS水平,说明NAC可以有效清除犬细小病毒导致的细胞内过多的ROS,从一定程度上可以阻止细胞凋亡的发生,但其分子机制有待进一步研究。
参考文献:
[1] 李世静,嵇辛勤,主 性,等.犬细小病毒VP2基因测序分析[J].动物医学进展,2013,34(6):96-100.
[2] Gray L K,Crawford P C,Lecy J K,et al.Comparison of two assays for detection of antibodies against canine parvovirus and canine distemper virus in dogs admitted to a Florida animal shelter[J].J Am Vet Med Assoc,2012,240(9):1084-1087.
[3] Pinto L D,Streck A F,Goncalves K R,et al.Typing of canine parvovirus strains circulating in Brazil between 2008and 2010[J].Virus Res,2012,165(1):29-33.
4 Muz DOguzoglu T CTimurkan M Oet al.Characterization of the partial VP2gene region of canine parvoviruses in domestic cats from Turkey[J].Virus Gen,2012,44(2):301-308.
[5] Fleury C,Mignotte B,Vayssière J L.Mitochondrial reactive oxygen species in cell death signaling[J].Biochimie,2002,84 (2-3):131-141.
[6] De Flora S,Izzotti A,D'Agostini F,et al.Mechanism of N-acetyl-cysteine in the prevention of DNA damage and cancer,with special reference to smoking-related end-points[J].Carcinogenesis,2001,22(7):999.
[7] 唐汉庆,劳传君,李晓华,等.N-乙酰半胱氨酸对COPD大鼠模型血管活性物质的影响[J].动物医学进展,2014,35(6):54-57.
[8] 贾 宁,孙荣钊.病毒感染对细胞凋亡的影响及作用机制[J].中国动物检疫,2012,29(8):69-72.
[9] Muller A,Rudel T.Modification of host cell apoptosis by viral and bacterial pathogens[J].Int J Med Microbiol,2001,291 (3):197-207.
[10] 杜林林,李 梁,刘 娟,等.复方苦芩对犬细小病毒致肠粘膜细胞凋亡及相关基因表达的影响J.中国兽医学报2012 32(10):1511-1515.
[11] 李卫中.病毒感染与靶细胞凋亡[J].中国社区医师,2013,15 (3):15-16.
[12] Heath-Engel H M,Shore G C.Mitochondrial membrane dynamics,cristae remodeling and apoptosis[J].Biochimica et Biophysica Acta,2006,1763(5-6):549-560.
[13] 李 悦,郑云亭.N-乙酰半胱氨酸对镉致人胚肾细胞凋亡拮抗作用[J].中国公共卫生,2007,23(5):543-544.
[14] 谢荣辉,周师洁,殷 明,等.N-乙酰半胱氨酸对过氧化氢诱导的骨髓间充质干细胞凋亡的保护及作用机制研究[J].中国药理学通报,2014,30(1):54-59.
[15] 袁 燕,张 英,卞建春,等.镉致大鼠大脑皮质神经细胞凋亡的机理及N-乙酰半胱氨酸的保护作用[J].中国兽医学报,2010,30(8):1107-1110.
[16] 原红艳,张淑香,李兴启,等.N-乙酰半胱氨酸对活性氧诱导耳蜗毛细胞凋亡的抑制作用的观察[J].听力学及言语疾病杂志,2012,20(3):266-268.
Effects of N-acetylcysteine on Canine Parvovirus Induced Apoptosis and Reactive Oxygen Species of MDCK Cells
QIU Xian-shuai1,ZHANG Hao1,XIAO Xi-yu1,REN Chang-bao2,TANG Zhao-xin1,2
(1.College of Veterinary Medicine,South China Agriculture University,Guangzhou,Guangdong,510642,China;2.Zhaoqing Dahuanong Biology Medcine Co.,Ltd,Zhaoqing,Guangdong,526238,China)
Abstract:To explore the protective effect of N-acetylcysteine(25μg/mL)on canine parvovirus infection in MDCK cells,the proliferation rate of NAC on the infected MDCK cells was measured by MTT assay.The apoptosis rate and reactive oxygen species were detected by flow cytometry.The results showed that the cell proliferation rate of infected group decreased significantly(P<0.05),compared with the control group,but the rate of NAC group was significantly higher than that of the infected group(P<0.05);The apoptotic rate and intracellular ROS levels of infected group was significantly increased(P<0.05)with a certain time-effect relationship,but the NAC group significantly reduced this situation.Conclusion:NAC obviously protects MDCK cells against canine parvovirus induced apoptosis by reducing ROS.
Key words:Canine parvovirus;N-acetylcysteine;viability;apoptosis;reactive oxygen species
作者简介:邱先帅(1988-),女,河南新乡人,硕士研究生,主要从事兽医内科学研究。*通讯作者
收稿日期:2014-12-24
中图分类号:S852.3
文献标识码:A
文章编号:1007-5038(2015)07-0018-04

