猪PD-1胞外区基因的克隆及原核表达
杨 媛,朱艳平,岳 锋,孙国鹏,张艳芳,银 梅,王选年*(.新乡学院生物技术研究中心,生命科学与技术系,河南新乡453003;.河南科技学院动物科学学院,河南新乡453003)
猪PD-1胞外区基因的克隆及原核表达
杨媛1,2,朱艳平1,岳锋1,孙国鹏1,张艳芳1,银梅2,王选年1*
(1.新乡学院生物技术研究中心,生命科学与技术系,河南新乡453003;2.河南科技学院动物科学学院,河南新乡453003)
摘 要:为研究PD-1/PD-L1通路在猪免疫抑制性疾病中的作用,根据猪的PD-1的基因序列,设计扩增其胞外区的引物,从猪PBMC基因组中通过PCR扩增获得猪PD-1胞外区基因片段,测序正确后克隆至原核表达载体pET-32a(+),构建重组原核表达质粒pET32-PD1,转化大肠埃希菌DH5α。挑选可疑菌落鉴定正确后转至Rosetta(DE3)进行诱导表达,表达产物进行SDS-PAGE和Western blot分析。结果表明,在37℃、0.5 mmol/L IPTG条件下诱导获得33ku的PD-1胞外区融合蛋白,能够被其多抗血清、His标签抗体和人PD-1抗体所识别。本研究为制备其单克隆抗体和研究PD-1/PD-L1在猪免疫抑制性疾病中的作用提供了材料。
关键词:猪PD-1;胞外区;克隆;原核表达
程序性死亡分子1(programmed death-1,PD-1)基因编码一个分子质量50ku~55ku的Ⅰ型跨膜糖基化表面受体蛋白,其细胞外区为免疫球蛋白样V区,胞质区含免疫受体酪氨酸抑制基序和免疫受体酪氨酸转换基序,这些结构表明PD-1为抑制性调节分子[1]。早期被认为与细胞凋亡有关而被命名为PD-1[2]。PD-1主要在活化的T细胞、B细胞和单核细胞上表达。PD-1的配体(PD-L)有两种类型,分别为PD-L1和PD-L2[1]。PD-1/PD-L1通路在机体的免疫调节中起着重要的负调节作用。
PD-1与其配体PD-L1结合,并不引起T细胞凋亡,而是使大多数细胞被阻滞在细胞增殖周期G0时相,限制了进入细胞周期的细胞数[3],降低了T细胞受体介导的细胞增殖和细胞毒作用[4-5],同时也影响很多细胞因子分泌,如下调IL-2和IFN-γ的分泌[6],在一定程度上下调了机体的免疫应答。在阻断PD-1/PD-L通路后,效应T细胞数量增加、功能加强[7-10]。基于上述理论研制PD-1单抗为许多疾病(如肿瘤、自身免疫疾病)的治疗拓宽了途径。
本研究旨在获得猪PD-1胞外区基因片段,将其克隆入原核表达载体pET-32a(+)中,转化大肠埃希菌Rosetta(DE3)诱导表达获得重组蛋白,为制备其单克隆抗体和探讨其在猪免疫抑制性疾病中的作用积累资料。
1 材料与方法
1.1材料
1.1.1菌株和载体 E.coli DH5α、Rosetta(DE3)菌株和原核载体pET-32a(+)均由新乡学院生物技术研究中心实验室保存;pMD18-T simple vector,TaKaRa公司产品。
1.1.2试剂 淋巴细胞分离液,天津市灏洋生物制品科技有限责任公司产品;Trizol试剂,Invitrogen公司产品;ExTaq酶、dNTP、T4-DNA连接酶、EcoRⅠ和XhoⅠ,TaKaRa公司产品;琼脂糖凝胶回收试剂盒和质粒提取试剂盒,TIANGEN公司产品;Amp,IPTG,Solarbio公司产品;琼脂糖、酵母提取物和蛋白胨,OXOID公司产品;HRP标记羊抗鼠IgG、鼠Anti His Tag单克隆抗体及AEC显色试剂盒,北京中杉金桥生物公司产品;ProteinPure-Ni-NTA Resin,北京全式金公司产品。
1.2方法
1.2.1引物设计与合成 根据GenBank公布的猪PD-1基因序列(NM-001204379.1)设计扩增其胞外区的366bp的特异性引物:PD-L1F:5′-CGGAATTC CTGCTAGATGCTCCGAGC-3′(含有EcoRⅠ酶切位点),PD-L1R:5′-CCCTCGAG TAAGTAGCTTTCGGGCCT-3′(含有XhoⅠ酶切位点),引物由上海生工生物工程技术服务有限公司合成。
1.2.2猪淋巴细胞总RNA的提取 猪耳缘静脉采血,按照淋巴细胞分离液说明书分离淋巴细胞,然后按Trizol法提取总RNA。
1.2.3反转录 总RNA 10μL,随机引物1μL,dNTP 1μL,混匀,75℃5min,然后加入RNA酶抑制剂1μL,反转录酶1μL,buffer 4μL,DEPC水2μL,混匀,25℃10min,42℃1h,70℃10min,4℃保存。1.2.4 目的基因片段扩增与纯化 以cDNA为模板,利用设计的引物扩增目的基因片段,PCR反应体系:dNTP(2.5 mmol/L)2μL,ExTaq buffer 2.5μL,上游引物0.5μL,下游引物0.5μL,ExTaq 酶0.2μL,cDNA 0.5μL,ddH2O 18.8μL,混匀;PCR反应条件:95℃预变性5min;95℃30s,55℃30s,72℃30s,29个循环;72℃,10min后4℃保存。PCR产物经10g/L的琼脂糖凝胶电泳检测,DNA回收试剂盒回收目的片段。
1.2.5PD-L1胞外区基因片段的鉴定 将回收纯化的产物连接pMD18-T-simple载体,转化大肠埃希菌DH5α感受态细胞。筛选出阳性可疑菌落,菌液PCR和质粒双酶切鉴定后,送上海生工生物工程技术服务有限公司测序,测序正确的的质粒命名为pMD-PD1。
1.2.6表达PD-L1胞外区原核表达载体的构建
利用限制性内切酶EcoRⅠ和XhoⅠ分别对质粒pMD-PD1及原核表达载体pET32a(+)进行双酶切,T4-DNA连接酶连接纯化回收的酶切产物,连接产物转化大肠埃希菌DH5α感受态细胞,菌液PCR和质粒PCR鉴定筛选出阳性可疑菌落,送上海生工生物工程技术服务有限公司测序,测序正确的的质粒命名为pET32-PD1。
1.2.7pET32-PD1在大肠埃希菌中的诱导表达
将构建的重组表达质粒pET32-PD1转入大肠埃希菌Rosetta中,挑取阳性克隆接种于含100mmol/L Amp的LB液体培养基中,37℃、180r/min摇床培养至OD 600nm为0.4~0.6后,加入终浓度分别为0.5mmol/L的IPTG进行诱导表达。诱导6h后收集菌体,用100μL PBS重悬,再加入100μL 2×SDS Loading buffer,混匀,煮沸10 min,进行SDS-PAGE电泳分析。
1.2.8表达产物的可溶性分析 收集诱导表达的菌液,12 000r/min离心1min,沉淀用200μL PBS重悬,超声波破碎后,12 000r/min离心1min,保留上清。沉淀再次用100μL PBS重悬,分别取上清和沉淀进行SDS-PAGE电泳检测。
1.2.9蛋白纯化 对重组蛋白进行大量表达,收获菌体,弃上清液,包涵体沉淀用磷酸盐缓冲液重悬,超声波破碎20 min。于4℃,5 000r/min离心20min,弃上清。用含尿素溶解缓冲液溶解沉淀,于4℃、12 000r/min离心20 min,收集上清,用0.4μm滤膜过滤上清。依照ProteinPure-Ni-NTA Resin亲和柱的操作手册,进行蛋白纯化
1.2.10Western blot分析 将表达的目的蛋白纯化后免疫接种小鼠,50μg/只,免疫4次后制备其多抗血清。目的蛋白经SDS-PAGE电泳分离后,电转印到硝酸纤维膜上。用50g/L脱脂奶粉封闭过夜,TBST洗3次,每次5min,加入一抗(抗猪PD-1血清、His标签单抗或抗人PD-1抗体),37℃孵育2h,同上洗涤,加HRP标记羊抗鼠IgG 37℃孵育1h,同上洗涤,加AEC显色剂显色,用水终止反应,观察。
2 结果
2.1pET32-PD-1重组表达质粒的构建
用PD-1胞外区扩增引物以猪PBMC cDNA产物为模板进行PCR,产物经10g/L琼脂糖凝胶电泳后,在366bp处有特异性DNA条带,大小与预期相符,测序证明为PD-1胞外区基因序列(图1),连接载体后,挑取单菌落经菌液PCR检测、双酶切鉴定和测序,证实构建重组表达载体pET32-PD1(图2),酶切出现的中间一条带是由于质粒提取过程中螺旋结构部分遭到破坏所致。
2.2pET32-PD1诱导表达、可溶性分析及纯化
重组表达质粒pET-PD1转化至Rosetta表达宿主菌,利用IPTG诱导表达后,经SDS-PAGE分析,表达产物的分子质量为33ku,与预期的大小一致,经超声裂解处理的样品,分别取上清和沉淀进行SDS-PAGE检测,结果显示沉淀中含有大量的目的蛋白(图3),说明目的蛋白的表达形式是包涵体。对pET-PD1重组目的蛋白进行大量诱导表达,表达产物经ProteinPure-Ni-NTA Resin柱层析纯化后得到纯化蛋白(图4)。
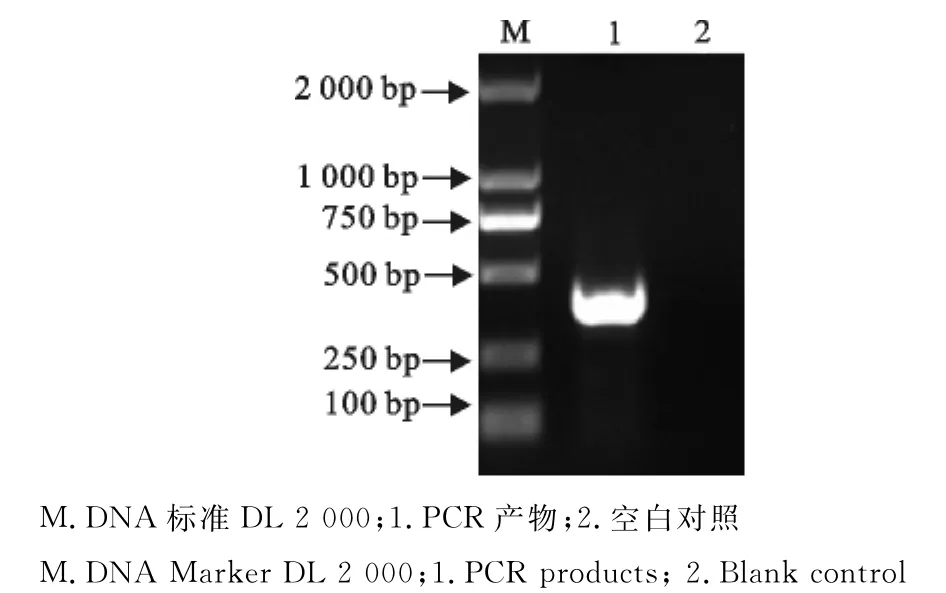
图1 猪PD-1胞外区PCR产物检测Fig.1 Analysis of PCR products of porcine PD-1
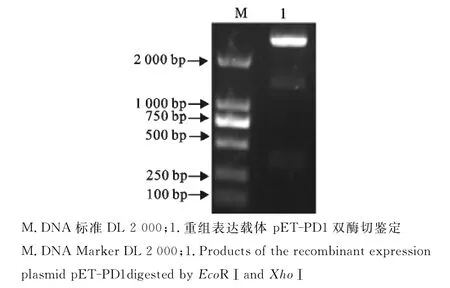
图2 重组表达质粒pET-PD1的双酶切鉴定Fig.2 Identification of the recombinant expression plasmid pET-PD1by EcoRⅠand XhoⅠdigestion
2.3Western blot检测
Western blot结果见图5,结果表明表达的目的蛋白分别与抗猪PD-1血清、His标签单抗和抗人PD-1抗体在约33ku处出现了特异的条带。证明成功诱导表达了目的蛋白,该蛋白具有良好的反应原性。
3 讨论
根据GenBank中猪PD-1基因序列设计特异性引物,采用PCR方法克隆了PD-1胞外区的基因序列,成功构建重组表达质粒pET32-PD1,重组蛋白能够被抗猪PD-1抗体、His标签抗体和抗人PD-1抗体识别,且多抗不与载体蛋白反应,说明目的蛋白得到很好的表达且有良好的反应原性。Western blot结果中A和B图第2条泳道是未诱导的蛋白,但也有少量的蛋白,所以也有显色反应。本研究选用的大肠埃希菌表达载体pET-32a(+),pET32-PD1是一个融合表达载体质粒,所表达蛋白带有His标签,所以PD-1蛋白能与标签抗体结合;另外猪的PD-1与人的PD-1氨基酸同源性是63%,而且分子结构也相似,在胞外区都含有IgV样结构域,在胞质尾部都有两个免疫调控基序,所以获得的PD1融合蛋白能与抗人PD-1抗体发生交叉反应。
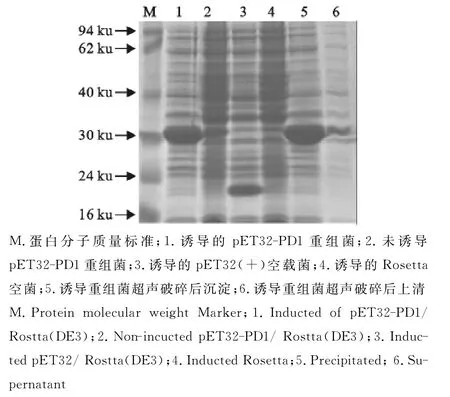
图3 pET32-PD1表达产物SDS-PAGE分析Fig.3 Analysis of pET32-PD1products by SDS-PAGE

图4 重组目的蛋白PD-1的纯化Fig.4 Analysis of purificated recombinant PD-1protein by SDS-PAGE

图5 pET32-PD1表达产物Western blot分析Fig.5 Analysis of the expression of recombinant plasmid pET32-PD1by Western blot
PD-1及配体的研究在人和鼠方面的研究比较多,如PD-1缺乏的小鼠可导致小鼠自主免疫的扩大性心肌病[11-12];人类免疫缺陷病毒(HIV)感染可选择性下调被感染细胞的PD-1的表达[13];PD-1/PDL1信号途径与自身免疫性脑脊髓炎和肥胖型糖尿病小鼠的胰岛素分泌密切相关[14-15]等。但是一些病原引起猪的持续性感染和免疫抑制[16-19]是否与PD-1/PD-L1密切相关的文献报道还很少。本实验室建立了mRNA水平检测PD-1及配体的荧光定量PCR方法,并检测到在猪瘟病毒感染不同阶段PD-1及其配体表达量的变化,在猪瘟病毒感染后第7天PD-1及其配体表达量显著升高,随着病毒量的减少PD-1及其配体的表达量会缓慢下降并维持在正常水平(本实验室尚未发表),说明猪PD-1及其配体与病毒感染有一定的关系,这些数据对本试验的开展提供了前提依据。
PD-1/PD-L1通路对获得性免疫应答的强度起负调节作用,这种作用对机体而言可以降低免疫反应对组织的损害,是一种自我保护作用,但是一些病原微生物利用此通路来逃避机体的免疫应答,使机体处于长期的持续性感染状态,因此,阻断PD-1/ PD-L1信号通路有望成为治疗自身免疫性疾病、病毒性疾病和肿瘤等的新策略[20-22]。本试验成功表达出PD-1胞外区蛋白,为以后制备PD-1单克隆抗体和研究PD-1在猪的免疫抑制性疾病中的作用奠定了基础。
参考文献:
[1] Jin H T,Ahmed R,Okazaki T.Role of PD-1in regulating T-cell immunity[J].Curr Top Microbiol Immunol,2011,350:17-37.
[2] Riley J L.PD-1signaling in primary T cells[J].Immunol Rev,2009,229(1):114-125.
[3] Latchman Y,Wood C R,Chernova T,et al.PD-L2is a second ligand for PD-1and inhibits T cell activation[J].Nat Immunol,2001,2(3):261-268.
[4] Parry R V,Chemnitz J M,Frauwirth K A,et al.CTLA-4and PD-1receptors inhibit T-cell activation by distinct mechanisms [J].Mol Cell Biol,2005,25(21):9543-9553.
[5] West E E,Jin H T,Rasheed A U,et al.PD-L1blockade synergizes with IL-2therapy in reinvigorating exhausted T cells[J].J Clin Invest,2013,123(6):2604.
[6] Topalian S L,Drake C G,Pardoll D M.Targeting the PD-1/B7-H1(PD-L1)pathway to activate anti-tumor immunity[J].Curr Opin immunol,2012,24(2):207-212.
[7] Kim H K,Guan H,Zu G,et al.High-level expression of B7-H 1 molecules by dendritic cells suppresses the function of activated T cells and desensitizes allergen-primed animals[J].J Leukoc Biol,2006,79(4):686-695.
[8] Seo S K,Seo H M,Jeong H Y,et al.Co-inhibitory role of T-cell associated B7-H1and B7-DC in the T-cell immune response[J]. Immunol Lett,2006,102(2):222-228.
[9] Ding H,Wu X,Gao W.PD-L1is expressed by human renal tubular epithelial cells and suppresses T cell cytokine synthesis [J].Clin Immunol,2005,115(2):184-191.
[10] Araki K,Youngblood B,Ahmed R.Programmed cell death 1-directed immunotherapy for enhancing T-cell function[C]. Cold Spring Harbor symposia on quantitative biology.Cold Spring Harbor Laboratory Press,2014:a019869.
[11] Okazaki T,Tanaka Y,Nishio R,et al.Autoantibodies against cardiactroponin I are responsible fordilated cardiomyopathy in PD-1-deficient mice[J].Nat Med,2003,9(12):1477-1483.
[12] Saha A,Aoyama K,Taylor P A,et al.Host programmed death ligand 1is dominant over programmed death ligand 2expression in regulating graft-versus-host disease lethality[J]. Blood,2013,122(17):3062-3073.
[13] Venkatachari N J,Buchanan W G,Ayyavoo V.Human immunodeficiency virus(HIV-1)infection selectively down regulates PD-1expression in infected cells and protects the cells from early apoptosis in vitro and in vivo[J].Virology,2008,376(1):140-153.
[14] Bodhankar S,Galipeau D,Vandenbark A A,et al.PD-1Interaction with PD-L1but not PD-L2on B-cells mediates protective effects of estrogen against EAE[J].J Clin & Cell Immunol,2013,4(3):143.
[15] Fife B T,Guleria I,Gubbels Bupp M,et al.Insulin-induced remission in new-onset NOD mice is maintained by the PD-1-PDL1pathway[J].J Exp Med,2006,203(12):2737-2747.
[16] Beura L K,Sarkar S N,Kwon B,et al.Porcine reproductive and respiratory syndrome virus nonstructural protein 1βmodulates host innate immune response by antagonizing IRF3activation[J].J Virol,2010,84(3):1574-1584.
[17] Mclntosh K A,Harding J C,Parker S,et al.Nested polymerase chain reaction detection and duration of porcine circovirus type 2in semen with sperm morphological analysis from naturally infected boars[J].J Vet Diagn Invest,2006,18(4):380-384.
[18] Cheng X,Dai H,Wan N,et al.Interaction of programmed death-1and programmed death-1ligand-1contributes to testicular immune privilege[J].Transplantation,2009,87(12):1778-1786.
[19] Butt A Q,Mills K H.Immunosuppressive networks and checkpoints controlling antitumor immunity and their blockade in the development of cancer immunotherapeutics and vaccines [J].Oncogene,2014,33(38):4623-4631.
[20] 伊 凡,李 江,李玉谷.T细胞免疫重建的临床策略[J].动物医学进展,2011,32(6):171-174.
[21] Hua D,Sun J,Mao Y,et al.B7-H1expression is associated with expansion of regulatory T cells in colorectal carcinoma [J].World J Gastroenterol,2012,18(9):971.
[22] Waisman A,Yogev N.B7-H1and CD8+Treg:The enigmatic role of B7-H1in peripheral tolerance[J].Eur J Immunol,2009,9(6):1448-1451.
Cloning and Prokaryotic Expression of Porcine PD-1 Extracellular Region Gene
YANG Yuan1,2,ZHU Yan-ping1,YUE Feng1,SUN Guo-peng1,ZHANG Yan-fang1,YIN Mei2,WANG Xuan-nian1
(1.Biotechnology Research Center,Department of Life Science and Technology,Xinxiang University,Xinxiang,Henan,453003,China;2.College of Animal Science,Henan Institute of Science and Technology,Xinxiang,Henan,453003,China)
Abstract:In order to study the role of porcine PD-1/PD-L1pathways in immunosuppressive disease,the primers were designed according to the extracellular region of porcine PD-1sequence in GenBank,and the porcine PD-1extracellular region gene was cloned from porcine PBMC.The PCR products were determined by cloning and sequencing,and then directionally cloned into pET32a(+).The recombinant plasmid in E.coli Rosetta(DE3)was induced with IPTG,and the expression products were detected by SDS-PAGE and Western blot.SDS-PAGE analysis showed that we obtained the recombinant proteins at 37℃,0.5mmol/L IPTG,and its molecular weight is 33 ku.Western blot revealed that the expressed products were reacted by anti-porcine PD-1antibody,His-tag antibody and anti-human PD-1monoclonal antibody.These results indicated that the recombinant prokaryotic expression protein of porcine PD-1was properly expressed.The protein has a good antigenecity and reactogenicity.It is useful to prepared the monoclonal antibodies and study the PD-1/PD-L1function in immunosuppressive diseases in pigs.
Key words:porcine PD-1;extracellular region;cloning;prokaryotic expression
作者简介:杨 媛(1988-),女,河南林州人,硕士研究生,主要从事分子免疫学与动物病理学研究。*
通讯作者
基金项目:河南省基础与前沿技术研究(122300410150);国家自然科学基金项目(31272539,31201877);河南省教育厅科学技术研究重点项目(13A230837)
收稿日期:2014-03-25
中图分类号:Q786;S858.28
文献标识码:A
文章编号:1007-5038(2015)09-0055-05

