辣椒雄性不育系葡萄糖-6-磷酸脱氢酶基因的克隆及表达分析
吕俊恒,文锦芬,莫云容,赵 凯,马仲飞,邓明华*
(1 云南农业大学 园林园艺学院,昆明650201;2昆明理工大学 现代工程学院,昆明 650500;3 昭通市昭阳区园艺技术推广所,云南昭通 657000)
辣椒雄性不育系葡萄糖-6-磷酸脱氢酶基因的克隆及表达分析
吕俊恒1,文锦芬2,莫云容1,赵 凯1,马仲飞3,邓明华1*
(1 云南农业大学 园林园艺学院,昆明650201;2昆明理工大学 现代工程学院,昆明 650500;3 昭通市昭阳区园艺技术推广所,云南昭通 657000)
为了深入研究辣椒雄性不育与能量代谢之间的关系,该研究以辣椒近缘物种番茄的葡萄糖-6-磷酸脱氢酶基因(G6PDH)同源序列为基础,采用电子克隆的方法克隆出辣椒CaG6PDH基因。利用荧光定量PCR技术,对辣椒雄性不育系9704A与其保持系9704B花蕾发育的不同阶段,以及保持系9704B不同组织(茎、叶、花、果皮、胎座、种子)中CaG6PDH基因进行表达分析。结果表明:两系中获得的CaG6PDH基因的编码序列一致,全长1 533 bp,编码510个氨基酸残基;辣椒CaG6PDH基因在保持系不同组织中表达量存在差异,胎座中表达量最高,茎中表达量最低;辣椒CaG6PDH基因的表达量在花蕾发育的不同阶段雄性不育系均高于保持系,此种差异在小孢子发育的单核期与成熟期尤为明显,这种差异可能使雄性不育系能量代谢供应出现异常,从而影响小孢子的正常发育而导致雄性败育。
辣椒;葡萄糖-6-磷酸脱氢酶;雄性不育;基因克隆;荧光定量PCR
雄性不育是指存在于植物中雌蕊发育正常但花粉发育不良或者不能产生可育的花粉等雄性器官发生退化的现象,目前至少已经在43科162属320个种和297个种间杂交中发现了雄性不育现象[1-2]。雄性不育的形成原因包括光照、温度、化学试剂和环境等一系列因素,在辣椒中主要分为细胞核与细胞质雄性不育。研究表明雄性不育的形成是由于小孢子发育期间能量代谢发生了异常,ATP供应异常导致小孢子不能正常发育,严重影响了花粉活力或者花粉管的萌发,最终不能产生可育的花粉,导致植株败育[3-8]。能量代谢在植物中处于极其重要的地位,能够保证植物正常的生长发育,能量代谢又与呼吸代谢息息相关,呼吸代谢中存在几种极其重要的途径,包括戊糖磷酸途径与糖酵解等。
戊糖磷酸途径(PPP)是植物中重要的代谢途径,与植物的生长发育密切相关。葡萄糖-6-磷酸脱氢酶(G6PDH)是PPP途径中关键的限速酶,催化PPP第一步中6-磷酸葡萄糖的脱氢[9]。其产生的磷酸戊糖参与核酸代谢能够产生NADPH,为脂肪酸、固醇类物质的合成提供还原力,NADPH的一系列反应还能够与其它一系列物质形成共调控,与能量代谢紧密相关[10-11]。目前在小麦、烟草、马铃薯、菠菜、水稻等植物材料中均已分离出此基因[12-16]。
早期研究从辣椒中克隆的SCS、NADP-ICDH、TPI等与能量代谢相关的酶基因,均表明其与不育系的形成有关[17-19]。本研究采用同源克隆的方法,从辣椒不育系与保持系中克隆到CaG6PDH基因cDNA完全编码序列,并对CaG6PDH在辣椒保持系不同组织以及在不育系与保持系花蕾发育的4个时期进行表达,可以为进一步研究辣椒雄性不育的形成与能量代谢之间的关系提供参考。
1 材料和方法
1.1 材 料
辣椒不育系9704A及其保持系9704B种植于云南农业大学园林园艺学院实验基地,取保持系茎、叶、花、果实、胎座、种子6个不同组织作为组织表达材料;取不育系与保持系小孢子形成初期、小孢子细胞分裂期、小孢子单核期、小孢子成熟期4个不同时期花蕾作为研究两系表达谱差异的材料。所有材料取样后立即冻于液氮,置于-80 ℃超低温冰箱长期保存备用。
1.2 方 法
1.2.1 RNA提取及cDNA合成 本实验采用TaKaRa公司RNAiso Plus试剂盒,进行各个组织与花蕾不同时期的RNA提取,提取完毕后用紫外分光光度计和1.5%琼脂糖凝胶电泳双重检测RNA浓度及纯度,检测合格后使用TaKaRa公司的反转录试剂盒进行cDNA合成。
1.2.2CaG6PDH的克隆 以GenBank中与茄科作物G6PDH基因高度同源的编码序列为参照,利用Primer Premier 5.0设计引物F1(TTGAAGGGATCATACTTG)和R1(AGAGGGATAATAGGACGT),引物序列由北京梓熙生物科技有限公司合成。以雄性不育系与保持系的cDNA作为模板各自进行RT-PCR扩增,反应体系为:1 μL 25 ng/mL cDNA,10.5 μL ddH2O,12.5 μL 2×EasyTaqPCR SuperMix(购于全式金公司),10 μmol/L的上下游引物各0.5 μL;反应条件为:94 ℃预变性4 min;94 ℃变性1 min,55 ℃退火45 s,72 ℃延伸90 s,39个循环;72 ℃延伸10 min;4 ℃保存。
1.2.3 生物信息学分析 利用GenScan(http://genes.mit.edu/GENSCAN.html)预测基因的cDNA 序列,利用DNAMAN等软件对测序结果进行初步编辑、比对、人工校对,并推导出氨基酸序列,氨基酸分子量(Mw)和等电点(pI),利用Compute pI/Mw Tool(http://us.expasy.org /tools /pi_tool.html)来预测,利用SignalP 4.1 server(http://www.cbs.dtu.dk/services/SignalP)预测信号肽序列,使用PSort II程序(http://psort.hgc.jp)预测蛋白质的亚细胞定位情况,蛋白质的保守结构域通过NCBI(http://www.ncbi.nlm.nih.gov)服务器上的Conserved Domain Architecture Retrieval Tool(CDART)工具(http://www.ncbi.nlm.nih.gov/BLAST)进行预测,使用SOPMA程序(http://npsa-pbil.ibcp.fr)预测蛋白质的二级结构,蛋白质的跨膜螺旋结构由TMHMM Server version 2.0程序(http://www.cbs.dtu.dk/services/TMHMM)预测。利用Clusta lX对氨基酸序列进行同源性比较,并用MEGA4构建多物种系统进化树。
1.2.4 实时荧光定量PCR(qRT-PCR) 实时定量PCR采用TaKaRa公司荧光定量试剂盒,染料为SYBR Green,在Eppendorf荧光定量PCR仪上进行。以辣椒Actin片段为内标,上述材料的cDNA为模板,所用Actin引物为F2(TGCAGGAATCCACGAGACTAC)和R2(TACCACCACTGAGCACAATGTT),根据CaG6PDH基因的测序结果设计特异性引物F3(CTCTTCCACCATCAGTATATCCC)和R3(ACCTTCAGTTCCAAAGTCCTCTC)。qRT-PCR反应体系如下:20 μL体系,10 μL SYBR Premix ExTaqⅡ(购于TaKaRa公司),10 μmol·L-1的上下游引物各0.8 μL,2 μL cDNA模板,6.4 μL dH2O;反应程序如下:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸20 s,循环40次。每个样品设3次重复。反应结束,利用2-△△Ct法进行相对表达量分析。
2 结果与分析
2.1 CaG6PDH基因的分离
分别以辣椒雄性不育系与保持系cDNA为模板,采用特异性引物进行CaG6PDH基因PCR扩增。PCR扩增产物用1.5%琼脂糖凝胶电泳检测,扩增结果送北京梓熙生物科技有限公司测序,结果表明目的片段为1 533 bp的完全编码序列,与预期结果相符(图1)。
2.2 辣椒CaG6PDH基因的生物信息学分析
RT-PCR产物测序结果表明,编码区全长1 533 bp,编码510个氨基酸(图2)。生物信息学分析表明CaG6PDH蛋白质等电点为6.27,分子量为58 541.87 ku,无信号肽,亚细胞定位显示该蛋白位于细胞质的概率是76.7%。通过Blast(protein)预测辣椒CaG6PDH蛋白的保守结构域,CaG6PDH属于G6PD_N与G6PD_C超家族。通过SOPMA 程序预测CaG6PDH蛋白的二级结构中含212 aa的α-螺旋(41.57%),73 aa的延伸链结构(14.31%),34 aa的β-转角(6.67%),191 aa的无规则卷曲(37.45%)。
2.3 CaG6PDH氨基酸序列比对及其分子进化关系
对雄性不育系与保持系PCR产物的测序结果进行比对,雄性不育系与保持系中CaG6PDH的氨基酸序列无差异。通过Blast(protein)比对可知,辣椒CaG6PDH氨基酸序列与多种作物G6PDH氨基酸序列具有相似性,分别与马铃薯相似性达96%,番茄96%,本氏烟95%,烟草95%等(图3)。利用辣椒CaG6PDH与以上7种作物的氨基酸序列构建系统进化树,表明辣椒的CaG6PDH氨基酸序列与马铃薯、番茄的亲缘关系较近(图4)。
2.4 CaG6PDH基因的组织表达分析
实时荧光定量结果表明,保持系6个组织中CaG6PDH基因均有表达,但在不同组织中表达量的差异较为明显,其中在胎座中的表达量最高,在茎中的表达量最低,两者表达量相差达1 548倍。茎、叶、花中的表达量相差很小,叶、花与茎的表达量相比,分别是其2.3倍和1.3倍;茎、叶、花与果皮、胎座、种子的表达量差异较大,此结果可能是由于不同组织处于不同发育时期,CaG6PDH基因表达量也存在一定的差异(图5)。

图1 辣椒CaG6PDH基因扩增结果

图2 CaG6PDH基因编码区序列及对应的氨基酸序列
2.5 CaG6PDH基因在不育系与保持系花期的表达分析
实时荧光定量PCR结果表明,雄性不育系与保持系中CaG6PDH基因的表达量在小孢子形成初期基本一致。在小孢子细胞分裂期至小孢子成熟期,G6PDH在雄性不育系中的表达都远远高于保持系。G6PDH在雄性不育系中的表达呈现先升高后降低的趋势,在小孢子单核期达到最大值;而在保持系中的表达则一直呈现下降趋势,到小孢子成熟期达到最低点。此结果表明CaG6PDH基因在雄
性不育系与保持系中的表达存在差异,其在雄性不育系中的表达较高可能与雄性不育的形成密切相关(图6)。
3 讨 论
Graeve等[11]在1994年首次从马铃薯胞质中克隆出了G6PDH基因,随后许多研究者在小麦、烟草、马铃薯、菠菜、水稻、苜蓿、甜杨等作物中均克隆出了G6PDH基因[12-16,20-21]。研究表明G6PDH基因的表达与植物的抗逆性、植物的生长发育有密切关系。例如,水稻的G6PDH基因与穗的发育相关,能够调控其生长发育[22];甜杨中的G6PDH基因与其抗冻性具有密切关系[21]。目前在辣椒中CaG6PDH基因功能的研究相对较少,本研究从辣椒雄性不育系与保持系中克隆出CaG6PDH基因,旨在研究CaG6PDH基因对辣椒雄性不育形成的作用。

图3 辣椒与其他物种G6PDH基因推导的氨基酸比对

图4 辣椒与其他物种G6PDH基因推导氨基酸序列进化树分析标尺代表遗传距离;数值代表从1 000次重复计算得到的Bootstrap百分比值;括号内为氨基酸登录号

图5 CaG6PDH基因在9704B不同组织中的表达图中数据为3次重复的平均值±SD;*.表示P<0.05为显著;**.表示P<0.01为极显著;图6同
同一植物不同器官呼吸速率有很大的差异,一般生长旺盛、幼嫩的器官的呼吸速率比生长缓慢、年老的快,生殖器官的呼吸作用比营养器官强。本研究发现,辣椒CaG6PDH基因在辣椒植株不同组织中的表达水平不一致,其中果皮、胎座和种子中的表达水平要远远高于茎和叶,这可能与取材时营养器官(茎和叶)是已经成熟的,而生殖器官(果实)是正在发育的有关,其果皮、胎座和种子的呼吸作用要远远强于茎和叶,而G6PDH基因编码呼吸作用过程中一个十分重要的酶,因此其在果实(果皮、胎座和种子)中表达水平要远高于茎和叶。
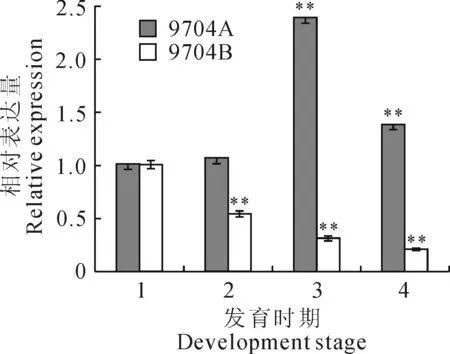
图6 CaG6PDH基因在9704A与9704B花蕾不同发育时期的表达1.小孢子形成初期;2.小孢子细胞分裂期;3.小孢子单核期;4.小孢子成熟期
植物花粉的发育过程中需要充足的能量补给,如果在花粉的发育过程中能量的供给出现问题,会导致花粉发育不良,从而导致败育。大量研究表明植物雄性不育系的线粒体基因发生了重组。线粒体是植物能量供应的主要器官,线粒体基因的重组会使呼吸作用的某些途径受到影响,干扰呼吸途径某些基因的正常表达,从而造成能量供应的异常,影响小孢子的发育。本研究结果表明,CaG6PDH在雄性不育系与保持系花的小孢子形成初期表达量没有明显差异,但从小孢子细胞分裂期开始到小孢子成熟期,雄性不育系的表达量均明显高于保持系。我们推测,在小孢子发育时期雄性不育系中由于线粒体基因的重组导致能量代谢发生紊乱,破坏了能量代谢的平衡,使得CaG6PDH在雄性不育系中的表达出现异常。由于小孢子发育环境十分敏感,能量供应的异常可能干扰小孢子的正常发育而导致败育。
本研究首次从辣椒雄性不育系与保持系中分离出了CaG6PDH基因,并对其编码区进行克隆,序列分析和功能预测,并研究了其在不同组织(保持系)以及不同发育阶段花蕾(雄性不育系与保持系)表达谱,此研究可为深入研究辣椒雄性不育与能量代谢之间的关系提供参考。
[1] SHI Y L(石雅丽),ZHANG R(张 锐),REN M ZH(任茂智),etal.Advanced study on the male sterility of cotton[J].CurrentBiotechnology(生物技术进展),2013,3(5):328-335(in Chinese).
[2] MARTIN J A,CRAWFORD J H.Several types of sterility inCapsicumfrutescents[J].JournaloftheAmericanSocietyforHorticulturalScience,1951,57:335-338.
[3] CHEN X F(陈贤丰),LIANG CH Y(粱承邺).Relation of energy metabolism in HPGMR abortive anthers and accumulation of H2O2to male sterility[J].PlantPhysiologyCommunications(植物生理学通讯),1991,27(1):21-24(in Chinese).
[4] XIA T(夏 涛),LIU J L(刘纪麟).Study on material metabolic system of cytoplasmic male sterility in maize[J].JournalofHuazhongAgriculturalUniversity(华中农业大学学报),1993,12(1):1-6(in Chinese).
[5] ZHANG L(张 丽),LI X Y(李霄燕),WEI Y T(魏毓棠),etal.Studies on material metabolism of male sterility in radish[J].JournalofAnhuiAgriculturalSciences(安徽农业科学),2002,30(3):326-327(in Chinese).
[6] HAO X F(郝雪峰),SHAN SH H(单树花),CHEN G J(陈国菊),etal.Development dynamics and cytological observation of floral organ in nucleic male sterile AB line of hot pepper[J].GuizhouAgriculturalSciences(贵州农业科学),2011,39(12):18-20(in Chinese).
[7] XIA T(夏 涛),LIU J L(刘纪麟).Cytochrome oxidase activity and ATP content of male-sterile cytoplasm in maize(ZeamaysL.)[J].ActaAgriculturaeBoreali-Sinica(华北农学报),1994,9(4):33-37(in Chinese).
[8] ZHOU P J(周培疆),LING X Y(凌杏元),ZHANG D Y(张端阳),etal.Energy metabolism and molecular mechanism of the cytoplasmic male sterility in plants[J].PlantPhysiologyCommunications(植物生理学通讯),1999,35(5):491-500(in Chinese).
[9] HUANG J(黄 骥),WANG J F(王建飞),ZHANG H SH(张红生).Adcances on plant pentose phosphate pathway and its key enzymes[J].ChineseBulletinofBotany(植物学通报),2004,21(2):189-194(in Chinese).
[10] GRAEVE K,SCHAEWEN A,SCHEIBE R.Purification,characterization and cDNA sequence of glucose-6-phosphate dehydrogenase from potato(SolanumtuberosumL.)[J].PlantJournal,1994,5(3):353-361.
[11] LIN S Z,ZHANG Z Y,LIU W F,etal.Role of ghcose-6-phosphate dehydrogenase in freezing-induced freezing resistance ofPopulussuaveolens[J].JournalofPlantPhysiologyandMolecularBiology,2005,31(1):34-40.
[12] SCHAEWEN A,LANGENKAMOER G,GRAEVE K.Molecular characterization of the plastidic glucose-6-phosphate dehydrogenase from potato in comparison to its cytosolic counterpart[J].PlantPhysiology,1995,109(4):1 327-1 335.
[13] KNIGHT J S,EMES M J,PHILLIP M D.Isolation and characterization of a full-length clone encoding a plastidic glucose-6-phosphate dehydrogenase fromNicotianatabacum[J].Planta,2001,212(4):499-507.
[14] NEMOTO Y,SASAKUMA T.Specific expression of glucose-6-phosphate dehydrogenase(G6PDH) gene by salt stress in wheat[J].PlantScience,2000,158(1-2):53-60.
[15] SCHNARRENBERGER C,FLECHNER A,MARYIN W.Enzymatic evidence for a complete oxidadtive pentose phosphate pathway in chloroplasts and an incomplete pathway in the cytosol of spinach leaves[J].PlantPhysiology,1995,108(2):609-614.
[16] HUANG J(黄 骥),WANG J F(王建飞),ZHANG H SH(张红生),etal.In silico cloning of glucose-6-phosphate dehydrogenase cDNA from rice(OryzasativaL.)[J].ActaGeneticaSinica(遗传学报),2002,29(11):1 012-1 016(in Chinese).
[17] DENG M H,WEN J F,HUO J L,etal.Cloning and sequence characterization of a novel pepper gene——SCSand the relationship with cytoplasmic male sterility[J].JournalofAnimal&PlantSciences,2013,17(3):2 589-2 600.
[18] DENG M H,WEN J F,HUO J L,etal.Molecular cloning,sequence characterization of a novel pepper geneNADP-ICDHand its effect on cytoplasmic male sterility[J].GeneticsandMolecularResearch,2012,11(3):3 020-3 031.
[19] DENG M H,WEN J F,HUO J L,etal.cDNA cloning,sequence characterization and expression analyses of a novel gene-TPIfrom pepper cytoplasmic male sterility(CMS)[J].JournalofMedicinalPlantsResearch,2012,6(10):1 997-2 003.
[20] FAHRENDORF T,NI W T,SORROSH B S,etal.Stress responses in alfalfa(MedicagosativaL.) XIX.Transcriptional activation of oxidative pentose phosphate pathway genes at the onset of the isoflavonoid phytoalexin response[J].PlantMolecularBiology,1995,28(5):885-900.
[21] LIN S Z,ZHANG Z Y,LIU W F,etal.Role of glucose-6-phoshate dehydrogenase in freezing-induced freezing resistance ofPopulussuaveolens[J].JournalofPlantPhysiologyandMolecularBiology,2005,31(1):34-40.
[22] HUANG J,ZHANG H SH,WANG J F,etal.Molecular cloning and characterization of rice 6-phosphogluconate dehydrogenase gene that is up-regulated by salt stress[J].MolecularBiologyReports,2003,30(4):223-227.
(编辑:宋亚珍)
Clone and Expression Analyses ofCaG6PDHGene from Pepper Cytoplasmic Male Sterility Line
LÜ Junheng1,WEN Jinfen2,MO Yunrong1,ZHAO Kai1,MA Zhongfei3,DENG Minghua1*
(1 College of Landscape and Horticulture,Yunnan Agricultural University,Kunming 650201,China;2 Faculty of Modern Agricultural Engineering,Kunming University of Science and Technology,Kunming 650500,China;3 Horticultural Technology Extension Station of Zhaoyang District,Zhaotong,Yunnan 657000,China)
In order to study the relationship between of pepper cytoplasmic male sterility and energy metabolism,we cloned pepper glucose-6-phosphate dehydrogenase gene (CaG6PDH) based on theG6PDHhomologous sequences of the related species tomato by the electronic cloning in this research.Real-time quantitative-PCR was used to analyze the gene expression levels in the different stages of flower development in the cytoplasmic male sterility line (9704A) and its maintainer line (9704B),and different tissues(stem,leaf,flower,pericarp,placenta and seed) in the 9704B.The results showed that there was no difference of cDNA sequences between theCaG6PDHin the 9704A and the 9704B.Sequence prediction showed that the 1 533 bp cDNA sequences represent 1 single gene,which encodes 510 amino acids.CaG6PDHgene has a different expression in the different tissues in the 9704B,the highest in the placenta and the lowest in the stem.CaG6PDHgene expression in 9704A was higher than that in 9704B during the different stages of flower development,especially in the uninucleate microspore stage and mature pollen stage.The abnormal expression level ofCaG6PDHin the 9704A disturbed the balance of energy metabolism and interfered the development of microspore,then resulted male sterility in the pepper.
CapsicumannuumL.;glucose-6-phosphate dehydrogenase;cytoplasmic male sterility;gene cloning;Real-time quantitative-PCR
1000-4025(2015)04-0682-06
10.7606/j.issn.1000-4025.2015.04.0682
2014-10-10;修改稿收到日期:2015-01-30
云南省应用基础研究项目(2013FB038)
吕俊恒(1989-),男,在读硕士研究生,主要从事蔬菜分子生物学方面的研究。E-mail:417911509@qq.com
*通信作者:邓明华,博士,副教授,主要从事蔬菜分子生物学方面的研究。E-mail:dengminghua2013@163.com
Q785;Q789
A

