HPLC法测定泊马度胺原料药中的有关物质
张笑雨,高爱伟,杨 浩,丁 黎中国药科大学药物分析教研室,南京 0009;南京卡文迪许生物工程技术有限公司,南京 0046
HPLC法测定泊马度胺原料药中的有关物质
张笑雨1,2,高爱伟2,杨 浩2,丁 黎1*
1中国药科大学药物分析教研室,南京 210009;2南京卡文迪许生物工程技术有限公司,南京 210046
目的:建立泊马度胺有关物质的HPLC测定方法。方法:采用Inertsil ODS-3V柱(250 mm×4.6 mm,5 μm)对降解杂质和工艺杂质进行定量分析;以辛烷磺酸钠缓冲液-乙腈(90∶10,A)与乙腈-甲醇(50∶50,B)为流动相,梯度洗脱;检测波长为215 nm。结果:在选定的色谱条件下泊马度胺与各杂质分离良好,6个杂质平均回收率均在83.4%至100.8%之间。结论:本法选择性高、重现性好,可作为泊马度胺质量控制的方法。
HPLC法;泊马度胺;有关物质
泊马度胺(Pomalidomide)是一种免疫调节抗肿瘤药[1],分子式为C13H11N3O4(结构见图1),分子量为273.24。泊马度胺胶囊(Pomalyst誖)由美国赛尔基因公司(Celgene Corporation)研制,于2013年2月8日,经美国FDA通过快速审批程序批准上市,用于治疗先前至少接受过包括来那度胺和硼替佐米在内的两种药物治疗的骨髓瘤患者(患者已对两药没有响应,并在60天的治疗期内病情发展和难以治疗)[2]。泊马度胺的规格为1、2、3、4 mg;并在美国获得了罕用药资格。2013年8月5日,经欧洲药品管理局审批在欧洲上市。
目前泊马度胺原料及制剂未在国内上市。根据本科研项目——合成泊马度胺,在详细研究起始物料的基础杂质、过程杂质(含歧化反应杂质)以及降解杂质的基础上,建立测定泊马度胺的有关物质方法,可以全面地控制该原料中的有关物质。
1 仪器与试药
美国Agilent公司1100型高效液相色谱仪,含DAD检测器,ChemStation色谱工作站(瑞士Mettler Toledo公司);135-S电子分析天平。
泊马度胺对照品(南京卡文迪许生物工程技术有限公司自制,批号:13050101,纯度:99.54%);泊马度胺(南京卡文迪许生物工程技术有限公司,含量98%,批号:130501、130502、130503)。杂质对照品IMP01(纯度:99.31%,批号:12100101);IMP02(纯度:99.69%,批号:12100101);IMP03(纯度99.31%,批号;130301);IMP04(纯度:90.77%,批号:130301);IMP05(纯度:98.59%,批号:130201);IMP06(纯度96.16%,批号:130201)均由南京卡文迪许生物工程有限公司提供。甲醇、乙腈均为色谱纯;其余试剂为分析纯。泊马度胺及各杂质结构式见图1。

图1 泊马度胺、杂质结构式
2 方法与结果
2.1 色谱条件
色谱柱:Inertsil ODS-(4.6 mm×250 mm,5 μm);检测波长:215 nm;柱温:25℃;自动进样器温度:4℃;流速:1.0 mL·min-1;进样量:20 μL;流动相:流动相A为辛烷磺酸钠缓冲液(取辛烷磺酸钠1.08 g,磷酸0.5 mL,用水稀释至1000 mL,用氢氧化钠调节pH至3.0)-乙腈(90∶10),流动相B为乙腈-甲醇(50∶50),进行梯度洗脱。洗脱梯度见表1。
2.2 有关物质测定方法
取本品,精密称定,加40%乙腈水溶液溶解并稀释成每1 mL中含泊马度胺0.2 mg的溶液,作为供试品溶液;精密量取供试品溶液适量,用40%乙腈水溶液稀释制成每1 mL中含泊马度胺2 μg的溶液,作为主成分自身对照溶液。
照“2.1”项下色谱条件,取对照溶液20 μL注入液相色谱仪,调节仪器灵敏度,使主成分色谱峰的峰高约为满量程的10%~25%,再精密量取供试品溶液和对照溶液各20 μL,分别注入液相色谱仪,记录色谱图。供试品溶液色谱图中,扣除溶剂峰及梯度峰后,如显杂质峰,除 IMP01、IMP02、IMP03、IMP04、IMP05、IMP06按外标法以峰面积计算,其余杂质峰,按主成分自身对照法以峰面积计算,即得。

表1 有关物质流动相洗脱梯度
2.3 专属性试验
2.3.1 与已知杂质分离情况 取泊马度胺及IMP01、IMP02、IMP03、IMP04、IMP05、IMP06适量,精密称定,加40%乙腈水溶液稀释制成每1 mL中含泊马度胺200 μg、各杂质2 μg的混合溶液,进样。见图2。结果表明,在“2.1”色谱条件下泊马度胺主峰与杂质间、杂质峰之间分离情况理想,杂质间的分离度均大于1.5。

图2 有关物质分离度试验色谱图
2.3.2 与未知杂质分离情况 另取本品 (批号130501)约20 mg,分别经酸(5 mL,0.5 mol·mL-1稀盐酸溶液,室温放置30 min,中和)、碱(5 mL,0.01 mol·mL-1氢氧化钠溶液,室温放置10 min,中和)、氧化(5 mL,30%H2O2,室温放置2 h)、水浴(80℃,2 h)、光照(4500 lx,5天)等条件强制降解破坏,以上样品用40%乙腈水溶液溶解并稀释至100 mL,再稀释1倍。按“2.1”项下色谱条件测定上述溶液,见图3。由图3可见主峰与杂质峰分离良好。
上述条件下,各杂质峰与主峰均能良好分离,主峰纯度高,纯度因子均大于999.0。说明此方法专属性好,能够有效检测样品中的杂质与降解产物,且降解回收率在94%~103%,回收率符合要求。
2.4 检测限和定量限
取泊马度胺对照品和各杂质对照品适量,分别配成每1 mL中含0.2 mg的溶液,分别吸取溶液适量,用40%乙腈水溶液逐级稀释,进样分析,按信噪比S/N=3计算检测限,按信噪比S/N=10计算定量限,泊马度胺 (PMDA)和杂质IMP01、IMP02、IMP03、IMP04、IMP05、IMP06的检测限与定量限见表2。
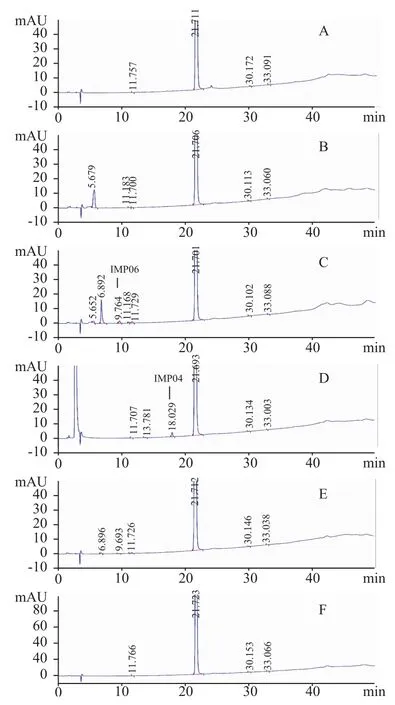
图3 破坏试验的HPLC图

表2 泊马度胺检测限与定量限(ng)
2.5 杂质的线性与范围
取IMP01、IMP02、IMP03、IMP04、IMP05、IMP06样品适量,精密称定,加40%乙腈水溶液溶解,并稀释制成0.05、0.1、0.2、0.5、1.0、2.0 μg·mL-1系列标准溶液。按“2.1”项下色谱条件,分别精密量取20 μL,注入液相色谱仪,记录色谱图,以浓度C(μg·mL-1)为横坐标,峰面积Y为纵坐标,进行线性回归,得回归方程和相关系数。结果见表3。
2.6 准确度试验
取泊马度胺对照品配制成0.2 mg·mL-1的溶液,进行分析测定样品中已知杂质的含量。分别称取杂质IMP01、IMP02、IMP03、IMP04、IMP05、IMP06配制成4 μg·mL-1的溶液作为杂质储备液,各配制3份。精密称取泊马度胺样品9份,精密移取各杂质储备液,得到相当于杂质限量浓度80%、100%、200%的溶液 (每个浓度对应3份杂质储备液),照“2.1”项下色谱条件进行分析。按外标法以峰面积计算各杂质的测得量,根据测得量和加入量计算回收率。IMP01、IMP02、IMP03、IMP04、IMP05、IMP06平均回 收率 分别为 83.36%、100.31%、98.09%、100.77%、99.76%、98.65%,RSD分别为 1.89%、1.55%、1.44%、1.65%、0.99%、1.28%。

表3 各杂质的回归方程和相关系数(n=6)
2.7 进样精密度
取泊马度胺对照品适量制成浓度为2 μg·mL-1的溶液,照“2.1”项下色谱条件,连续进样6次,记录峰面积,并对结果进行评价,RSD值为0.30%。
2.8 溶液稳定性
取“2.7”中的样品,置于4℃,分别于0、1.25、2.5、5、10、15、20、25 h照“2.1”项下色谱条件进样分析,记录峰面积,并对结果进行评价,RSD为0.29%。
2.9 样品测定结果
照以上方法测定3批样品,已知的6种杂质中检出IMP05存在于130502批与130503批中,结果见表4。
3 讨 论
3.1 流动相的筛选
杂质IMP02在普通色谱系统中难保留,故选择加入离子对试剂(辛烷磺酸钠),改善其保留效果,从而达到更好的分离。辛烷磺酸钠考察两种浓度,采用0.01 mol·L-1时,峰形较宽,IMP02有拖尾峰、肩峰;采用0.005 mol·L-1时峰形变窄。又考察了不同pH,发现pH对各物质出峰时间有影响,且pH越低峰形越好,但pH低于3.0时IMP01、IMP02、IMP06的分离度不好,故选择pH为3.0。
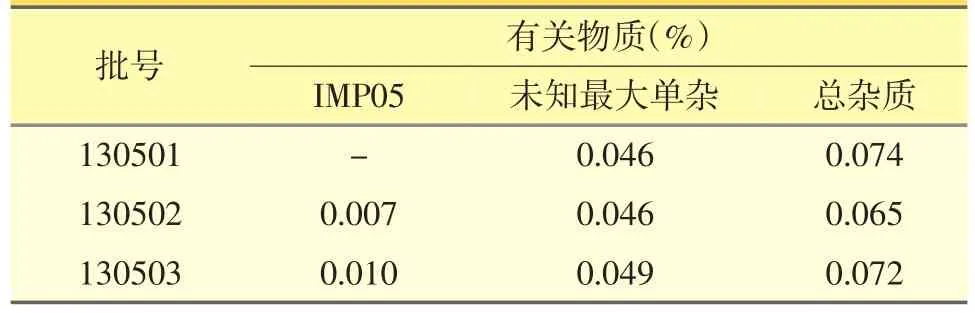
表4 泊马度胺3批样品杂质检测结果
3.2 进样器温度的选择
由于样品溶液在常温下不稳定,经过试验后将其置于4℃的自动进样器中。
3.3 检测波长的选择
IMP01、IMP02、IMP04为末端吸收,IMP03在227 nm处有最大吸收,IMP05在215 nm处有最大吸收,IMP06在228 nm处有最大吸收。泊马度胺在226 nm处有最大吸收。为了确保杂质能够检出,综合考虑本品在215 nm处杂质检出最佳,降解试验回收率符合要求,梯度基线干扰较小,适合有关物质检测。
经过方法学验证,此高效液相色谱法选择性高、重现性好,可作为泊马度胺质量控制的方法。
[1] LacyMQ,McCurdyAR.Pomalidomide [J].Blood, 2013,122(14):2305-9.
[2] U.S.Food and Drug Administration.FDA NEWS RE-LEASE:FDA approves Pomalyst for advanced multiple myeloma[EB/OL].(2013-02-08)[2014-09-30].http:// www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ ucm338895.htm.
Determination of the Related Substances of Pomalidomide by HPLC
ZHANG Xiao-yu1,GAO Ai-wei2,YANG Hao2,DING Li1*
1DepartmentofPharmaceuticalAnalysis,China PharmaceuticalUniversity,Nanjing 210009;2Nanjing Cavendish Bio-engineering Technology Co.,Ltd.,Nanjing 210046
Objective:To establish an HPLC method for the determination of pomalidomide and its related substances.Methods:The test for degradation and process impurities was based on an Inertsil ODS-3V(250 mm×4.6 mm,5 μm)column;Mobile phase consisted of octane sulfonic acid sodium buffer solution-methanol acetonitrile for gradient elution;The detection wavelength was set at 215 nm.Results:Related substances were completely separated from the main constituent.The recoveries were from 83.4%to 100.8%.Conclusion:This highly selective and reproducible HPLC method offers an option in the quality control of pomalidomide.
HPLC;Pomalidomide;Related substances
R927.11
A
1673-7806(2015)02-153-03
张笑雨,女,硕士生 E-mail:cpuzxy@126.com
*通讯作者丁黎,男,博士生导师,教授 E-mail:dinglidl@hotmail.com
2014-12-03
2014-12-27

