熔盐预电解脱水与电解时间对溶盐电解TiO2脱氧行为的影响
翁启钢,邱子力,袁铁锤,李瑞迪, 2,苏文俊,王 双,贺跃辉
熔盐预电解脱水与电解时间对溶盐电解TiO2脱氧行为的影响
翁启钢1,邱子力1,袁铁锤1,李瑞迪1, 2,苏文俊1,王 双1,贺跃辉1
(1. 中南大学粉末冶金国家重点实验室,长沙 410083;2. 华中科技大学材料成形与模具技术国家重点实验室,武汉 430074)
以无水氯化钙作为熔盐,采用熔盐电解法对TiO2阴极片进行脱氧,通过X射线衍射(XRD)和扫描电镜(SEM)对TiO2电解产物的相组成、电极表面形貌与元素组成进行观察与分析,研究熔盐的预电解脱水与熔盐电解时间对TiO2电解脱氧行为的影响。结果表明,熔盐未经预电解时,TiO2阴极片不发生脱氧反应,电解产物只有CaTiO3相;熔盐经预电解脱水后,TiO2电解产物部分或全部为低价钛氧化物,预电解时间达到15 h即可有效去除熔盐中的水分,从而获得较佳的熔盐电解脱氧效果,电解产物为氧含量较低的Ti2O。TiO2电解脱氧是分步进行的,随电解进行,先后出现Ti2O3、TiO、Ti2O,由于钛的化合价逐渐降低,所需分解压升高,导致脱氧效率逐渐降低。TiO2阴极的脱氧反应是由表面到心部进行,电解后的阴极片明显分层,表层为氧含量较低的Ti2O,中间层为CaTiO3和钛的低价氧化物,心部为CaTiO3。
预电解;电解时间;FFC法;脱氧行为
金属钛具有强度高、耐腐蚀、无磁性等优异性能,广泛应用于航空、医学和化工等领域。但目前金属钛的传统制备工艺克劳尔法[1]工序长、成本高,制约了钛的应用。2000年Nature杂志报道了直接电解TiO2制备金属Ti,该方法被称为FFC剑桥工艺[2],是将TiO2作为阴极,以惰性金属或石墨电极为阳极,以氯化物熔盐为电解质,在低于熔盐的分解电压下直接电解出金属钛。由于FFC法工艺简单、成本低且无污染,成为最有可能替代克劳尔法而且最具前景的钛制备新技术。
自FFC剑桥法首次报导后,国内外学术界进行了广泛深入的研究,波兰ELZBIETA[3]研究了TiO2电极的孔隙对电解TiO2的影响,发现孔隙尺寸比孔隙率的影响更大,孔隙越大,氧离子迁移越容易。ALEXANDER等[4]的研究表明 TiO2的开孔隙率为11%~12%、总孔隙率为15%~16%时,由于孔隙较少,进入孔隙的钙离子少,因而可抑制CaTiO3的生成,TiO2的还原过程为TiO2→Ti2O3→TiO→Ti-O。东北大学的廖先杰等[5]通过不同电解时间的电解实验研究了电解还原TiO2的动力学行为,发现TiO2的电解还原分为4步:TiO2→Ti3O5,Ti3O5→Ti2O3, CaTi2O4→TiO, TiO→Ti。郭晓玲等[6]利用TiO2和Fe2O3制备混合阴极,在1 173 ℃,3.1 V条件下电解10 h制备出TiFe合金。西北有色金属研究院[7−8]采用FFC剑桥工艺制备出金属Ti和TiZr、TiFe合金。
然而,FFC法存在以下问题:首先,氯化钙熔盐特别容易与空气中的水反应生成一系列结晶水合物,这些产物在电解过程中产生一系列副反应,影响TiO2的电解还原效果,因此必须通过预电解去除熔盐中的残留水分[9];其次,固态TiO2电化学的脱氧时间长,电流效率低。并且,TiO2的电解过程较复杂,是一个多步电化学反应过程,已有文献缺少对熔盐预电解脱水对TiO2脱氧行为影响的研究报道。基于此,本文作者主要研究熔盐预电解时间以及电解时间对TiO2脱氧行为的影响,以期建立TiO2电化学脱氧工艺的理论基础,为提高FFC法的生产效率与产品质量提供理论 参考。
1 实验
按照一定质量比称量TiO2粉末和PVA(聚乙烯醇),加水混合,搅拌均匀后放置在干燥箱中干燥24 h,然后破碎、研磨,过100目标准筛。所得粉末在30 MPa压力下压制成外径36 mm、内径16 mm、高度为4 mm的圆环形电极片。将压坯以2 ℃/min的速率升温至400 ℃,保温3 h,以去除粘结剂,随后继续以2 ℃/min的速率升温至950 ℃,保温4 h[10],得到TiO2电极片。
称取一定质量的无水氯化钙,加热到100 ℃,保温1 h,再升温至350 ℃,保温2 h,去除熔盐中的结晶水。然后在900 ℃真空条件下进行,以高纯石墨棒为预电解阴极和阳极进行熔盐预电解,电解电压2.4 V。将预电解时间为0、5、15和26 h的试样分别记为1#、2#、3#、4#。预电解完成后,将阴极更换为TiO2电极片,通入氩气保护,在3V的电压下电解4 h。实验结束后继续通氩气,冷却到室温后取出电极片,用蒸馏水进行冲洗,再用1%的盐酸溶液洗涤。根据电解后TiO2电极片的物相组成确定较佳的预电解时间,而后研究电解时间(1~14 h)对TiO2电解脱氧的影响。
使用Dmax 2500VB型 X 射线衍射仪分析TiO2阴极片电解还原后的相组成,用Nova Nano SEM 230型扫描电镜观察电解后TiO2电极片的截面形貌并分析元素组成。
2 结果与讨论
2.1 预电解时间的影响
氯化钙熔盐中水的存在会影响TiO2的脱氧效果,表1所列为电解时熔盐中的水可能参与的反应及各反应的标准自由能与理论分解压。预电解可有效去除熔盐中的水分。图1和图2所示分别为熔盐经过不同时间预电解处理后,TiO2阴极片电解还原后的XRD谱与电解还原的电流–时间曲线。由图1可见,熔盐未经预电解时,TiO2的电解还原产物为CaTiO3相,TiO2阴极片由TiO2和CaTiO3组成,说明TiO2阴极片未发生脱氧反应。但电解过程中有较大电流流过,是由于没有进行预电解,熔盐电解时熔盐中的水优先分解,因而电流较高。经过预电解后,熔盐中的大部分水分都已脱除,一部分电能开始用于阴极脱氧。熔盐经过5 h预电解时电解产物是氧含量较高的Ti2O3、TiO以及CaTiO3,这时因预电解时间不足,仍有较多电能用于水的分解;预电解15 h和26 h时,TiO2电解还原后基本上是氧含量较低的Ti2O(氧的质量分数14.28%),其中预电解 26 h时,除含有Ti2O外,还有少量CaTiO3。这是因为预电解15 h后熔盐中仍残留少量的水分,在电解开始时这些水与TiO2及熔盐直接反应生成CaTiO3,进一步转化为Ti2O。需要指出的是CaTiO3是TiO2多步脱氧过程必经的一种脱氧产物,由少量水分与TiO2及熔盐生成CaTiO3,一定程度上可减少后续TiO2的脱氧时间。由此可见熔盐中较多的残留结晶水不利于电解,电解时容易形成大量CaTiO3层,影响电极片内部的脱氧,但残余少量的水分有利于电解,可以加速电解中间产物CaTiO3的产生,促进TiO2的脱氧过程。

表1 CaCl2熔盐中的水参与的反应
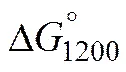
2.2 电解时间的影响
图3所示为不同电解时间下TiO2电解还原后的XRD谱,预电解时间固定为15 h。由图可见,电解1 h后的主要产物是Ti2O3和CaTiO3;电解3 h后的产物主要是TiO和CaTiO3;电解时间延长至5 h时开始出现Ti2O;随时间进一步延长,Ti2O含量逐渐增加,CaTiO3越来越少,电解14 h后阴极表层全部为Ti2O。由此可知TiO2的脱氧是分步完成的,脱氧路径与文献报道[11]基本一致。脱氧的前期除了生成钛的低价氧化物,还伴生有CaTiO3。比较电解5 h和7 h的电解产物XRD谱发现,电解7 h后CaTiO3衍射峰强度减弱,Ti2O衍射峰强度增加,表明随电解时间延长,CaTiO3开始分解,最终转变为Ti2O。表2所列为TiO2电解脱氧过程中所发生的反应[12]。

图2 熔盐的预电解时间对TiO2阴极电解脱氧的电流−时间曲线的影响

图3 不同电解时间下TiO2电解还原后的XRD谱
为了考察阴极反应的难易程度,将阴极反应统一考虑为氧离子失去电子生成氧气,求得各反应所需的分解压[13]。化合物分解所需要的电能在数值上等于它在恒压下的生成自由能,计算公式如下:
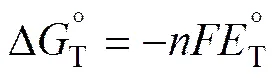

表2 熔盐电解过程中的主要阴阳极反应[12]
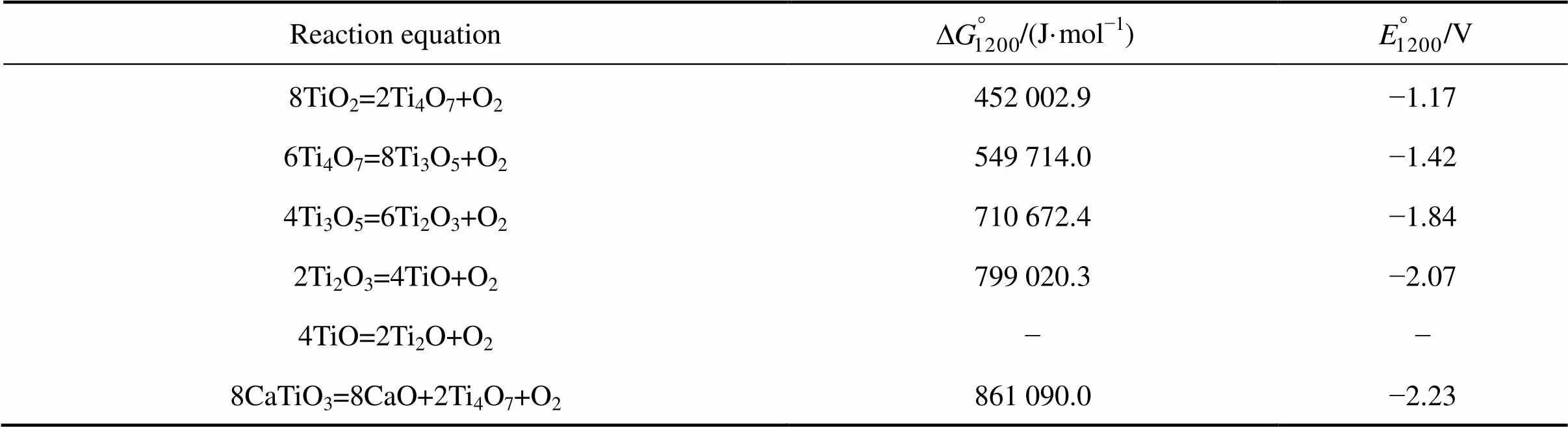
表3 TiO2电解脱氧反应的标准自由能及理论分解电压
由于TiO2脱氧是分步完成的,脱氧的可能路径是:TiO2→Ti4O7→Ti3O5→Ti2O3→TiO→Ti2O→Ti[14−17]。由表3可知,整个脱氧过程所需的理论分解压是递增的,意味着随钛化合价降低,脱氧难度增加。所以电解14 h的TiO2阴极中仍然含有Ti2O的原因可能是:1) 在槽电压一定的情况下,由于阴极极化等原因,造成的电压值不足以促使Ti2O继续脱氧;2) CaTiO3分解所需的电压远小于Ti2O分解所需的电压,所以电能优先满足CaTiO3脱氧。随着电解的进行,脱氧反应的速率和效率逐渐降低。
图4所示为电解7 h后TiO2电极片的截面形貌、以及不同区域的SEM形貌与EDS分析结果。由图4(a)可看出,电解产物分为3层,表层(A区域)为氧含量较低的Ti2O,中间层(B区域)为CaTiO3和钛的低价氧化物,心部(C区域)全是CaTiO3。可以看出脱氧反应主要在第2层发生,表层Ti2O较稳定,未继续脱氧。随电解时间延长,CaTiO3厚度不断减小,Ti2O层厚度增加。原因是TiO2分步脱氧所需分解压逐渐增加,电能在此阶段优先用于CaTiO3的脱氧。随电解的不断进行,阴极内部CaTiO3不断脱氧还原成Ti2O,电解反应逐步沿深度方向进行。

图4 电解7 h后TiO2电极片的截面形貌(a)以及不同区域的SEM形貌与EDS分析结果
3 结论
1) 以无水氯化钙作为熔盐,采用熔盐电解的方法对TiO2进行脱氧,熔盐中的残余水分对电解速率和阴极脱氧产生影响。熔盐未经预电解时,TiO2电解产物中未出现钛的低价氧化物相,只存在CaTiO3相;熔盐经5、15、26 h预电解后,TiO2电解产物有部分或全部为钛的低价氧化物相。在恒压2.4 V、预电解15 h可有效去除熔盐中的水分,从而获得较佳的TiO2电解脱氧效果。
2) TiO2熔盐电解1 h的主要产物是Ti2O3和CaTiO3,电解3 h的产物主要是TiO和CaTiO3,电解时间继续增加,开始出现Ti2O,随时间延长Ti2O量逐渐增加,CaTiO3越来越少,电解14 h后,表层全部是Ti2O。
3) 电极片的脱氧反应是由表面到心部进行的,电解后的阴极片明显分层,表层为稳定的阴极产物,中间为反应层,内层为CaTiO3。随钛氧化物化合价降低,分解压越高,脱氧效率降低。
REFERENCES
[1] KROLL W. The production of ductile titanium [J]. Trans Electrochem Soc, 1940, 78(1): 35−46.
[2] CHEN G Z, FRAY D J, FARTHING T W. Direct electrochemical reduction of titanium dioxide to titanium in molten calcium chloride [J]. Nature, 2000, 407(6802): 361−364.
[3] ELZBIETA K. Deoxidation of titania foams [C]. Honolulu: The Pacific Rim Meeting on Electrochemical and Solid-state Science, The Electrochemical Society, 2012.
[4] ALEXANDER D T L, SCHWANDT C, FRAY D J. The electro-deoxidation of dense titanium dioxide precursors in molten calcium chloride giving a new reaction pathway [J]. Electrochimica Acta, 2011, 56(9): 3286−3295.
[5] 廖先杰, 翟玉春, 谢宏伟, 等. 低温熔盐电解法制备金属Ti及其动力学[J]. 材料研究学报, 2012, 26(6): 590−596.LIAO Xian-jie, ZHAI Yu-chun, XIE Hong-wei, et al. Preparation of Ti by direct electrochemical deoxidation in low temperature molten salt [J]. Chinese Journal of Materials Research, 2012, 26(6): 590−596.
[6] 郭晓玲, 郭占成, 王 志. TiO2和Fe2O3直接电解还原制备TiFe合金[J]. 北京科技大学学报, 2008, 30(6): 620−624.GUO Xiao-ling, GUO Zhan-cheng, WANG Zhi. Direct preparation of TiFe alloy by electroly tic reduction from TiO2and Fe2O3[J]. Journal of University of Science and Technology Beijing, 2008, 30(6): 620−624.
[7] 杜继红, 奚正平, 李晴宇, 等. 熔盐电解还原制备TiFe合金[J]. 稀有金属材料与工程, 2008, 37(12): 2240−2243.DU Ji-hong, XI Zheng-ping, LI Qing-yu, et al. Preparation of TiFe alloy by electro-deoxidization in molten salt [J]. Rare Metal Materials and Engineering, 2008, 37(12): 2240−2243.
[8] 李晴宇, 杜继红, 奚正平, 等. 熔盐电解制备钛锆合金及其反应过程研究[J]. 稀有金属, 2009, 33(6): 779−784.LI Qing-yu, DU Ji-hong, XI Zheng-ping, et al. Reaction processes and preparation of TiZr alloy by electrolysis in molten salt [J]. Chinese Journal of Rare Metals, 2009, 33(6): 779−784.
[9] CHEN G Z, FRAY D J. Voltammetric studies of the oxygen- titanium binary system in molten calcium chloride [J]. Journal of the Electrochemical Society, 2002, 149(11): E455−E467.
[10] 王 双, 翁启钢, 吴浩波, 等. 熔盐电解法制取金属钛用TiO2电极片[J]. 粉末冶金材料科学与工程, 2012, 17(4): 535−540.WANG Shuang, WENG Qi-gang, WU Hao-bo, et al. Preparing TiO2cathode used in preparation of titanium by molten-salt electrolysis [J]. Materials Science and Engineering of Powder Metallurgy, 2012, 17(4): 535−540.
[11] YAN X Y, FRAY D J. Electrochemical studies on reduction of solid Nb(2)O(5) in molten CaCl(2)-NaCl eutectic [J]. Journal of the Electrochemical Society, 2005, 152(10): E308−E318.
[12] SCHWANDT C, FRAY D J. Determination of the kinetic pathway in the electrochemical reduction of titanium dioxide in molten calcium chloride [J]. Electrochimica Acta, 2005, 51(1): 66−76.
[13] 杨 帆, 李 钒, 姚传好, 等. Ti-O体系化合物的生成吉布斯自由能的计算与分析[J]. 过程工程学报, 2012, 12(5): 857−863. YANG Fan, LI Fan, YAO Chuan-hao, et al. Calculation and analysis of the standard gibbs free energy of formation for Ti-O compounds [J]. The Chinese Journal of Process Engineering, 2012, 12(5): 857−863.
[14] SCHWANDT C, ALEXANDER D T L, FRAY D J. The electro- deoxidation of porous titanium dioxide precursors in molten calcium chloride under cathodic potential control [J]. Electrochimica Acta, 2009, 54(14): 3819−3829.
[15] ALEXANDER D, SCHWANDT C, FRAY D J. Microstructural kinetics of phase transformations during electrochemical reduction of titanium dioxide in molten calcium chloride [J]. Acta Materialia, 2006, 54(11): 2933−2944.
[16] WANG S L, LI Y J. Reaction mechanism of direct electro-reduction of titanium dioxide in molten calcium chloride [J]. Journal of Electroanalytical Chemistry, 2004, 571(1): 37−42.
[17] SCHWANDT C, FRAY D J. Determination of the kinetic pathway in the electrochemical reduction of titanium dioxide in molten calcium chloride [J]. Electrochimica Acta, 2005, 51(1): 66−76.
(编辑 汤金芝)
Effects of pre-electrolysis dehydration and electrolysis time on TiO2deoxidation behavior during molten salt electrolysis
WENG Qi-gang1, QIU Zi-li1, YUAN Tie-chui1, LI Rui-di1, 2, SU Wen-jun1, WANG Shuang1, HE Yue-hui1
(1. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China;2. State Key Laboratory of Materials Processing Die & Mould Technology, Huazhong University of Science and Technology, Wuhan 430074, China)
The effects of pre-electrolysis dehydration and electrolysis time on the TiO2deoxidation during molten salt electrolysis were studied. The results showed that the electrolytic product was only CaTiO3phase in the molten salt without pre-electrolysis. When pre-electrolysis time of 5h, 15h, 26h were applied, the electrolytic products were partial or complete suboxide of titanium. Pre-electrolysis of 15h can remove moisture and deoxidize effectively. During the deoxidization process, the electrolytic products of Ti2O3, TiO, Ti2O were formed successively. With the decrease of titanium valence, the decomposition voltage increased and led to the low deoxidation efficiency. The deoxidation reaction occurred from surface to inner of the TiO2cathode. The electrolytic product showed layered structure with stable surface layer of Ti2O, interlayer of CaTiO3and low titanium oxide, inner layer of CaTiO3.
pre-electrolysis; electrolysis time; FFC; deoxidation
A
1673-0224(2015)2-155-07
国家自然科学基金资助项目(51474245,51301205);华中科技大学材料成形与模具技术国家重点实验室开放基金资助项目(P2014-07)
2014-05-07;
2014-06-24
袁铁锤,博士,研究员。电话:0731-88830142;E-mail: tiechuiyuan@csu.edu.cn

