新生儿肺透明膜病早产儿游离肉碱水平变化的探讨*
张李霞,戴怡蘅,徐景武,高平明
(佛山市妇幼保健院新生儿科,广东佛山528000)
新生儿肺透明膜病(hyaline membrane disease,HMD)又称新生儿呼吸窘迫综合征(respiratory distress syndrome,RDS),是由于肺表面活性物质(pulmonary surfactant,PS)缺乏所致,即生后不久出现呼吸窘迫并呈进行性加重的临床综合征。多见于早产儿,临床表现为生后数小时出现进行性呼吸困难、青紫和呼吸衰竭[1]。中国新生儿HMD 发病率约为1%,占新生儿死亡原因的30%,早产儿死亡原因的50%~70%,是早产儿死亡的主要原因[2]。早产儿游离肉碱水平偏低可能会导致肉碱转运降低以及肺组织合成PS 减少[3],进一步导致HMD 病情加重。但目前关于早产儿游离肉碱水平与HMD发病关系的临床研究尚浅,相关报道不多,且结果不一致。本研究测定了HMD早产儿生后6h内及3、7d血游离肉碱水平并分析其变化趋势。旨在探寻一条更加有效的途径预防和治疗HMD,减轻患儿的临床症状、缩短病程、降低并发症的发生率。
1 资料与方法
1.1 一般资料 收集本院2013年6月至2014年4月新生儿重症监护室胎龄为28~32周的早产儿63例,其中患HMD 的早产儿32 例作为观察组,男20 例,女12 例,出生体质量(1 479.45±304.21)g;未 患HMD 的 早 产 儿31 例 作 为 对 照组,其中男18例,女13例,出生体质量(1 537.83±378.39)g,两组患儿性别、胎龄、出生体质量比较,差异无统计学意义(P>0.05),具有可比性。HMD 的诊断标准参照《实用新生儿学(第4版)》[1]。病例排除标准:生后7d内死亡病例,患先天性遗传代谢性疾病、先天畸形,以及肝、肾衰竭,重度窒息及败血症的病例。两组患儿的基本临床资料比较,差异无统计学意义(P>0.05)见表1。
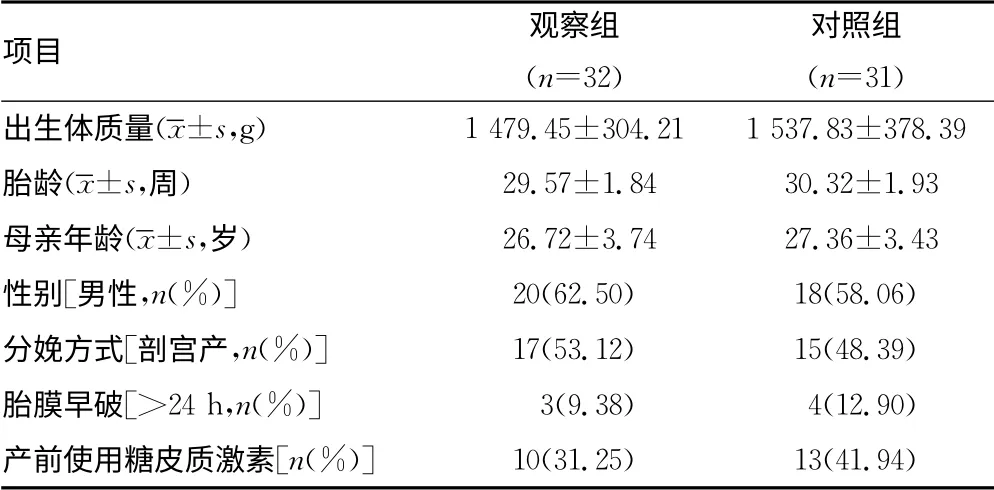
表1 两组患儿的基本临床资料比较
1.2 方法
1.2.1 喂养方法 所有患儿生后尽早开奶,使用早产儿专用配方奶,不能耐受胃肠喂养或经胃肠喂养热卡不足者,根据《中国新生儿营养支持临床应用指南》[4]进行营养支持。观察组患儿入院后根据病情需要进行固尔苏替代治疗,吸氧和辅助通气等对症支持处理。
1.2.2 游离肉碱水平的测定 采用API3200 型串联质谱仪(购自美国生物应用系统公司,Applied Biosystems),将干血滤纸片用打孔器制成3mm 的圆形滤纸片,置于96孔过滤板中,经过前处理后使用衍生法检测游离肉碱水平。所有患儿于生后6h内及3、7d采其足跟血,滴于专用滤纸上,形成1个直径为0.80~1.00cm 的均匀血斑,在空气中自然干燥后行串联质谱检测其游离肉碱水平。
1.3 统计学处理 采用SPSS13.0 软件进行统计分析。计量资料以±s表示,组间比较采用成组t检验,同组均数比较采用方差分析;计数资料用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结 果
两组患儿生后6h内游离肉碱水平比较,差异无统计学意义(P>0.05);生后3、7d观察组患儿游离肉碱水平较对照组显著下降(P<0.05)。观察组患儿生后游离肉碱水平逐渐下降,生后6h内及3、7d3个时间点的游离肉碱水平比较,差异有统计学意义(F=3.39,P=0.001);对照组生后6h内及3、7 d 3个时间点的游离肉碱水平比较,差异无统计学意义(F=0.42,P=0.660),见表2。
表2 两组患儿游离肉碱水平比较(±s,μmol/L)
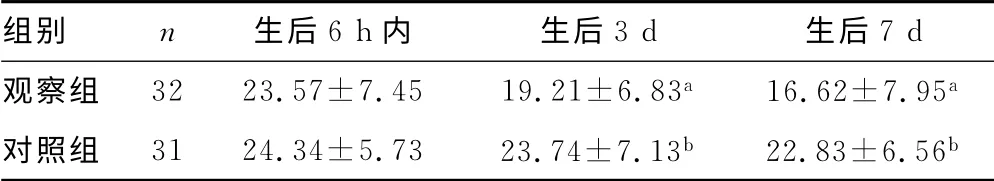
表2 两组患儿游离肉碱水平比较(±s,μmol/L)
a:P<0.01,与生后6h内比较;b:P<0.05,与观察组比较。
组别 n 生后6h内 生后3d 生后7d观察组 32 23.57±7.45 19.21±6.83a 16.62±7.95 a对照组 31 24.34±5.73 23.74±7.13b 22.83±6.56 b
3 讨 论
PS是由Ⅱ型肺泡上皮细胞合成并分泌的一种磷脂蛋白复合物,其主要成分为二棕榈酰磷脂酰胆碱(dipalmitoylphosphatidylcholine,DPPC)和表面活性物质结合蛋白(surfactant protein,SP),前者约占60%以上,后者约占10%。国外有动物实验及临床实验研究表明,孕妇产前补充肉碱能有效诱导PS 合成及促进胎肺成熟,在早产儿出生前给予孕妇肉碱加小剂量倍他米松,另一组给予大剂量倍他米松,前组HMD 发生率为7.3%,后组为14.5%;前组HMD 病死率1.8%,后组为7.3%,提示肉碱加小剂量皮质激素的预防效果好于单用皮质激素的效果[5]。Lohninger等[6]给怀孕大鼠补充肉碱,结果发现胎鼠肺组织的肉碱水平升高了约2 倍,且同时伴有总磷脂、卵磷脂及DPPC 水平的升高。
肉碱(carnitine)又名肉毒碱,结构为β-羟基-γ-三甲胺基丁酸。是人体内一种小分子、水溶性的氨基酸衍生物,迄今研究发现肉碱具有多种重要生理作用,主要是作为长链脂肪酸的惟一载体将胞浆中的长链脂肪酸转运至线粒体内进行β-氧化,提供能量。另外还具有抗氧化作用,避免自由基的损害,促进细胞膜磷脂的更新和修复,起到稳定线粒体膜和保护细胞的作用[7]。人体内的肉碱以游离肉碱和酰基肉碱两种形式存在,内源性肉碱的合成机理复杂,需要赖氨酸、蛋氨酸、烟酸、维生素B6、维生素C、铁6 种营养素参与[8]。Ⅱ型肺泡上皮细胞通过磷脂从头合成途径及细胞膜磷脂脂肪酸“结合-水解-再结合”合成DPPC,后者占肺泡细胞合成DPPC 的50%~70%,而肉碱通过促进细胞膜磷脂的更新和修复在细胞膜磷脂脂肪酸“结合-水解-再结合”中起主要作用[9]。由于胎儿体内的肉碱主要来源于母体,妊娠周数不足导致胎儿体内肉碱水平低下及早产儿肝脏合成肉碱功能低下可能是HMD 发病的重要原因之一。Jochen等[10]对临床上新生儿的组织中肉碱水平进行测定后观察得出,随着胎龄的增加,胎儿肉碱储备不断增加;早产儿体内游离肉碱水平低于足月儿,且胎龄越低,差距越明显。
为了明确是否早产儿的低游离肉碱水平与HMD 的发生有关,国外有学者进行了相关临床研究。Ayse等[11]研究发现,与同胎龄的非HMD 早产儿相比,HMD 早产儿生后2h内的血浆游离肉碱水平显著降低,两组早产儿的母亲游离肉碱水平无显著差异。他们认为可能存在以下2 种机制:(1)胎盘肉碱转运功能受损,因为两组早产儿的母亲肉碱水平无显著差异,可能因为母亲胎盘肉碱转运功能部分受损,导致早产儿游离肉碱水平低下而发生HMD,是否胎盘存在结构性或功能性的病理因素导致肉碱转运受损尚需进一步研究;(2)肉碱消耗增加,在HMD 早产儿,可能需要更多的游离肉碱从血浆转运至未成熟的肺组织以促进PS 合成。在许多组织内肉碱的水平都高于血浆游离肉碱的水平,在心脏、肝脏及肾脏中都存在一种肉碱主动转运机制,可以将肉碱逆浓度梯度进行转运,在肺组织中可能也存在这种转运机制,将游离肉碱从血浆中转运至肺组织中用于PS 的合成。而Ozturk等[12]在另外一项临床研究中发现,HMD 早产儿生后血浆游离肉碱水平未见明显下降,生后一周游离肉碱水平与对照组相比较有显著降低。此外,有报道称,肉碱的脂肪酸氧化中间产物棕榈酰肉碱具有类表面活性物质样作用,可以降低肺泡表面张力,缺乏此类物质会引起肺组织PS 合成减少,进而导致早产儿HMD 症状加重[13]。
综上所述,早产儿游离肉碱水平偏低可能会导致肉碱转运降低以及肺组织合成PS减少,进一步导致HMD 病情加重,但目前关于早产儿游离肉碱水平与HMD 发病关系的临床研究尚浅,相关报道不多,且结果不一致。本研究结果显示,HMD早产儿生后6h内的游离肉碱水平未见明显下降,但生后3、7 d的游离肉碱水平同对照组相比显著下降,且呈逐渐降低趋势,考虑其原因为HMD 早产儿生后需要更多的肉碱合成DPPC 以促进PS 生成。故对HMD 早产儿生后有必要定期监测游离肉碱水平,给孕妇或早产儿及时补充肉碱可能会预防或减轻HMD 的症状,但这需要进一步临床研究来证实。
[1] 邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].4版.北京:人民卫生出版社,2011:395-398.
[2] 陈宏香,温伟珍.肺表面活性物质治疗新生儿肺透明膜病37例临床观察[J]中国妇幼保健,2010,25(14):20-21.
[3] Lohninger A,Laschan C,Auer B.Animal experiment and clinical studies of the significance of carnitine for energy metabolism in pregnant patients and the fetus during the pre-and perinatal period[J].Wien Klin Wochenschr,1996,108(2):33-39.
[4] 中华医学会肠外肠内营养学分会儿科协作组,中华医学会儿科学分会新生儿学组,中华医学会小儿外科学分会新生儿学组.中国新生儿营养支持临床应用指南[J].中华儿科杂志,2006,44(9):711-714.
[5] Kurz C,Arbeiter K,Obermair A,et al.L-carnitine-betamethasone combination therapy versus betamethasone therapy alone in prevention of respiratory distress syndrome[J].Z Geburtshilfe Perinatol,1993,197(5):215-219.
[6] Lohninger A,Krieglsteiner HP,Hajos F,et al.Effects of prenatal treatment with betamethasone,L-carnitine or betamethasone-L-carnitine combinations on the phosphatidylcholine content and composition of the foetal and maternal rat lung[J].Eur J Clin Chem Clin Biochem,1996,34(5):387-391.
[7] Reda E,Diddio S,Nicolai R,et al.The camitine system and body composition[J].Acta Diabetes,2003,40(Suppl 1):S106-113.
[8] Matera M,Bellinghieri G,Costantino G,et al.History of L-carnitine:implications for renal disease[J].J Ren Nutr,2003,13(1):2-14.
[9] Arduino A,Gianni Z,Liliana F.Participation of carnitine palmitoyltransferase in the synthesis of dipalmitoylphosphatidylcholine in rat alveolar type Ⅱcells[J].Mol Cell Biochem,2001,218(1):81-86.
[10] Jochen M,Andreas S,Dirk K,et al.Acylcarnitine profiles of preterm infants over the first four weeks of life[J].Pediatr Res,2002,52(5):720-723.
[11] Ayse K,Gulsevin T,Turgay C,et al.Plasma carnitine levels in preterm infants with respiratory distress syndrome[J].Pediatr Int,2005,47(1):49-52.
[12] Ozturk MA,Gunes T,Koklu E,et al.Free carnitine levels in respiratory distress syndrome during the first week of life[J].Am J Perinatol,2006,23(7):445-450.
[13] Goni FM,Requero MA,Alonso A.Palmitoylcarnitine,a surface-active metabolite[J].FEBS Lett,1996,390(1):1-5.

