新型鸭呼肠孤病毒σC 蛋白间接ELISA 检测方法的建立
王锦祥,程晓霞,陈少莺*,陈仕龙,林锋强,王 劭
(1.福建省农业科学院 畜牧兽医研究所,福建 福州 350013;2.福建省畜禽疫病防治工程技术研究中心,福建 福州 350013)
鸭出血性坏死性肝炎是由新型鸭呼肠孤病毒(Novel duck reovirus,NDRV)引起鸭的一种新发传染病,其特征是肝脏不规则坏死和出血、心肌出血、脾脏肿大斑块状坏死、肾脏和法氏囊出血。NDRV主要感染雏鸭,感染鸭死亡率高,日龄愈小并发感染时其发病率、死亡率愈高,给养鸭业造成较大的经济损失。自陈少莺等首次将鸭出血性坏死性肝炎的病原鉴定为NDRV 后[1],在我国福建[2]、广东[3]和浙江[4]等地的鸭群中相继有该病发生的报道,疫区有逐年扩大的趋势。
目前,已报道的NDRV 实验室检测方法尚未见ELISA 方法报道。ELISA 是一种简便、快速、敏感且适用于大批量样品检测的血清学方法[5]。本研究以原核表达的NDRV 外衣壳蛋白σC 为检测抗原,建立了检测NDRV 抗体的间接ELISA 方法,为NDRV 抗体检测试剂盒的研制奠定基础。
1 材料和方法
1.1 菌株、血清和临床样品 重组菌pET-NDRVσC/BL21 由本实验室构建并保存;NDRV 阳性和阴性血清、番鸭呼肠孤病毒(MDRV)、鸭肝炎病毒(DHV)、番鸭细小病毒(MPV)和番鸭源鹅细小病毒(MD-GPV)阳性血清均由本实验室保存;NDRV 阴性血清为采自浙江、福建和广东等地区经NDRV 全病毒间接ELISA 检测为阴性的鸭血清;待检血清样品采自浙江、福建、广东等不同地区的212 份疑似NDRV 感染鸭。
1.2 主要试剂 辣根过氧化物酶标记的羊抗鸭IgG(IgG-HRP)购自美国KPL 公司;SDS-PAGE 凝胶试剂盒购自上海碧云天生物技术有限公司;镍离子亲和纯化柱购自GE 公司。
1.3 重组蛋白的表达及纯化 将重组菌pETNDRV-σC/BL21 进行诱导表达,按照His Trap FF 蛋白纯化步骤纯化σC 重组蛋白,通过SDS-PAGE 及western blot 对重组蛋白进行鉴定。
1.4 间接ELISA 方法的建立 将重组蛋白经pH9.6的碳酸盐缓冲液倍比稀释(50 μg/mL~3.12 μg/mL)后包被96 孔ELISA 板,每孔100 μL,4 ℃过夜。以NDRV 阳性血清和阴性血清(1∶20~1∶320)倍比稀释后为一抗,每孔100 μL,37 ℃作用90 min。以羊抗鸭IgG-HRP(1∶400)为二抗,37 ℃作用60 min。加入底物,37 ℃作用3 min~15 min,2 mol/L H2SO4终止反应,测定样品的OD490nm值。上述操作重复3次。以阳性血清OD490nm值大于1.0,P/N 值(阳性血清OD490nm/阴性血清OD490nm)最大时的反应条件为最佳工作条件。
1.5 间接ELISA 判断标准的确定 参照文献[6]的方法,将164 份NDRV 阴性血清在最佳工作条件下进行间接ELISA 测定。计算每份血清的S/P 值及平均值和标准方差(SD)确定阴阳性临界值S/P=(样品OD490nm值-阴性对照OD490nm值)/(阳性对照OD490nm值-阴性对照OD490nm值)
1.6 阻断试验 将阳性血清按最佳稀释度进行稀释,加入等体积最适稀释度的重组抗原,于37 ℃作用1 h,将上述混合液加入已包被抗原的酶标板,同时设阳、阴性血清对照组,进行ELISA 反应,测定其OD490nm。按(N-P)/N=(未阻断孔OD490nm值-阻断孔OD490nm值)/(未阻断孔OD490nm值)的公式计算,若结果大于0.5,则判断为阻断阳性。
1.7 特异性试验 按照建立的ELISA 方法,对本实验室保存的MDRV、DHV、MPV 和MD-GPV 的阳性血清进行检测,每份血清设3 个重复,同时设置NDRV 阳性和阴性血清对照,验证建立的ELISA方法的特异性。
1.8 重复性试验 采用同一时间和不同时间包被的ELISA 反应板,选取NDRV 抗体效价不同的8 份血清,按建立的间接ELISA 方法进行批内和批间重复性试验。每份血清重复检测3 次,评价该方法的重复性。
1.9 符合性试验 应用NDRV 全病毒间接ELISA和建立的σC 蛋白间接ELISA 方法对80 份疑似鸭血清样品进行检测,统计两者的符合率。
1.10 临床血清样品的检测 应用建立的σC 蛋白间接ELISA 方法,检测来自浙江、福建和广东等不同地区共132 份疑似NDRV 感染的血清样品,计算样品的阳性率。
2 结果
2.1 重组蛋白的表达及鉴定 重组菌pET-NDRVσC/BL21 经IPTG 诱导后对重组蛋白进行SDS-PAGE检测,结果显示重组蛋白获得表达,其分子量约为40 ku,与预期结果相符,并且重组蛋白以包涵体形式存在。Western blot 结果表明,重组蛋白与NDRV阳性血清发生特异性反应,具有良好的反应原性(图1)。
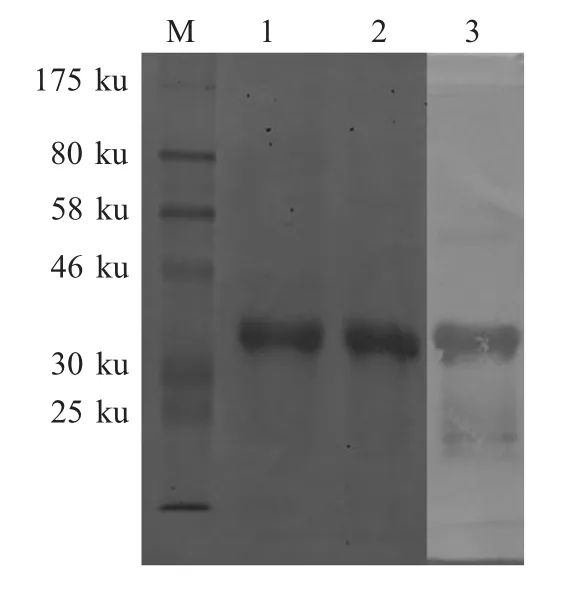
图1 NDRV σC 纯化蛋白的SDS-PAGE 和western blot 分析Fig.1 SDS-PAGE and western blot analysis of the purified NDRV σC protein
2.2 间接ELISA 反应条件的确定 对间接ELISA反应条件进行优化,结果见表1。
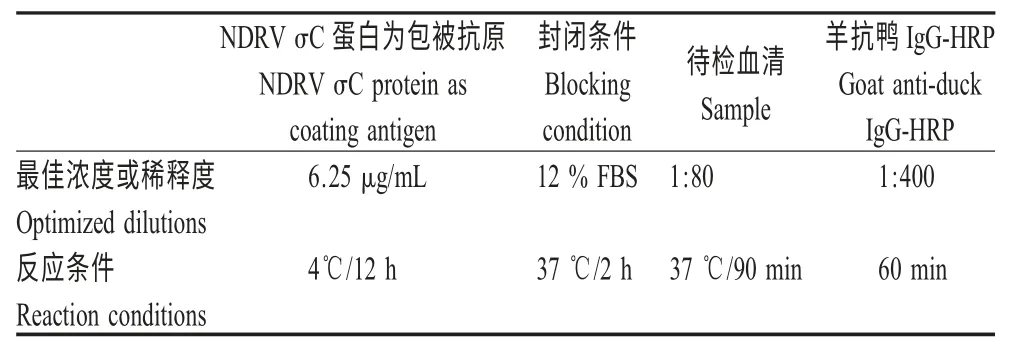
表1 间接ELISA 检测方法的反应条件优化结果Table 1 The optimized conditions of the indirect ELISA
2.3 间接ELISA 判定标准的确定 应用优化的间接ELISA 方法,对164 份NDRV 阴性血清样品进行检测,经计算为0.0564,SD 为0.0381。确定临界值为0.171,即OD490nm大于(等于)0.171判定为阳性,小于0.171 则判定为阴性(图2)。
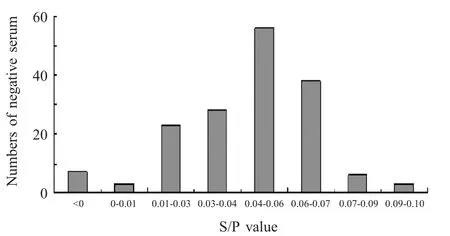
图2 阴性血清S/P 值分布图Fig.2 Frequency distribution of S/P value of negative serum
2.4 阻断试验 将阳性血清与重组抗原等体积混合后加入已包被抗原的ELISA 板进行阻断试验,结果显示,经重组蛋白阻断的阳性血清OD490nm值比未被阻断的对照阳性血清明显降低,阻断后OD490nm值平均为0.338,对照阳性血清的OD490nm值平均为1.560,计算阻断率为0.783,大于0.5,判定为阻断试验阳性,表明重组抗原可以阻断阳性血清与重组蛋白的反应。
2.5 特异性试验 对MDRV、DHV、MPV 和MDGPV 4 份阳性血清进行检测,结果表明重组蛋白与这4 种鸭病原的阳性血清均无交叉反应,表明该检测方法具有较好的特异性。
2.6 重复性试验 采用同一时间和不同时间包被的ELISA 板,对NDRV 抗体效价不同的8 份血清进行检测,结果显示,批内和批间重复性试验的变异系数均小于5%,表明该方法具有良好的重复性(表2)。
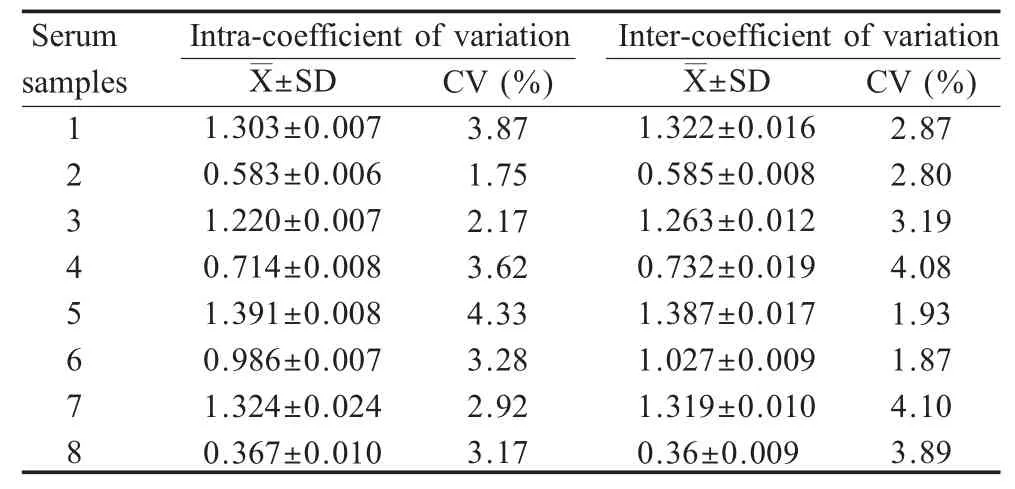
表2 间接ELISA 重复性试验Table 2 Repeatability assay for indirect ELISA
2.7 符合性试验 应用NDRV 全病毒间接ELISA和建立的σC 蛋白间接ELISA 方法对80 份疑似鸭血清样品进行检测。结果显示NDRV 全病毒间接ELISA 的阳性检出率为41.25 %(33/80),阴性检出率为58.75 %(47/80)。本研究建立的σC 蛋白间接ELISA 方法阳性检出率为35 %(28/80),两者符合率为88.75 %(表3)。
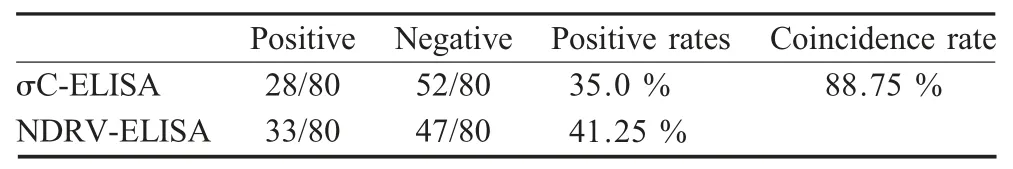
表3 σC 蛋白间接ELISA 和NDRV 全病毒间接ELISA方法的符合性试验Table 3 Comparison of the agreement between σC-ELISA and NDRV-ELISA
2.8 临床样品的检测 应用建立的σC 蛋白间接ELISA 方法对浙江、福建、广东等不同地区的132份疑似感染鸭血清样品进行检测,结果显示检出阳性样品57 份,阳性率为43.18 %(57/132)。
3 讨论
σC 蛋白是禽源呼肠孤病毒(ARV)的重要结构蛋白。在病毒感染过程中,σC 蛋白被活化,形成同源三聚体,与易感细胞表面的受体结合,促使病毒侵入易感细胞,是病毒的重要致病因子。此外,σC蛋白还能诱导机体产生保护性中和抗体[7-9]。研究表明,杆状病毒表达的ARV[10]和MDRV[11]的σC 蛋白能够有效地诱导实验动物产生保护性抗体,表明σC 蛋白是一种保护性抗原。耿宏伟等利用E.coli 系统表达出具有良好反应原性的MDRV σC 蛋白,并基于该蛋白建立了间接ELISA 方法[12]。本实验也选择E.coli 系统表达NDRV σC 蛋白。经western blot鉴定表明,重组蛋白具有良好的反应原性。因此,选择E.coli 表达的σC 蛋白作为抗原能够满足建立检测NDRV 抗体间接ELISA 方法的要求。
目前,国内外尚未见利用NDRV 重组σC 蛋白作为包被抗原建立间接ELISA 方法的报道。本实验利用原核表达系统表达了NDRV σC 蛋白,并采用纯化的蛋白作为包被抗原,建立了检测NDRV 抗体的间接ELISA 方法,并对反应条件进行了优化。同时试验表明其具有良好的特异性和重复性。通过对浙江、福建和广东3 省采集的132 份疑似血清样品进行检测阳性率为43.18 %。因此,采用该方法用于检测大批量血清样品具有较高的应用价值,可以广泛应用于σC 蛋白抗体的流行病学调查,同时也为研制检测NDRV 抗体的间接ELISA 试剂盒奠定了基础。
[1]陈少莺,陈仕龙,林锋强,等.一种新的鸭病(暂名鸭出血性坏死性肝炎)病原学研究初报[J].中国农学通报,2009,25(16):28-31.
[2]陈少莺,陈仕龙,林锋强,等.新型鸭呼肠孤病毒的分离与鉴定[J].病毒学报,2012,28(3):224-230.
[3]袁远华,吴志新,黄兴国,等.新型鸭呼肠孤病毒病研究进展[J].养禽与禽病防治,2012,10:18-20.
[4]Wang Dan,Xu Feng,Ma Guo-ming,et al.Complete genomic sequence of a new Muscovy duck-origin reovirus from China[J].J Virol,2012,86(22):12445.
[5]范祚舟,徐加发,沈萍萍.酶联免疫分析技术研究进展[J].中国预防兽医学报,2011,27(1):113-118.
[6]董井泉,张蕾,马波,等.1 型鸭肝炎病毒VP1 蛋白优势抗原区的鉴定及抗体检测ELISA 方法的建立[J].中国预防兽医学报,2014,36(7):542-546.
[7]马辉,赵绪永.ELISA 技术在畜牧行业中的应用及研究进展[J].郑州牧业工程高等专科学校学报,2010,30(2):13-15.
[8]Weiner H L,Fields B N.Neutralization of reovirus:the gene responsible for the neutralization antigen[J].J Exp Med,1977,146:1305-1310.
[9]Gouvea V S,Schnitzer T J.Polymorphism of the migration of double-stranded RNA genome segments of avian reoviruses[J].J Virol,1982,43:465-471.
[10]Wickramasinghe R,Meanger J,Enriquez C E,et al.Avian reovirus proteins associated with neutralization of virus infectivity[J].Virology,1993,194:688-696.
[11]Kuntz S G,Blanchard P,Cherbonnel M,et al.Baculovirusexpressed muscovy duck reovirus sigma C protein induces serum neutralizing antibodies and protection against challenge[J].Vaccine,2002,(20):3113-3122.
[12]耿宏伟,郭东春,张云,等.以番鸭呼肠孤病毒σC 表达蛋白为抗原的ELISA 检测方法的建立[J].中国兽医科学,2006,36(3):171-176.

