酶解龙须菜粗多糖硫酸基工艺优化
殷 勤,肖安风,2,3,4,朱艳冰,2,3,4,蔡慧农,2,3,4,倪 辉,2,3,4,杨秋明,2,3,4
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,
福建 厦门 361021;3.厦门市食品生物工程技术研究中心,福建 厦门 361021;
4.厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建 厦门 361021)
酶解龙须菜粗多糖硫酸基工艺优化
殷勤1,肖安风1,2,3,4,朱艳冰1,2,3,4,蔡慧农1,2,3,4,倪 辉1,2,3,4,杨秋明1,2,3,4
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,
福建 厦门 361021;3.厦门市食品生物工程技术研究中心,福建 厦门 361021;
4.厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建 厦门 361021)
[摘要]为探索重组芳香基硫酸酯酶水解龙须菜粗多糖的动态过程变化,同时为重组酶的应用提供基础数据,以pET-28a为表达载体,在大肠杆菌(E.coli)中诱导表达获得能特异性水解硫酸酯的重组芳香基硫酸酯酶.并利用重组芳香基硫酸酯酶水解海藻龙须菜中的硫酸基团,以硫酸基含量和硫酸基脱除率为指标,利用单因素试验研究各因素对龙须菜粗多糖硫酸基水解过程的影响.试验确定了脱除龙须菜粗多糖硫酸基团的工艺条件,结果表明,重组芳香基硫酸酯酶水解龙须菜粗多糖的适宜工艺条件为:水解温度40 ℃,pH值7.0,初始底物5 g/L,加酶量108.14 U,振荡速率120 times/min,酶解反应2 h,在此工艺条件下脱除了78.4%的硫酸基团,凝胶强度提高2.1倍,凝固温度、融化温度分别为38.4 ℃和91.3 ℃.重组芳香基硫酸酯酶在酶解过程中水解龙须菜粗多糖中硫酸酯表现出较高的活力.
[关键词]重组;芳香基硫酸酯酶;酶解;工艺;龙须菜;粗多糖;硫酸基
0引言
琼脂是来源于红藻类海藻细胞壁的天然有机多糖胶体,由70%琼脂糖和30%琼脂果胶(质量分数)构成.琼脂糖是由(1-3)-β-D-半乳糖和(1-4)-3,6-内醚-α-L-半乳糖组成的链状聚合物,而琼脂果胶的结构则比较复杂,其主要结构与琼脂糖相同,只是(1-4)-3,6-内醚-α-L-半乳糖上的羟基易被硫酸基、甲氧基、丙酮基等基团替代.琼脂中的这些基团会影响分子间交联,从而降低琼脂的凝胶强度[1-2].凝胶强度是衡量琼脂产品品质的主要指标,硫酸基团是阻碍琼胶分子形成凝胶的关键因素.琼脂作为凝固剂、稳定剂、药膏基材和瞬时吸收剂等在食品工业、医药、化工等领域具有广泛的应用[3-5].目前琼脂工业生产中普遍使用碱法去除海藻原料中的硫酸酯基团[6].碱法处理工艺不仅产生严重的环保问题,还会导致琼脂大量降解流失[7].与碱处理工艺相比,采用酶水解技术去除琼脂中的硫酸酯基团具有反应条件温和、特异性高的特点,减少了产品污染和化学排放,而且可提高琼脂产品质量,是新型琼脂生产技术的发展方向.
近年来,相关研究发现,来自Sphingomonassp.AS6330、Pseudoalteromonascarrageenovora、Pyrococcusfuriosus和Thermotogamaritima等少数微生物的芳香基硫酸酯酶(arylsulfatase,EC 3.1.6.1)具有琼脂硫酸酯水解活性,Kim等[8]2004 年筛选到一株产芳香族硫酸酯酶的菌株Sphingomonassp.AS6330,该酶能降解琼脂、岩藻糖、卡拉胶等多种海藻多糖上的硫酸基团,且对琼脂的脱硫效果最好,能水解琼脂上97.7%的硫酸根,经酶处理后凝胶强度可提升2.44倍;Lim等[9]2004年利用异源表达的方法,在大肠杆菌中成功表达了Pseudomonascarrageenovora菌株中的芳香族硫酸酯酶,纯化后的重组芳香基硫酸酯酶与琼脂反应后,琼脂凝胶强度增加了2倍,73%的硫酸根被去除;Jung等[10]2011年将Pyrococcusfuriosus中芳香基硫酸酯酶基因克隆并在大肠杆菌中表达,纯化后的重组芳香基硫酸酯酶可以脱除75%的硫酸基;Lee等[11]2013年将Thermotogamaritima中的芳香基硫酸酯酶克隆并在大肠杆菌中表达,重组芳香基硫酸酯酶脱除了琼脂中60%的硫酸基.
在前期研究中,本课题组成功克隆芳香基硫酸酯酶基因并在大肠杆菌(E.coliBL21 (DE3))中表达,得到重组芳香基硫酸酯酶(recombinant arylsulfatase),该酶具有水解人工底物对硝基苯硫酸钾(p-NPS)和脱除龙须菜(Gracilaria lemaneiformis)粗多糖硫酸基团的活力.本文在前期工作基础上,通过单因素试验优化酶法脱除龙须菜粗多糖硫酸基团的条件,得出了适合龙须菜粗多糖脱硫的相关工艺参数,完善了脱硫工艺.通过调整相关工艺参数,有效地提高了重组芳香基硫酸酯酶脱除硫酸基团的功能效果,降低了脱硫成本,为实现酶法脱除硫酸基团辅助提取琼脂的研究积累了实践资料.
1材料与方法
1.1 材料与试剂
重组芳香基硫酸酯酶:将来源于假交替单胞菌(Pseudoalteromonas carrageenovora)Ary987 的芳香基硫酸酯酶基因(GenBank:KJ509595)克隆、表达至大肠杆菌(E.coli)中,发酵培养大肠杆菌获得重组芳香基硫酸酯酶,收集发酵培养后的菌体,复溶后用低温超声波破碎细胞,再冷冻离心后收集上清液,经Ni-NTA纯化后获得重组芳香基硫酸酯酶,经考马斯亮蓝法测得蛋白质质量浓度为0.27 mg/mL,酶的比活力为26.7 U/mg (酶活力U定义:在一定条件下,每分钟催化生成1 μmoL 对硝基苯酚(p-NP)所需的酶量).龙须菜购于福建厦门集美菜市场.硫酸钾、盐酸、氯化钡、吐温-80、无水乙醇、氢氧化钠等均为分析纯,国药集团化学试剂北京有限公司.
1.2 仪器与设备
UV-2600A紫外可见分光光度计(尤尼柯(上海)仪器有限公司);ZHWY-2012双层全温度恒温摇床(上海智诚实验设备有限公司);BS223S电子天平(赛多利斯科学仪器(北京)有限公司);SW-CJ-2FD超净工作台(苏州净化设备有限公司);Minispin 高速离心机(德国Eppendorf公司);LDZX-40KAS立式高压蒸汽灭菌锅(上海申安医疗器械厂).
1.3 方法
1.3.1龙须菜粗多糖的制备
取100 g的龙须菜剪成1~2 cm小段,加入100 mL水,在80 ℃水浴2 h,加入300 mL沸水,置于高压灭菌锅中,在0.12 MPa、121 ℃保持30 min,用8层纱布过滤,滤液冷却后称重,于-20 ℃冷冻完全后,加入1.5倍体积的95%乙醇(体积分数)融化脱水,用85%乙醇(体积分数)浸泡后,于50 ℃烘干,粉碎,制得龙须菜粗多糖干粉,备用.
1.3.2单因素试验优化重组芳香基硫酸酯酶脱除龙须菜粗多糖硫酸基团
称取一定量的龙须菜粗多糖干粉用50 mmol/L Tris-HCl (pH=7.0)缓冲液配制成5 g/L龙须菜粗多糖溶液,加入重组芳香基硫酸酯酶酶液在一定温度下水浴振荡2 h,每15 min取样测定硫酸基团含量.在保持其他条件不变的情况下分别改变底物浓度、pH值、加酶量、温度、振荡速率进行单因素试验.
1.3.3检测指标
1)硫酸基含量的测定:参照文献[12]测定样品硫酸基含量.
2)凝胶强度的测定:参照国家标准食品添加剂琼脂GB 1975—2010[13]测定样品凝胶强度(g/cm2).
3)凝固温度和融化温度的测定:参照文献[3]进行.
4)硫酸基脱除率的计算:硫酸基脱除率/%=[(总硫酸基含量-游离硫酸基含量)/总硫酸基含量]×100.
2结果与分析
2.1 单因素试验结果
2.1.1底物浓度对重组芳香基硫酸酯酶脱除硫酸基团的影响按照1.3.2的条件,分别考察不同底物浓度下重组芳香基硫酸酯酶水解龙须菜粗多糖的过程变化,结果如图1所示.可见,底物硫酸基含量随着底物浓度的增加而减小,而硫酸基脱除率则上升.在底物浓度较低时,反应体系均匀,不易凝固,产物易于扩散到溶液中,故在一定的底物浓度范围内,保持残留硫酸基含量随着底物浓度的增加而减小、硫酸基脱除率上升的趋势.底物浓度过高,酶量达到饱和且随反应时间的延长致龙须菜粗多糖凝固等因素影响酶解效率,故硫酸基含量及硫酸基脱除率趋于稳定.从酶解龙须菜粗多糖的转化率及底物利用效率角度考虑,选取质量浓度为5 g/L的龙须菜粗多糖为底物时较佳.
2.1.2pH值对重组芳香基硫酸酯酶脱除硫酸基团的影响来源于细菌的芳香基硫酸酯酶,有些最适pH值为6.5~7.1,有些最适pH值为8.3~9.0[14],Salmonellatyohimurium的芳香基硫酸酯酶最适pH值为6.7[15],如Pseudomonasaeruginosa的芳香基硫酸酯酶最适pH值为8.9[16].按照1.3.2的条件,分别考察不同pH值下重组芳香基硫酸酯酶水解龙须菜粗多糖的过程变化,结果如图2所示.结果表明,重组芳香基硫酸酯酶对pH值的变化不敏感,在待测的pH值条件下均呈现硫酸基团含量逐渐减小、硫酸基脱除率逐渐增加的趋势,且在pH=7.0时,硫酸基团含量降至最低,硫酸基脱除率达到最高,故确定重组芳香基硫酸酯酶酶解龙须菜粗多糖的最适pH值为7.0.
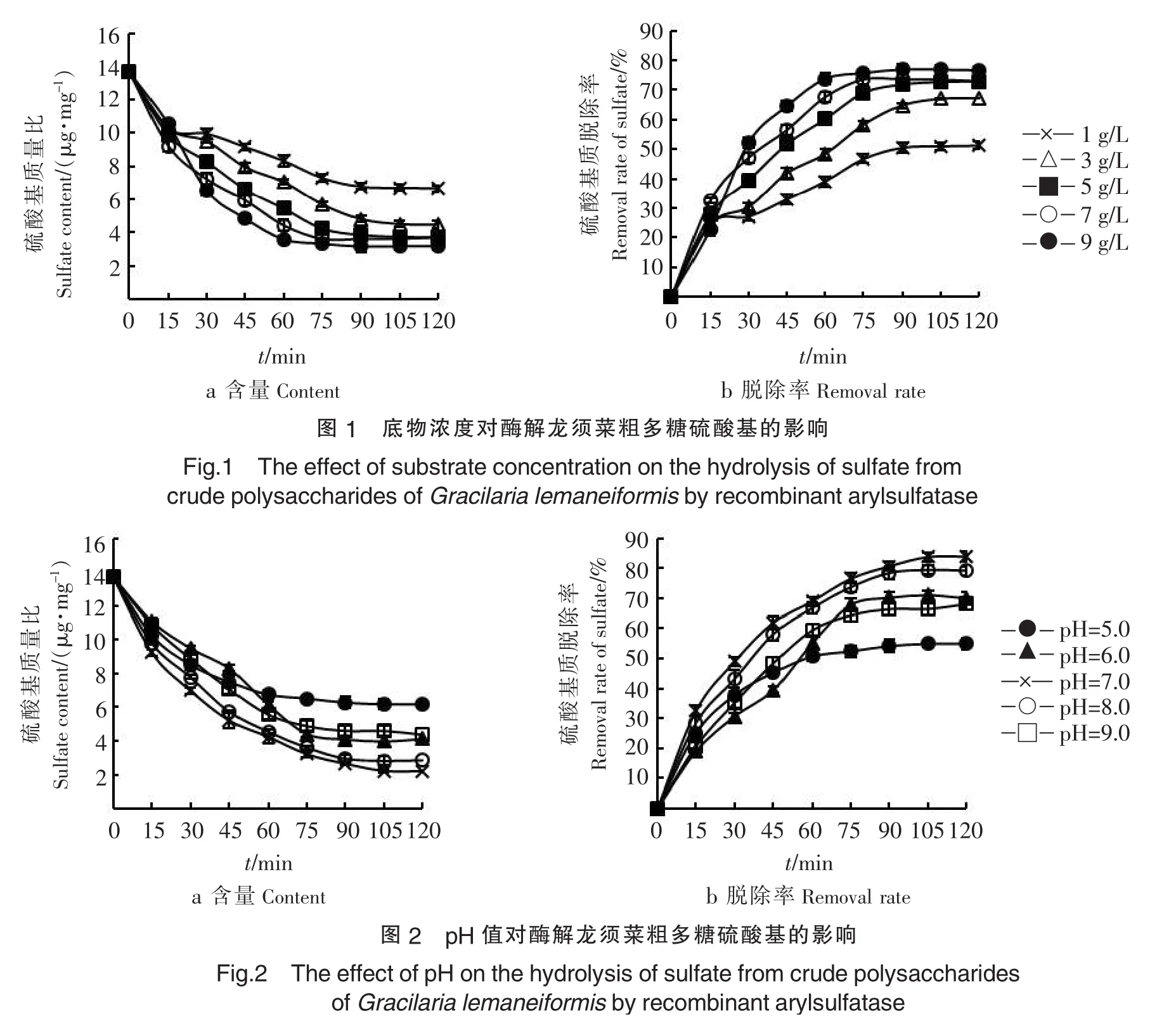
2.1.3加酶量对重组芳香基硫酸酯酶脱除硫酸基团的影响如图3,在加酶量小于108.14 U时,随着重组芳香基硫酸酯酶用量的增加,硫酸基含量减小及硫酸基脱除率逐渐增加,当加酶量大于108.14 U时,重组芳香基硫酸酯酶用量的增加对硫酸基含量及硫酸基脱除率没有明显影响.其原因主要是酶与底物的吸附作用有一定的饱和度,当酶过量时酶与底物结合饱和,再增加酶量,水解反应速率不再提高.从节约生产成本降低能耗角度考虑,最适酶用量为108.14 U,在此条件下,硫酸基脱除率在反应30 min后增加至69.1%,此后硫酸基脱除率变化不大.
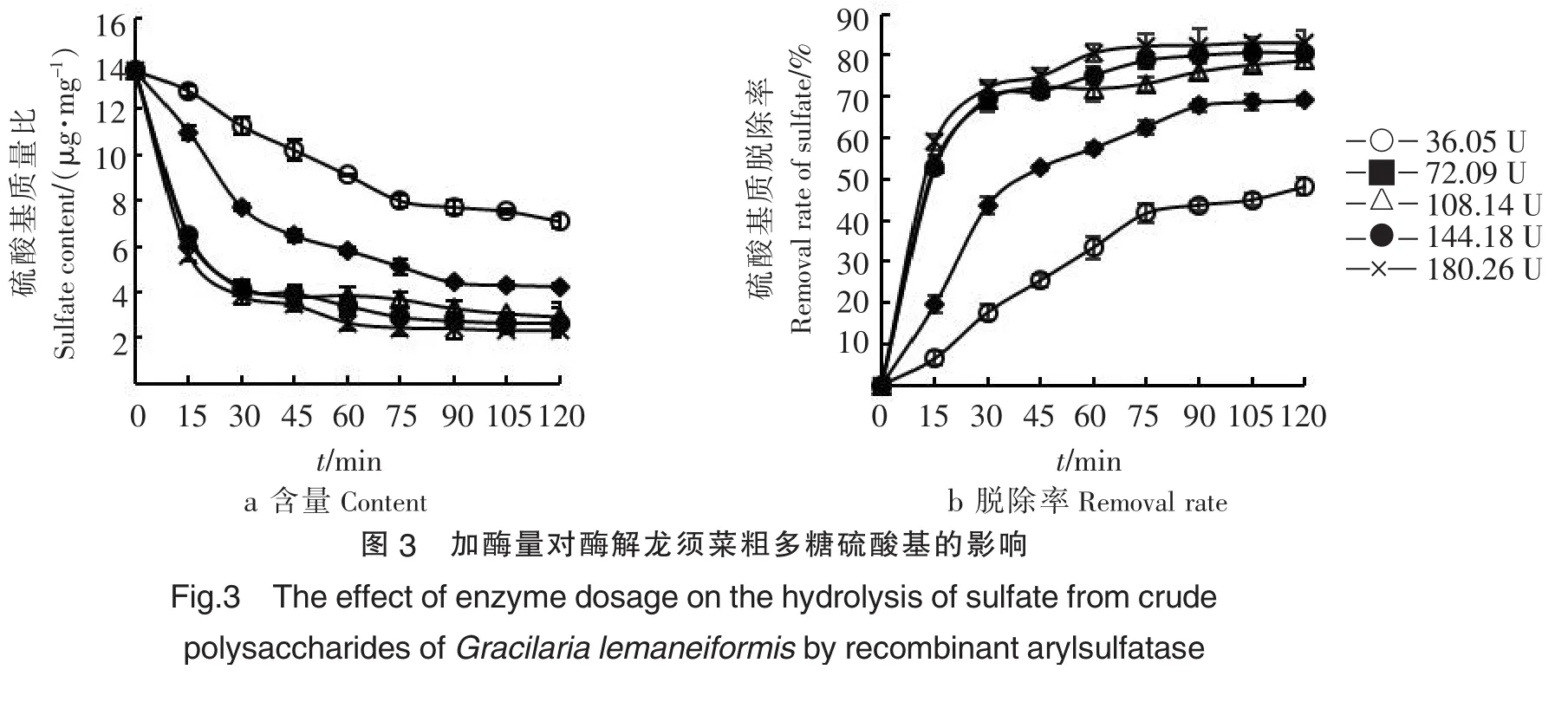
2.1.4温度对重组芳香基硫酸酯酶脱除硫酸基团的影响如图4,当酶反应温度小于40 ℃或大于40 ℃时,随着温度的升高,都呈现硫酸基含量减小及硫酸基脱除率增加的趋势;在40 ℃时硫酸基含量最低、硫酸基脱除率达到最高.此外,还可以发现,在反应的前30 min,50 ℃时的硫酸基含量及硫酸基脱除率要高于40 ℃时的硫酸基含量及硫酸基脱除率,这说明相比于40 ℃,重组芳香基硫酸酯酶在50 ℃时虽然活力更高,但更易失活,从而导致50 ℃条件下硫酸基含量及硫酸基脱除率反而小于40 ℃.在40 ℃的反应条件下,硫酸基脱除率在反应45 min后率先增加至58.7%,因此确定酶水解最适温度为40 ℃.

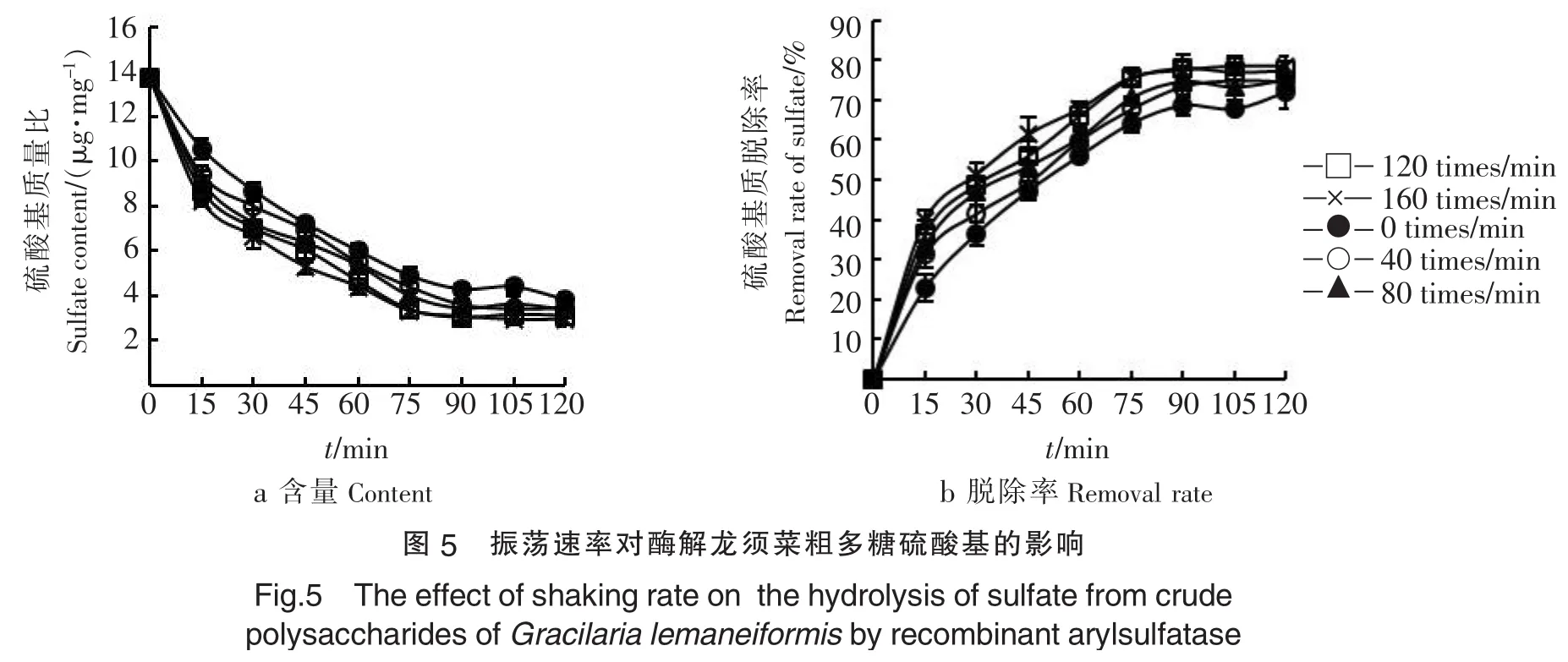
2.1.5振荡速率对重组芳香基硫酸酯酶脱除硫酸基团的影响振荡可增加酶与底物接触的机会,加速酶促反应的进行,且龙须菜粗多糖样品易于凝固,更应在反应时加以振荡,以保证酶促反应的催化效率及底物转化率.分别考察不同振荡速率下重组芳香基硫酸酯酶水解龙须菜粗多糖的动态过程变化,如图5,当振荡速率为160 times/min时,硫酸基含量最低及硫酸基脱除率最高,但与120 times/min的结果相差不大,为降低能耗,故选择120 times/min为宜.
2.2 酶解产物凝胶强度、凝固温度和融化温度的测定
由于琼胶分子的结构差异,如硫酸基的含量与结合位置不同,以及甲氧基、丙酮酸的含量不同等,分子质量和纯度的不同所生成的凝胶表现出的弹性强度有明显的差别,这种弹性强弱以凝胶强度(gel strength)表示.参照文献[13]的方法,在单因素优化后的实验条件下,将酶与底物反应后的产物用于测量龙须菜粗多糖的凝胶强度.琼胶具有溶胶和凝胶的可逆反应特性,因而表现两种形态转变温度,即凝固温度和融化温度.酶处理组和空白组的凝胶强度、凝固温度、融化温度、基质含量、硫酸基脱除率的测定结果分别为:428 g/cm2,38.4 ℃,91.3 ℃,2.883 μg/mg,78.4%;205 g/cm2,40.7 ℃,90.5 ℃,13.372 μg/mg,1.2%.经酶处理后的龙须菜粗多糖凝胶强度比空白组提高了2.1倍.
3结论
本试验用单因素试验的方法,对重组芳香基硫酸酯酶脱除龙须菜粗多糖硫酸基的酶促反应条件进行了优化,优化后最佳的反应条件为:底物质量浓度5 g/L,pH值为7.0,加酶量40%,温度40 ℃,振荡速率120 times/min,在该条件下反应后酶解产物的凝胶强度达428 g/cm2,比空白组提高了2.1倍,脱除了78.4%的硫酸基,凝固温度为38.4 ℃,融化温度为91.3 ℃.
[参考文献]
[1]MARINHO-SORIANO E,BOURRET E.Polysaccharides from the red seaweedGracilariadura(Gracilariales,Rhodophyta)[J].Bioresour Technol,2005,96(3):379-382.
[2]CHI W J,CHANG Y K,HONG S K.Agar degradation by microorganisms and agar-degrading enzymes[J].Appl Microbiol Biotechnol,2012,94(4):917-930.
[3]纪明侯.海藻化学[M].北京:科学出版社,1997:104-109,94-96.
[4]SOUZA B W S,CERQUEIRA M A,BOURBON A I,et al.Chemical characterization and antioxidant activity of sulfated polysaccharide from the red seaweedGracilariabirdiae[J].Food Hydrocolloid,2012,27(2):287-292.
[5]GARCIA C A,ALNAIEF M,SMIRNOVA I.Polysaccharide-based aerogels-promising biodegradable carriers for drug delivery systems[J].Carbohyd Polym,2011,86(4):1425-1438.
[6]戚勃,杨贤庆,李来好,等.冷碱处理条件与龙须菜琼胶强度的关系[J].食品科学,2009,30(22):23-26.
[7]薛志欣,杨桂朋,王广策.龙须菜琼胶的提取方法研究[J].海洋科学,2006,30(8):71-77.
[8]KIM J H,BYUN D S,GODBER J S,et al.Purification and characterization of arylsulfatase fromSphingomonassp.AS6330[J].Appl Microbiol Biotechnol,2004,63(5):553-559.
[9]LIM J M,JANG Y H,KIM H R,et al.Overexpression of arylsulfatase in E.coli and its application to desulfatation of agar[J].J Microbiol Biotechnol,2004,14(4):777-782.
[10]JUNG K T,KIM H W,YOU D J,et al.Identification of the first archaeal arylsulfatase fromPyrococcusfuriosusand its application to desulfatatiom of agar[J].Biotechnol Bioproc E,2012,17:1140-1146.
[11]LEE D G,SHIN J G,JEON M J,et al.Heterologous expression and characterization of a recombinant thermophilic arylsulfatase fromThermotogamaritime[J].Biotechnol Bioproc E,2013,18:897-902.
[12]DODGSON K S,PRICE R G.A note on the determination of the ester sulfate content of sulfated polysaccharides[J].Biochem J,1962,84(1):106-110.
[13]中华人民共和国卫生部.GB 1975—2010 食品安全国家标准 食品添加剂 琼脂[S].北京:中国标准出版社,2010.
[14]KERTESZ M A.Riding the sulfur cycle-metabolism of sulfonates and sulfate esters in Gram-negative[J].FEMS Microbiol Rev,1999,24(2):135-175.
[15]HENDERSON M J,MILAZZO F H.Arylsulfatase inSalmonellatyohimurium:detection and influence of carbon source and tyramine on its synthesis[J].J Bacteriol,1979,139(1):80-87.
[16]BEIL S,KEHRLI H,JAMES P,et al.Purification and characterization of the arylsulfatase synthesized byPseudomonasaeruginosaPAO during growth in sulfate-free medium and cloning of the arylsulfatase gene(atsA)[J].Eur J Biochem,1995,229:385-394.
(责任编辑马建华英文审校曹敏杰)
Optimization of Enzymatic Hydrolysis of Sulfate in Crude Polysaccharidefrom Gracilaria lemaneiformis by Recombinant Arylsulfatase
YIN Qin1,XIAO An-feng1,2,3,4,ZHU Yan-bing1,2,3,4,CAI Hui-nong1,2,3,4,NI Hui1,2,3,4,YANG Qiu-ming1,2,3,4
(1.College of Food and Biological Engineering,Jimei University,Xiamen 361021,China;
2.Fujian Provincial Key Laboratory of Food Microbiology and Enzyme Engineering,Xiamen 361021,China;
3.Research Center of Food Biotechnology of Xiamen,Xiamen 361021,China;4.Key Laboratory of Recycling Application
and Deep Processing in Economic Marine Alga,Xiamen South Oceanographic Research Center,Xiamen 361021,China)
Abstract:The arylsulfatase gene from a marine aerobic Gram-negative bacterium,Pseudoalteromonas carrageenovora,was cloned into pET-28a vector and expressed in E.coli BL21 (DE3).The technical conditions for sulfate hydrolysis of Gracilaria lemaneiformis by recombinant arylsulfatase were optimized by single factor experiments based on sulfate content and sulfate removal rate.The optimum parameters for sulfate hydrolysis by recombinant arylsulfatase were obtained as substrate concentration of 5 g/L,initial pH of 7.0,enzyme dosage of 108.14 U,at 40 ℃,oscillation rate of 120 times/min and enzymatic duration of 2 h.After crude polysaccharide from Gracilaria lemaneiformis was treated with purified fusion recombinant arylsulfatase for 2 h at 40 ℃,the gel strength of the products increased by 2.1 folds,and 78.4% of the sulfate in the crude polysaccharide was removed.The gelling temperature and melting temperature were 38.4 ℃ and 91.3 ℃,respectively.It was thus expected that the recombinant arylsulfatase could be used for the desulfation of sulfated polysaccharides and applied in the production of low sulfated agar or agarose.
Key words:recombination;arylsulfatase;enzymatic hydrolysis;technology;Gracilaria lemaneiformis;crude polysaccharide;sulfate
[文献标志码]A
[中图分类号]Q 814.9
[文章编号]1007-7405(2015)03-0173-06
[作者简介]殷勤(1990—),女,硕士生,主要从事食品生物技术研究.通信作者:杨秋明(1977—),男,高级实验师,主要从事食品微生物及工艺方面的研究,E-mail:yangqm@jmu.edu.cn.
[基金项目]国家自然科学基金资助项目(31401632);厦门市科技计划项目(3502Z20120005);厦门南方海洋研究中心项目(13GZP004NF10)
[收稿日期]2014-11-17[修回日期] 2015-01-23

