LLO对大鼠肠黏膜微血管内皮细胞分泌NO和ET-1的影响
陈希,穆祥,许剑琴
(1.中国兽医药品监察所,北京 100081;2.北京农学院兽医学(中医药)北京市重点实验室,北京 102206;3.中国农业大学动物医学院,北京 100094)
LLO对大鼠肠黏膜微血管内皮细胞分泌NO和ET-1的影响
陈希1,穆祥2*,许剑琴3*
(1.中国兽医药品监察所,北京 100081;2.北京农学院兽医学(中医药)北京市重点实验室,北京 102206;3.中国农业大学动物医学院,北京 100094)
为探讨李斯特菌溶血素(LLO)导致大鼠肠黏膜微血管内皮细胞(RIMVECs)损伤的作用机制,将体外培养的RIMVECs分为对照组和LLO组,观察细胞形态变化,测定细胞生长情况,并检测细胞培养上清液中NO、ET-1浓度变化。结果表明:LLO组RIMVECs的细胞间隙变大,有大量细胞碎片漂浮;当LLO浓度达到50ng/mL以上时,测得细胞增殖(OD值)均呈极显著下降(P<0.01);12 h内,NO、ET-1分泌量高于正常水平。试验表明,LLO引起RIMVECs细胞因子NO、ET-1分泌量升高,导致细胞微环境紊乱,是LLO导致肠黏膜微血管内皮细胞损伤的机制之一。
大鼠肠黏膜;微血管内皮细胞;LLO;NO;ET-1
李斯特菌溶血素(Listeriolysin O,LLO)是产单核细胞李斯特菌(L.monocytogenes,LM)的最主要毒力因子[1]。LM通过分泌LLO作用于内皮细胞等靶细胞,导致细胞因子分泌紊乱及细胞膜穿孔,进而侵入细胞内增殖并诱发机体产生病理症状[2-3]。LM在自然感染时,最主要的特征是入侵中枢神经系统和胎盘。因此,LLO可引起构成血脑屏障和胎盘屏障的微血管内皮细胞损伤。作为一种重要的食源性细菌,LLO是否首先作用于肠黏膜微血管内皮细胞,并引起细胞损伤尚未见报道。由于不同组织器官的微血管内皮细胞在形态、结构、功能上存在异质性,本研究以大鼠肠黏膜微血管内皮细胞(Rat Intestinal Mucosal Microvascular Endothelial Cells,RIMVECs)为研究对象,旨在了解LLO对肠黏膜微血管内皮细胞的损伤机制。
1 材料和方法
1.1 材料 DMEM培养基,Gibco公司;D-Hank’s干粉,Sigma公司;胰蛋白酶,Gibco公司;优质胎牛血清,FBS,PAA公司;L-谷氨酰胺,Sigma公司;兔抗人第Ⅷ因子相关抗原抗血清,中杉金桥生物技术公司;羊抗兔IgG-FITC,中杉金桥生物技术公司;NO测试试剂盒,晶美生物工程有限公司;大鼠ET-1酶联免疫检测试剂盒,美国R&B公司。Wistar大鼠,1日龄,中国科学院遗传与发育生物学研究所动物中心提供,符合国家实验动物标准。
1.2 LLO的分离纯化 参照文献方法[4],将培养的LM菌液离心通过0.22 μm过滤,硫酸铵沉淀、透析、浓缩处理后,通过SephadexG-100分子筛层析,洗脱回收。经SDS-PAGE鉴定LLO为单条带型,达电泳级纯度,分子量为60000 Da。
1.3 RIMVECs的分离培养 参考文献方法[5],选用1日龄Wistar大鼠,用外科手术方法获得空肠,D-Hank’s液冲洗后,仔细撕除肠管浆膜层附着的肠系膜,暴露出肠黏膜微血管丰富组织。经过胰酶消化,120~150 μm细胞筛过滤,与完全培养基(DMEM培养基、20%胎牛血清、2% L-谷氨酰胺、100 U/mL青霉素、10 μg/mL链霉素)混合,接种于细胞培养板,置于5%CO2培养箱中培养。应用差速贴壁、胰酶消化和机械刮除法对培养细胞除杂纯化,待纯化细胞生长至80%融合时即可进行传代。倒置显微镜下,可见单层细胞呈典型的铺路石状相嵌排列。免疫荧光法检测内皮细胞第Ⅷ因子相关抗原抗阳性(图1)。
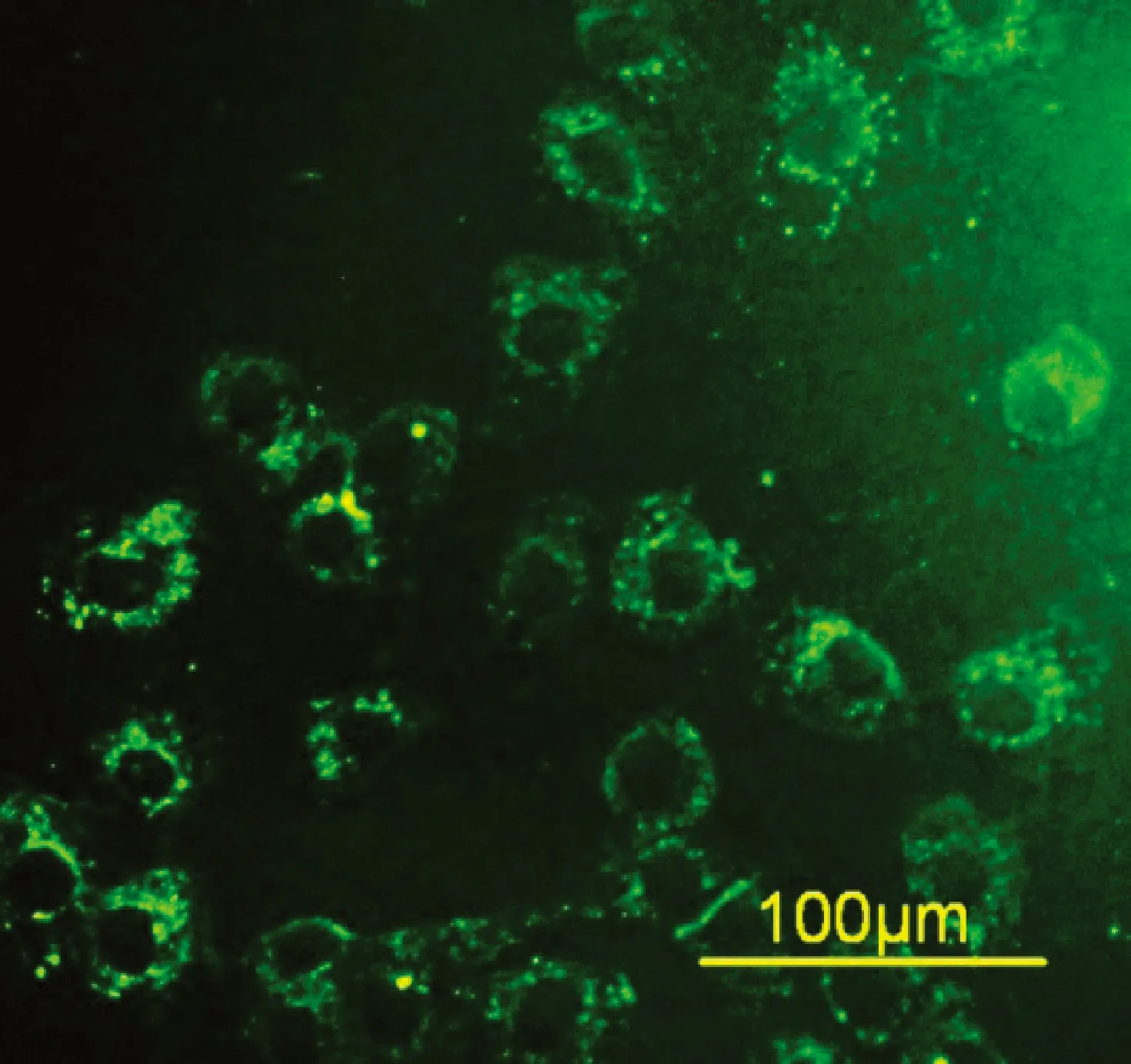
图1 第Ⅷ因子相关抗原抗鉴定阳性
1.4 细胞处理 试验使用第3代细胞。将融合生长的内皮细胞,以0.25%胰蛋白酶消化,细胞悬液接种于96孔细胞培养板,细胞密度5×108/L,每孔加150 μL完全培养基,置37 ℃、5% CO2条件下培养,待细胞融合成单层细胞即行试验。
1.4.1 不同浓度LLO对RIMVECs形态及增殖的影响观察 将培养板中已生长融合的RIMVECs分为空白组(LLO为0 μg/mL)和LLO处理组,按LLO终浓度分为5 μg/mL、1 μg/mL、500 ng/mL、50 ng/mL和5 ng/mL,每组设重复孔6个,空白组加维持培养基。培养12 h后镜下观察细胞形态及不同浓度LLO对细胞增殖的影响。
1.4.2 LLO对RIMVECs分泌NO、ET-1的影响观察根据细胞增殖测定结果,将培养板中已生长融合的RIMECs分为空白组(LLO为0 g/mL)和LLO处理组(50 ng/mL),每个组分5个不同时间段的亚组。每个亚组设5 个重复孔。空白组加维持培养基。分别于培养1、3、6、9、12 h 后收集上清液,3000 r/min离心5 min后,取上清于- 20 ℃条件下保存待测。
1.5 细胞增殖的测定 参照文献方法[6],采用MTT法测定细胞增殖情况,即将96孔细胞培养板置入CO2培养箱中,37 ℃、5%CO2静置培养24 h。吸净细胞上清液后,在各孔细胞中加入5 mg/mL的MTT 30 (L及150 (L的DMEM维持培养基,继续培养4 h后,轻轻吸弃孔内液体,每孔加入150 μL DMSO,37 ℃孵育30 min后,待细胞内结晶充分溶解,于酶标仪570 nm波长处测定各组OD值。
1.6 细胞培养上清液内NO及ET-1浓度的测定参照文献方法[7],采用硝酸还原酶法测定NO浓度,双夹心ELISA法测定ET-1浓度,具体参照试剂盒说明进行。
2 结果与分析
2.1 不同浓度LLO对RIMVECs形态及增殖的影响 细胞培养12 h后,镜下观察LLO各浓度组和空白组细胞,对比发现,LLO处理组(5 μg/mL、1 μg/mL)可见大量漂浮细胞碎片,基本没有残存贴壁细胞;LLO处理组(500 ng/mL、50 ng/mL)可见不同程度的细胞间隙变大,细胞碎片漂浮;LLO处理组5ng/mL和空白组细胞形态良好(图2)。
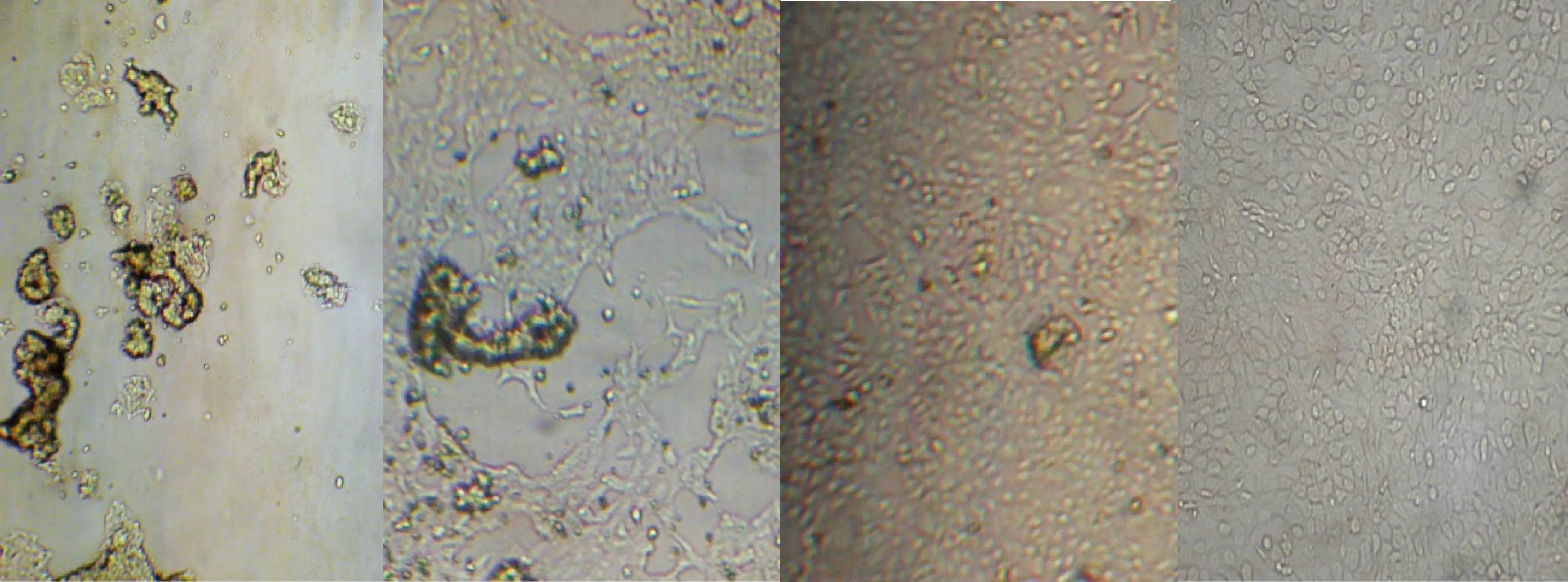
从左到右LLO浓度依次为:1 μg/mL、500 ng/mL、50 ng/mL和0 ng/mL图2 RIMVECs在不同浓度LLO作用下的形态学观察(12 h)
LLO处理组(除5 ng/mL以外),细胞增殖(OD值)均极显著下降(P<0.01)低于对照组,且50ng/mL的LLO浓度即可抑制细胞增殖或对细胞造成损伤(图3)。因此确定以50ng/mL的LLO浓度作为后续试验毒素作用浓度。
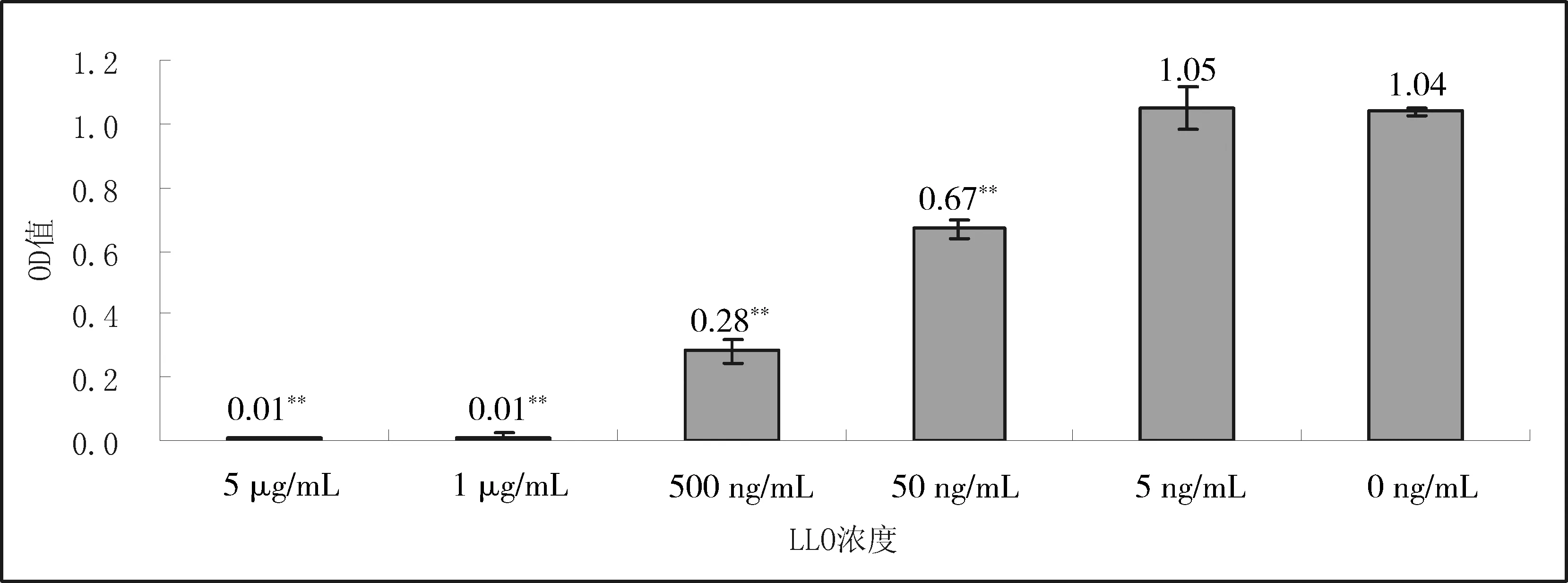
与空白组相比,**表示P<0.01图3 不同浓度LLO对RIMVECs增殖的影响
2.2LLO对RIMVECs分泌NO和ET-1的影响 由表1可知,12h内,各时间段LLO组NO分泌量均高于正常水平;细胞ET-1的分泌量如表2所示:各时间段LLO组ET-1分泌量均高于空白组。结果表明:在12h内,50ng/mL的LLO可以引起RIMVECs分泌NO和ET-1升高,12h达到最高值。

表1 RIMVECs细胞培养上清液NO浓度的变化 μmol/L

表2 RIMVECs细胞培养上清液ET-1浓度的变化 pg/mL
2.3 LLO对RIMVECs细胞微环境NO、ET-1平衡关系的影响 由图4可知,空白组RIMVECs的NO/ET比值维持在10左右,而LLO组比值随时间逐渐下降,说明LLO可以破坏RIMVECs分泌NO、ET-1的平衡,导致细胞微环境紊乱。
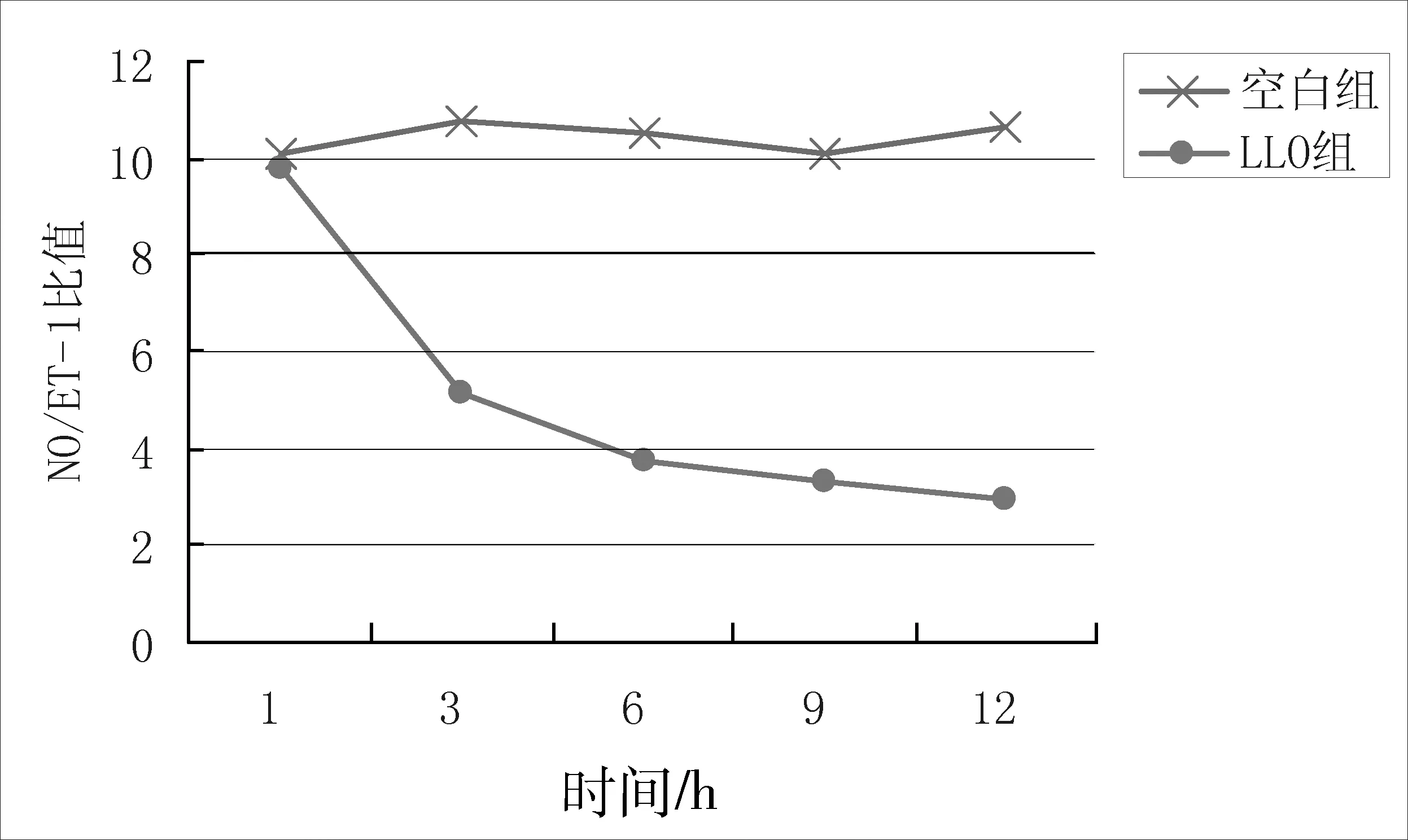
图4 不同时间段测得两组细胞NO/ET-1的比值
3 讨论与小结
3.1 LLO对RIMVECs形态及增殖的影响 血管内皮细胞受损是创伤、感染、休克、肿瘤、全身性炎症反应综合征以及多器官功能障碍发生、发展的病理学基础[8-10]。肠黏膜作为机体天然屏障部位,必然在肠道感染、细菌移位中起到关键作用,位于肠黏膜上的RIMVECs不仅是被动的靶细胞,更是一种效应细胞[11]。据文献报道[6],LM通过分泌毒力因子LLO,可侵入多种宿主细胞,包括上皮细胞、肝实质细胞、成纤维细胞、内皮细胞、甚至巨噬细胞。在自然感染时,最主要的特征是入侵中枢神经系统和胎盘。因此,循环系统内的LM必须通过与血管内皮细胞作用穿过血脑屏障和胎盘屏障。同时,微血管内皮细胞沿血液流动的方向,不仅构成了血脑屏障,也构成了肝、肾等其它组织器官内血液与组织间的主要屏障。因此,LM引起各组织器官的损伤首先要通过微血管内皮细胞并与其发生作用。目前,国外已有报道表示通过体外细胞试验(人脑微血管内皮细胞、人脐静脉内皮细胞)证实了LM对血管内皮细胞的刺激与损伤[7-8]。本研究表明,经不同浓度的LLO处理后,RIMVECs的形态损害程度随着LLO浓度的增加而加剧,细胞间隙逐渐增大,证明该内皮细胞是LLO作用的靶细胞。LM感染后可通过释放毒力因子LLO导致肠黏膜上的RIMVECs损伤,进而突破肠黏膜屏障进入血液。
3.2 LLO对RIMVECs分泌NO、ET-1及NO/ET比值的影响 NO是一种由血管内皮细胞分泌的内源性血管舒张因子[12],作为一种重要的信使分子对于动、静脉和微血管均有扩张作用,能够抑制缺氧引起的血管收缩,并具有神经传递以及杀灭微生物和肿瘤细胞等多种生物学功能[11]。而ET-1是目前已知的最强大的血管收缩剂,其作用正好同NO相颉颃。研究表明,NO的降低导致血管舒张水平降低,高浓度ET强烈收缩动、静脉,尤以冠状动脉、肾、肠系膜、脑及皮肤等微循环血管,加重微循环障碍及内皮细胞损害,恶性循环致组织缺氧,细胞能量耗竭进一步加重,最终导致多器官功能衰竭的发生[13]。本研究表明,LLO可导致RIMVECs分泌NO、ET-1增多,NO/ET-1比值逐步下降,NO/ET-1平衡破坏,引起微循环障碍。同时,NO和ET-1的平衡关系被打破,微血管的紧张度发生异常改变,这可能是LM感染机体引起肠道组织损伤及机体多种组织器官病变原因之一。
本研究通过检测LLO对体外培养RIMVECs的细胞形态、分泌NO、ET-1及NO/ET-1比值变化,确定LLO可直接损伤RIMVECs,并引起NO浓度升高以及ET-1的降低,说明LLO引起的肠黏膜微血管内皮细胞功能障碍在李斯特菌病的发生发展过程中起着重要的作用。关于LLO引起NO、ET-1以及其他细胞因子紊乱的分子作用机制还需进一步深入研究。
[1] Czuprynski J C,Faith G N,Steinberg H.A/J mice are susceptible and C57BL/6 mice are resistant toListeriamonocytogenesinfection by intragastric inoculation [J].Infection and Immunity,2003,71(2): 682-689.
[2] 崔焕忠,乔立桥,王义冲.单核细胞增生性李斯特菌的主要毒力因子及其致病机理[J].中国畜牧兽医,2010,37(1): 128-133.
[3] Kayal S,Lilienbaum A,Poyart C,etal.Listeriolysin O-dependent activation of endothelial cells during infection withListeriamonocytogenes: activation of NF-kB and upregulation of adhesion molecules and chemokines [J].Molecular Microbiology,1999,31(6): 1709-1722.
[4] 陈希,徐亮,胡格,等.产单核细胞李斯特菌溶血素的纯化[J].中国预防兽医学报.2008,30(8): 605-608.
[5] 索占伟,穆祥,许剑琴,等.大鼠肠黏膜微血管内皮细胞的体外培养[J].解剖学报,2005,36 (2) :214-217.
[6] 关心,杨同华,张爱玲,等.附子中的新乌头碱对K562细胞增殖和凋亡的影响[J].北京中医药大学学报,2015,7:37-42.
[7] Chen X,Xu J Q,Mu X,etal.Effects of rhynchophylline and isorhynchophylline on nitric oxide and endothelin-1 secretion from RIMECs induced by Listeriolysin Oinvitro[J].Veterinary Microbiology,2010,143: 262-269.
[8] Gonzalez A P,Sepulveda S,Massberg S,etal.Invivofluorescence microscopy for the assessment of microvascular reperfusion injury in small bowel transplants in rats [J].Transplantation,1994,58: 403-408.
[9] Kurose I,Granger D N.Evidence implicating xanthine oxidase and neutrophils in reperfusion-induced microvascular dysfunction [J].Ann N Y Acad Sci,1994,723: 158-179.
[10]Suzuki M,Grisham M B,Granger D N.Leukocyte endothelial cell adhesive interactions: role of xanthine oxidase-derived oxidants [J].J Leukoc Biol,1991,50: 488-494.
[11]杨雪静,曹俊敏,侯佳惠.姜黄素对LPS诱导大鼠肠黏膜微血管内皮细胞分泌TNF-α的影响[J].中国微生态学杂志,2015,9:1014-1018.
[12]Furchgott R F,Zawadzki J V.The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by cetylcholine [J].Nature ,1980 ,288 : 373 -376.
[13]Moncada S,Palmer R M,Higgs E A.Nitric oxide: physiology,pathophysiology,and pharmacology [J].Pharmacol Rev,1991,43:109-142.
(编辑:李文平)
Effects of Lipopolysaccharide on Secretion of NO and ET-1 of Rat Intestinal Mucosa Microvascular Endothelial Cellsinvitro
CHEN Xi1,MU Xiang2*,XU Jian-qin3*
(1.ChinaInstituteofVeterinaryDrugControl,Beijing100081,China;2.BeijingUniversityofAgriculture,Beijing102206,China;3.CollegeofVeterinaryMedicine,ChinaAgriculturalUniversity,Beijing100094,China)
The purpose of this study was to research on the functional mechanism of Listeriolysin O (LLO) damaging intestinal mucosa microvascular endothelial cells.Rat intestinal mucosa microvascular endothelial cells (RIMVECs) were in culture divided into blank control group and LLO group.Cells were observed under microscope and assessed proliferation by MTT assay.The Changes of NO and ET-1 level in cell culture supernatants were measured.Compared with blank group,the intercellular space was enlarged in LLO group.Cell debris floated in culture medium.When the concentration of LLO was up to 50 ng/mL,proliferation of RIMVECs was very significantly decreased.The production of NO and ET-1 were enhanced for 12h.The functional mechanism of LLO damaging intestinal mucosa microvascular endothelial cells may be that LLO leads to the rise in the secretion of NO and ET-1.
intestinal mucosa;microvascular endothelial cells;LLO; NO;ET-1
北京市自然科学基金A类重点项目(6061001);北京市教委人才强教“学术创新团队”中药方剂研究(5090245)
陈希,博士,从事中兽药相关研究。
穆祥,muxiang1109@sina.cn;许剑琴,E-mail: jianqinxucau@126.com
2015-10-28
A
1002-1280 (2015) 12-0009-05
S852.44

