乳化凝胶化法微囊化益生菌抗胁迫作用研究
张 琳 贠婷婷 綦文涛* 李 杰 王永伟 李爱科
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.国家粮食局科学研究院,北京 100037)
益生菌在疾病防治和抗生素替代方面已经表现出了巨大潜力[1],国际营养学界认可益生菌(probiotics)是一类定植于人体肠道、生殖系统内,能产生确切健康功效,从而改善宿主微生态平衡、发挥有益作用的活性有益微生物的总称[2]。因此,对于一个益生菌产品,保存及使用期间保持较强的活力,是其品质最关键的评价准则。然而,许多益生菌产品在保质期内的活菌很少,完全达不到我国益生菌类保健食品申报与审评规定中对活菌数的要求[3]。此外,益生菌在加工过程中,受高温、高湿及挤压剪切等外界胁迫作用,其活性又会大打折扣[4]。体内定植过程中,受胃液、胆汁等内部胁迫作用影响,活性会进一步损失[5]。因此,如何提高益生菌的抗胁迫能力,保持其活性,从而提高益生菌的益生作用,一直是人们关注的焦点。而微胶囊技术被视为解决这一问题的有效途径[6-7]。
微胶囊化技术在保护生物活性分子、组织和细胞以对抗不利环境方面已取得了较好的成效[8-10]。其中适合益生菌工业化规模生产的微胶囊技术主要有:挤出技术、乳化技术、流化床包覆/空气悬浮技术、真空冷冻干燥技术和喷雾干燥技术等[2]。其中乳化技术由于具有设备简单、操作容易、制备条件较温和,很适合大规模工业生产等优势,也备受益生菌微囊化研究者的关注[2,11]。但该技术也存在乳化过程和制备材料影响益生菌本身生理活性的问题[11]。
益生菌产品种类繁多,如何评价益生菌产品的品质是控制产品质量的关键。其中益生菌产品对储藏、高温、胃酸和胆汁等体内、外胁迫的耐受力是评价的关键指标[12]。目前,关于微囊化益生菌的研究多集中在材料的选择和工艺的优化上,而关于微囊化益生菌产品质量评价的报道还较少。基于此,本文采用乳化凝胶化法原理,对益生菌的代表性菌株——酵母菌和乳酸菌进行了微囊化包被,并以未包被的菌粉为对照,研究了微囊化益生菌对常见体内、外胁迫的耐受情况,以期为推广使用基于乳化法基础上的益生菌微囊化提供帮助。
1 材料与方法
1.1 菌种与培养基
2株试验菌株分别是布拉迪酵母菌(Saccharomyces boulardii)和粪肠球菌(Enterococcus faecium),均为国家粮食局科学研究院保藏菌株,布拉迪酵母菌培养条件是:YPD培养基,30℃耗氧培养,14 h;粪肠球菌培养条件是:MRS培养基,37℃耗氧培养,18 h。
1.2 试验材料
海藻酸钠[化学纯(CP)]、碳酸钙[分析纯(AR)]、冰醋酸(AR)、液体石蜡(CP)、Span80(CP)、无水氯化钙(AR)均为国药集团化学试剂有限公司产品。
1.3 试验仪器
JJ-4A六联电动搅拌器,上海乔跃电子有限公司;CKX41生物倒置显微镜,日本Olympus公司;Mastersizer 2000激光粒度仪,英国马尔文仪器有限公司;DK-8D型电热恒温水槽,上海森信实验仪器有限公司;生物安全柜(KS18)、微生物培养箱(BD),美国Thermo公司。
1.4 益生菌的微囊化
益生菌细胞的微囊化方法参照梁新晓等[13]的方法进行,向海藻酸钠溶液中加入碳酸钙至浓度为10 g/L,混合均匀,灭菌后加入对数生长期的益生菌种子液,充分混匀作为水相。向液体石蜡中添加体积百分含量为0.1%的Span80作为油相。在400~500 r/m in的搅拌速度下,按照水相与油相体积比为1∶3的比例,向油相中缓慢加入水相,搅拌2~5 m in,然后逐滴加入冰醋酸,反应10~15 min,向反应体系中加入氯化钙溶液,使微胶囊缓慢沉降,分离微胶囊,用清水清洗1~2次,后将微胶囊接入发酵液中,培养至对数生长末期,过滤分离微胶囊,45℃干燥3 h,得到益生菌微胶囊产品,微囊化布拉迪酵母菌与微囊化粪肠球菌的活菌数分别为1×109和1×1010CFU/g。对照组菌粉同样45℃干燥3 h,得到布拉迪酵母菌与粪肠球菌菌粉活菌数分别为1×1010和1×1011CFU/g。
1.5 高温胁迫耐受试验
在恒温干燥箱中对益生菌微胶囊产品进行高温耐受性评价,以未包被益生菌菌粉作为对照。分别取1 g益生菌微胶囊和益生菌菌粉在110和130℃下分别处理30、45和60 s。益生菌微胶囊需经破囊后通过梯度稀释平板倾注法进行活菌计数,布拉迪酵母菌和粪肠球菌分别于YPD和MRS培养基培养48 h,统计活菌数,每个处理做3个重复。
1.6 模拟胃肠液胁迫耐受试验
模拟胃液的配制:参考[14],取 9.5%盐酸16.4 m L,加蒸馏水稀释,使 pH 达到 3.0,按照每100 m L 加 1.0 g胃蛋白酶,混匀,0.22 μm 无菌滤膜过滤,现配现用。分别取益生菌微胶囊和2种益生菌菌粉样品各1 g,转移到预热的装有9 m L模拟胃液试管中,37℃ 80 r/min分别处理30、90和180 m in。益生菌微胶囊需加入破囊液中和pH再进行梯度稀释,对益生菌菌粉与益生菌微胶囊进行倾注法活菌计数,每个处理3个重复。
模拟肠液的配制:参考文献[14],取KH2PO46.8 g,加入500 m L蒸馏水溶解,用4 g/L氢氧化钠溶液调 pH至 6.8,蒸馏水定容至 1 L,加胆盐3%,按照100 m L加1 g胰蛋白酶,混匀,0.22μm无菌滤膜过滤,现配现用。分别取益生菌微胶囊和2种益生菌菌粉样品各1 g,转移到装有9 m L模拟肠液试管中,37℃ 80 r/min分别处理30、90和180 m in。益生菌微胶囊需加入破囊液中和pH再进行梯度稀释,对益生菌菌粉与益生菌微胶囊进行倾注法活菌计数,每个处理3个重复。
1.7 数据处理与分析
数据表示形式为平均值±标准差(mean±SD)的形式,其中n=3。数据处理采用Excel和SPSS 17.0统计分析软件进行处理,各组间平均值差异性比较采用的是 one-way ANOVA方法,P<0.05被认为具有显著性差异。
2 结 果
2.1 菌粉与微囊化益生菌耐储存性比较
由表1可见,在常温条件下,菌粉布拉迪酵母菌和粪肠球菌的存活率随着储存时间的延长而降低,储存第5个月存活率分别降低至 6.07%和10.96%。储存第5个月微囊化布拉迪酵母菌和微囊化粪肠球菌的存活率分别为40.71%和30.42%,比菌粉组分别高出 34.63%和 19.46%(P<0.05)。
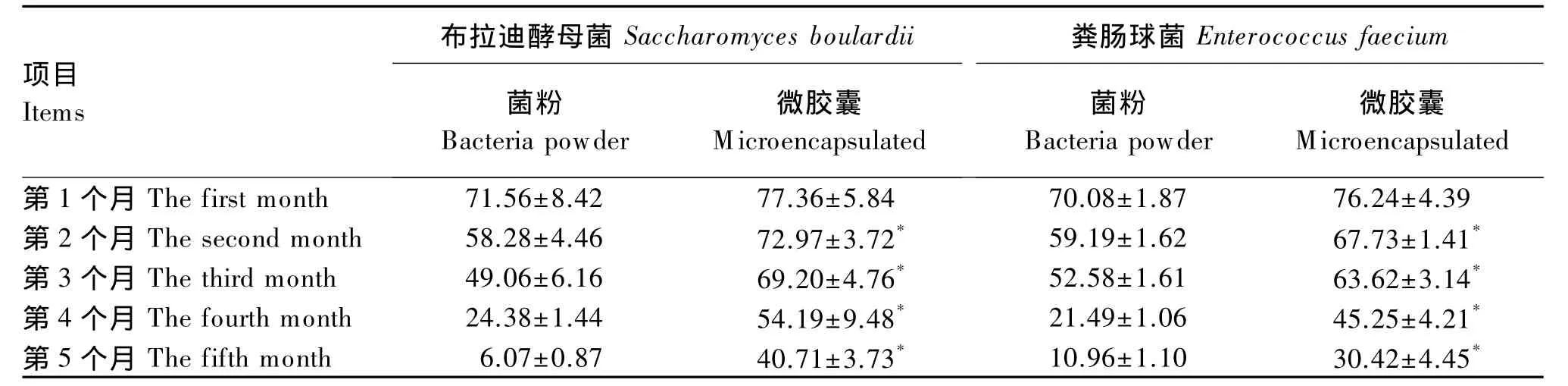
表1 储存对菌粉与微囊化益生菌存活率的影响Table 1 Effects of storage on survival rate of bacteria powder and m icroencapsulated bacteria %
2.2 菌粉与微囊化益生菌耐高温性能比较
由表2可见,布拉迪酵母菌无论是菌粉还是微囊化剂型,在110和130℃的高温下均表现出了较高的耐受性。110℃条件下,微囊化的布拉迪酵母菌耐受性虽然有高于菌粉的趋势,但差异并不显著(P>0.05)。但在更苛刻的130℃高温下,微囊化的优势得到了凸显,在处理45和60 s条件下,微囊化布拉迪酵母菌的存活率仍然分别高达88.21%和84.70%。粪肠球菌的耐高温性明显不如布拉迪酵母菌,尤其在未包被菌粉条件下,其存活率随着温度和处理时间的增加,几乎完全丧失。但在微囊化条件下,粪肠球菌的存活率得到了改善,130℃、60 s条件下,其存活率仍然可达34.04%。
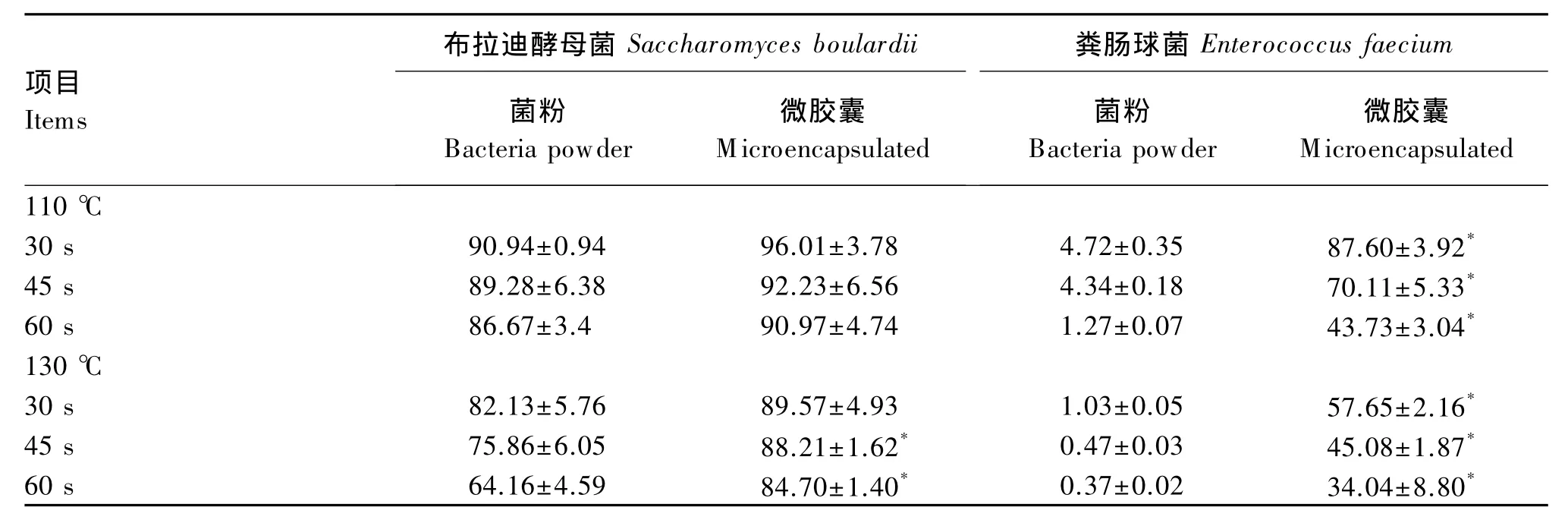
表2 高温对菌粉与微囊化益生菌存活率的影响Table 2 Effects of high temperature on survival rate of bacteria powder and m icroencapsulated bacteria %
2.3 菌粉与微囊化益生菌胃液耐受力比较
由表3可见,2种益生菌,尤其是布拉迪酵母菌菌粉的胃液耐受能力极低,处理30 m in后布拉迪酵母菌、粪肠球菌菌粉存活率分别降低70.39%和61.17%,处理 180 m in后分别降低 81.90%和72.00%。微囊化后2株菌的胃液耐受力均显著提高(P<0.05),处理30m in后存活率分别只降低了11.21%和 9.37%,处理 180m in 后分别只降低24.14%和 25.27%。
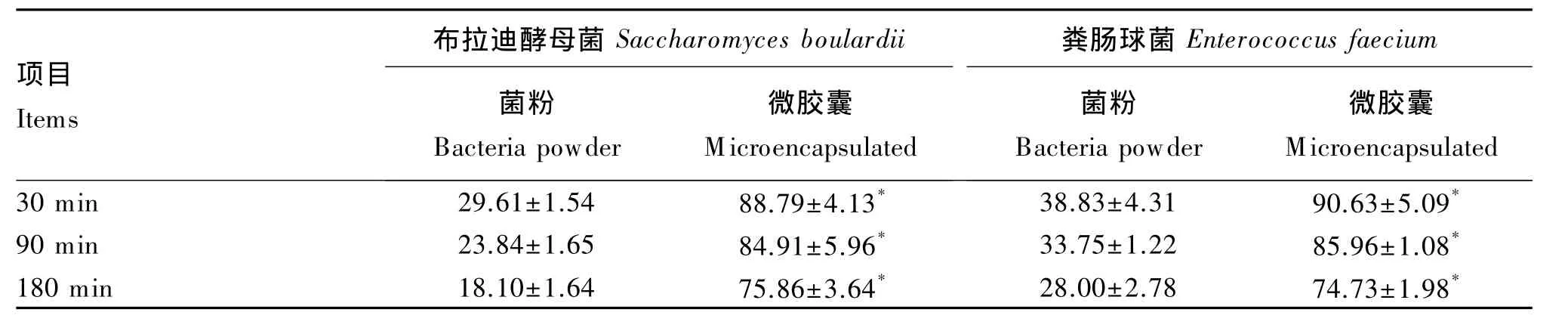
表3 模拟胃液对菌粉与微囊化益生菌存活率的影响Table 3 Effects of simulated gastric fluid on survival rate of bacteria powder and m icroencapsulated bacteria %
2.4 菌粉与微囊化益生菌肠液耐受力比较
由表4可见,随着处理时间的延长,布拉迪酵母菌和粪肠球菌的存活率均受到一定程度的抑制,且无包被菌粉的存活率下降幅度大于微囊化益生菌(P<0.05)。处理时间达到180 m in时,布拉迪酵母和粪肠球菌菌粉的存活率分别降低了59.20%和52.24%,而其微囊化制剂的存活率则分别只降低了 32.31%和31.08%。
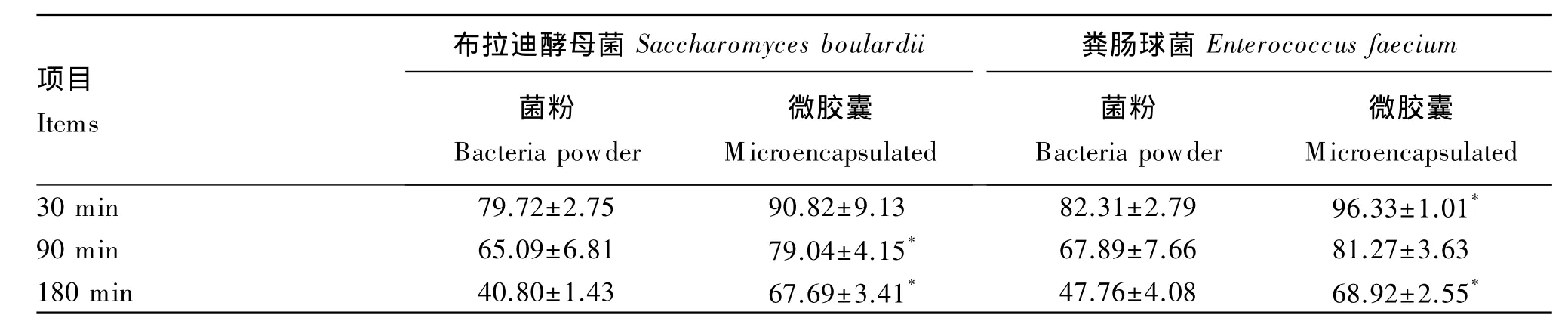
表4 模拟肠液对菌粉与微囊化益生菌存活率的影响Table 4 Effects of simulated intestinal fluid on survival rate of bacteria powder and m icroencapsulated bacteria %
2.5 微囊化益生菌的模拟体内释放情况
由图5所示,时间低于50 m in时,微囊化益生菌的释放呈现出较快的速度,时间高于50 m in时,释放速度趋于平缓,50 m in时微囊化布拉迪酵母菌和微囊化粪肠球菌的释放率分别可达71.74%和87.47%,溶液中的微胶囊已经基本崩解完全。
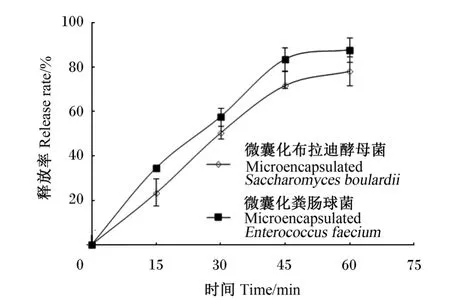
图5 微囊化益生菌的模拟消化道内释放曲线Fig.5 Release ofm icroencapsulated bacteria in simulated gastrointestinal conditions
3 讨论
3.1 菌粉与微囊化益生菌耐储存性比较
相对于低温储存来说,常温储存成本低,设备简单,更适合于大量益生菌产品和养殖用户的存放,同时也大大降低了益生菌的运输成本。然而常温储存的问题是益生菌活菌数下降明显。本文结果表明,在常温储藏条件下,无论是酵母菌还是乳酸菌,其存活率降低都极为明显,可达90%以上,严重影响了益生菌的使用效果。而微囊化后的益生菌存活率随储存时间的降低趋势,相对于游离未包被菌粉明显放缓。从第2个月开始,微囊化组存活率即显著高于菌粉组。因此,微囊化后的益生菌表现出明显的耐储藏性能。
3.2 菌粉与微囊化益生菌耐高温性能比较
益生菌经常会被加工成片剂或颗粒,以便于使用。制粒过程通常要经历70~90℃,甚至更高的温度环境[15]。而益生菌尤其是乳酸菌的高温耐受性非常低,有研究结果表明,乳酸菌在制粒后所存无几,死亡率达95%以上。即使是耐热性最好的芽孢杆菌,经制粒后存活率最高也只有80%左右[12]。因此,饲用益生菌的耐热性是其性能的重要的评价指标。本文结果表明,微囊化后的益生菌具备了较强的耐受短时高温的性能,尤其是乳酸菌的高温耐受能力得到明显的提高,这与李旭华等[16]的结果是一致的。
3.3 菌粉与微囊化益生菌胃液耐受力比较
人体及动物胃部的pH偏低,对益生菌具有潜在的灭活作用,致使其难以有足够的活菌数量到达肠道或定植肠道而发挥作用。耐酸性可以用简单的体外试验来评价[12],目前对于菌株耐酸性试验国内外尚无统一的标准,考虑消化酶对益生菌的影响,有学者使用添加胃蛋白酶制备的模拟胃液进行耐酸性评价[17]。本研究采用上述方法,对微囊化的酵母菌和乳酸菌进行了胃液耐受评价,结果显示经乳化凝胶化法包被后益生菌对胃环境的耐受力得到了明显的提高。对于双歧杆菌相关的研究也给出了类似的结果[18]。同时结果也表明,作为乳酸菌的粪肠球菌胃液耐受力要显著高于布拉迪酵母菌,推测与乳酸菌具有一定的产酸能力,因此具有较强的低pH耐受力有关。
3.4 菌粉与微囊化益生菌肠液耐受力比较
肠道的pH温和,接近中性,但胆盐以及其他多种酶类,对益生菌都有潜在的灭活作用,肠道部位的渗透压对微生物的生长也有很大影响[12]。因此益生菌对胆盐的抗性是其能够在肠道内存活、生长并发挥功效的先决条件之一。肠道中胆汁的含量在0.03%~0.30%之间波动,故本研究采用0.30%胆盐含量的模拟肠液进行了益生菌肠液耐受性试验[19]。本研究结果表明微囊化后的益生菌,其肠液耐受能力提高,益生菌可在小肠部位充分地发挥益生作用,并顺利到达大肠,从而进一步发挥作用。模拟肠液条件下益生菌相对于模拟胃液条件下的高存活率,可能与肠液环境下近乎中性的pH有关。
3.5 微囊化益生菌的模拟体内释放情况
微囊化益生菌在体内的释放也是决定其品质的重要因素。微生物细胞固定化在微胶囊中不能释放,其益生作用会受到影响。释放时间过快,又起不到有效的保护作用。本研究显示,微囊化的益生菌呈现出缓慢释放的特点,区别于菌粉的瞬间释放,这对于益生菌有效抵抗体内胃肠环境的胁迫影响,有效发挥作用具有明显的优势。此外,粪肠球菌和布拉迪酵母菌的释放过程未出现显著性差异数据,且表现出近乎相同的趋势,推测与两者的微囊化工艺和材料一致,从而导致制备的微胶囊物化特性一致有关。
4 结论
基于乳化凝胶化原理上的微胶囊技术可显著增强布拉迪酵母菌和粪肠球菌对储藏、高温、胃液和肠液等体内、外不良环境的抗性。同时,表现出了体内缓慢释放的特点。微囊化布拉迪酵母菌和粪肠球菌对机体的实际应用效果和益生作用机理尚需要进一步研究。
[1] 张灼阳,刘畅,郭晓奎.益生菌的安全性[J].微生物学报,2008,48(2):257-261.
[2] 李漫,袁杰利,刘党生.工业生产益生菌微囊化技术的研究进展[J].中国微生态学杂志,2014,26(3):354-357.
[3] GOMES A M P,MALCATA F X.Bifidobacterium spp.and Lactobacillus acidophilus:biological,biochem ical,technological and therapeutical properties relevant for use as probiotics[J].Trends in Food Science & Technology,1999,10(4/5):139-157.
[4] GARDINER G E,O'SULLIVAN E,KELLY J,et al.Comparative survival rates of human-derived probiotic Lactobacillus paracasei and L.salivarius strains during heat treatment and spray drying[J].Applied and Environmental M icrobiology,2000,66(6):2605-2612.
[5] 黄序,戚薇,王建玲,等.肠溶性双歧杆菌微胶囊的初步研究[J].药物生物技术,2002,9(2):105-109.
[6] 曹永梅,许时婴,张灏.肠溶性双歧杆菌微胶囊的制备[J].食品与发酵工业,2000,25(2):71-77.
[7] 徐致远,郭本恒,陈卫.乳酸菌微胶囊技术的研究进展[J].乳业科学与技术,2005(5):198-201.
[8] HOESLIC A,RAGHURAM K,KING R L J,et al.Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation[J].Biotechnology and Bioengineering,2011,108(2):424-434.
[9] ALEXAKIS T,BOADID K,QUONG D,et al.M icro-encapsulation of DNA w ithin alginate m icrospheres and crosslinked chitosan membranes for in vivo application[J].Applied Biochem istry and Biotechnology,1995,50(1):93-106.
[10] GUAN H N,CHI D F,YU J,et al.Encapsulated ecdysone by internal gelation of alginatem icrospheres for controlling its release and photostability[J].Chemical Engineering Journal,2011,168(1):94-101.
[11] YÁÑEZ-FERNÁNDEZ J,RAMOS-RAMÍREZ E G,SALAZAR-MONTOYA J A.Rheological characterization of dispersions and emulsions used in the preparation of m icrocapsules obtained by interfacial polymerization containing Lactobacillus sp.[J].European Food Research and Technology,2008,226(5):957-966.
[12] 张璐,张敏红.饲用益生菌产品评价研究进展[J].中国畜牧兽医,2008,35(3):21-24.
[13] 梁新晓,贠婷婷,田科雄,等.内源乳化凝胶化法制备海藻酸钙微胶珠的工艺优化[J].食品科学,2014,35(12):35-40.
[14] 中华人民共和国卫生部药典委员会.中华人民共和国药典[M].广州:广东科技出版社,1995:附录64.
[15] 黄序.微胶囊技术及片剂包衣技术在双歧杆菌保护中的应用[D].硕士学位论文天津:天津轻工业学院,2002:13.
[16] 李旭华,曾仕霞,苏泽躬,等.鼠李糖乳杆菌LT22微胶囊的制备及其稳定性和毒性研究[J].安徽农业科学,2010,38(11):5851-5853,5881.
[17] TSAIC C,HSIH H Y,CHIU H H,et al.Antagonistic activity against Salmonella infection in vitro and in vivo for two Lactobacillus strains from sw ine and poultry[J].International Journal of Food M icrobiology,2005,102(2):185-194.
[18] 杨汝德,肖仔君,陈惠音.采用微型包囊技术研制活性双歧联菌微囊微生态制剂[J].广州食品工业科技,2003,19(S1):38-40,35.
[19] 王玉华,张桂荣,刘景圣.2株耐酸及耐胆盐嗜酸乳杆菌的分离筛选及其发酵特性研究[J].东北师大学报:自然科学版,2006,38(3):115-118.

