莱州湾近岸海域中典型抗生素与抗性细菌分布特征及其内在相关性
何春明,那广水,陆紫皓,高会,#,葛林科,张琳晓,李瑞婧,李军,姚瑶
1. 上海海洋大学海洋科学学院,上海 201306 2. 国家海洋环境监测中心 国家海洋局近岸海域生态环境重点实验室,大连 116023 3. 大连工业大学生物工程学院,大连 116034
莱州湾近岸海域中典型抗生素与抗性细菌分布特征及其内在相关性
何春明1,2,那广水2,*,陆紫皓2,高会2,#,葛林科2,张琳晓3,李瑞婧2,李军1,2,姚瑶1,2
1. 上海海洋大学海洋科学学院,上海 201306 2. 国家海洋环境监测中心 国家海洋局近岸海域生态环境重点实验室,大连 116023 3. 大连工业大学生物工程学院,大连 116034
为了揭示海陆衔接区环境中抗生素与抗性细菌分布特征及其内在相关性,以莱州湾及其主要入海河流为研究区域,利用HPLC-MS/MS分析样品中15种磺胺类抗生素(SAs)和6种喹诺酮类抗生素(QNs)的浓度,并通过改良的Method 1604(US EPA)评估海水与沉积物中2种典型水传病原微生物大肠杆菌(E. coli)与金黄色葡萄球菌(S. aureus)的抗生素抗性水平,进而探讨该区域水体中抗性菌株的分布特点以及微生物抗性率与相应抗生素浓度的相关性。结果显示,莱州湾水体与沉积物中普遍存在磺胺与喹诺酮类抗生素残留及抗性污染问题。两大类抗生素在水体中平均残留浓度分别为3.89 ng·L-1(SAs)和234.68 ng·L-1(QNs),在沉积物中分别为0.91 ng·g-1(SAs)和49.37 ng·g-1(QNs),且分布特征基本呈现自河流向海洋逐渐递减的趋势,说明河流输入是莱州湾抗生素污染的主要来源。在水体中,具有磺胺类抗性的E. coli和S. aureus平均检出量分别达到2 018和4 683 CFU·L-1,抗性率范围分别在0%~ 37.3%和10.6% ~ 45.8%之间;而2种喹诺酮类抗性病原微生物的平均检出量则相对较低,分别为1 315 CFU·L-1(E. coli)和1 461 CFU·L-1(S. aureus),抗性率分别为0% ~ 50.0%和0% ~ 20.8%;此外,相比于E. coli,S. aureus为沉积物中的主要抗性病原微生物,磺胺与喹诺酮类抗性S. aureus检出率均高于80%,平均检出量分别为24 CFU·g-1和18 CFU·g-1。相关性分析表明,莱州湾近岸海域水体中磺胺类抗生素浓度与磺胺类抗性微生物总量之间具有良好的线性关系,然而其与微生物抗性率之间并未表现出相似的规律,说明近岸海洋环境中抗生素的残留量不是影响抗性菌株丰度的唯一因素。
磺胺;喹诺酮;抗生素抗性菌株;莱州湾;相关性
长期以来,由于抗生素在治疗感染性疾病与集约化养殖业中长期、大量、不合理的使用,造成了一系列严重的公共健康与环境问题。世界卫生组织在全球首份抗生素耐药性监测报告中称抗生素危机将比20世纪80年代的艾滋病疫情更加严重,抗生素耐药性正严重威胁着全球公共健康,若不采取紧急协调措施,全球将走向“后抗生素”时代[1]。目前全球范围内不同介质中抗生素药物及其抗性微生物被不断检出。中国作为第一大抗生素生产与消费国,其年消耗量达180 000 t[2],抗生素误用与滥用现象更为严重,因此迫切需要开展有关抗生素及其抗性污染的系统研究。
近10年来,国内外针对不同环境区域中的抗生素抗性污染状况开展了大量研究。欧洲、美国、日本、中国等国家和地区先后在污水处理厂进出水[3]、医疗废水[4]、地下水[5]以及河流[6]中检测到多类抗生素抗性微生物(antibiotic-resistant bacteria, ARB)与生物体内的抗性基因(antibiotic reisistance genes, ARGs),证实了城市污水、制药与医疗废水中已经普遍受到抗生素抗性污染,同时人类活动与抗生素的使用直接影响了抗生素抗性的产生及抗性基因的丰度,但是有关近岸海洋环境中典型水传病原微生物的抗生素抗性水平、分布规律及其由河流迁移到海洋环境中的动态变化特征却鲜有报道。河口海岸带是介于河流和海洋之间的生态交错区,也是陆海相互作用最强烈的区域,与内陆环境相比,其地理位置与物理化学性质较为特殊,抗生素残留量也明显低于河流、城市污水等。在低浓度抗生素相对较弱的选择压力与复杂的陆海交互作用双因素影响下,抗生素抗性微生物的分布与迁移规律是否与高抗生素残留量的内陆环境中的情形相一致尚不清楚。
因此,为了深入探讨河口海岸带在低浓度抗生素残留条件下,水体与沉积物中典型病原微生物的抗生素抗性水平、变化特征及其分布与迁移规律,本研究选取了莱州湾及其主要河流为代表区域,并以常用的磺胺类和喹诺酮类抗生素及水传病原微生物大肠杆菌(E. coli)与金黄色葡萄球菌(S. aureus)为研究对象,应用HPLC-MS/MS法对水样中抗生素浓度含量进行测定[7],并采用以往研究[8-9]基础上改良的Method 1604(EPA)[10]方法评估莱州湾近岸海洋环境中E. coli与S. aureus的抗生素抗性水平,探讨抗生素抗性病原微生物在河口海岸带的动态变化特征及其与相应抗生素残留水平间的内在相关性,以期为尽早采取针对性措施解决日趋严重的环境抗生素抗性污染问题提供理论基础与数据支持。
1 材料与方法 (Materials and methods)
1.1 样品采集
2014年12月对莱州湾近岸海域(SF01~SF06)及小清河、堤河、虞河及弥河等4条主要入海河流入海口(HK01~HK04)进行调查,共设置10个站位点采集水样与沉积物样品。
1.2 实验仪器与试剂
实验仪器:高效液相色谱串联质谱(HPLC-MS/MS,Thermo Fisher Scientific,USA),Symmetry© C18柱(2.1 mm × 150 mm,3.5 μm,Waters公司,USA),涡旋混匀器(QL-901,海门市其林贝尔仪器厂),固相萃取装置(VISIPREP 24TMDL,SUPELCO公司),隔水式恒温培养箱(GHP-9080,上海一恒),立式自动压力蒸汽灭菌器(GI54DWS,致微(厦门)仪器有限公司),超净工作台等,氮气均为高纯氮。
实验试剂:甲醇(色谱纯)、甲酸(99%)分别购自德国Merck KgaA公司和美国Tedia Scientific公司,其余药品或试剂均为分析纯。MI培养基购自美国BD公司,MH(B)培养基购自北京Solarbio公司,磺吡苄头孢菌素、亚碲酸钾,氯化钠均购自中国阿拉丁公司,孔径0.45 μm的网格滤膜购自美国BD公司。磺胺醋酰(SAAM)、磺胺吡啶(SP)、磺胺嘧啶(SDZ)、磺胺噻唑(STZ)、磺胺甲基嘧啶(SMR)、磺胺二甲嘧啶(SMZ)、磺胺对甲氧嘧啶(SM)、磺胺甲噻唑(SMTZ)、磺胺间甲氧嘧啶(SMM)、磺胺氯哒嗪(SCP)、磺胺甲基异恶唑(SMX)、磺胺甲氧哒嗪(SMP)、磺胺间二甲氧嘧啶(SDM)、磺胺二甲异恶唑(SIX)、磺胺邻二甲氧嘧啶(SDX)、诺氟沙星(NOR)、环丙沙星(CPFX)、洛美沙星(LOME)、恩诺沙星(ENRO)、氧氟沙星(OFL)、沙拉沙星(SARA)均购自Dr. Ehrenstorfer GmbH公司,回收率指示剂磺胺嘧啶-13C6(sulfadiazine-13C6)购自J&K公司(纯度>99.5%)。所有标准物质均溶解在甲醇中,并于暗处4 ℃保存。
1.3 实验方法
1.3.1 抗生素检测
采用Na等[11]开发的多类抗生素联合分析方法对磺胺类和喹诺酮类抗生素进行分析。
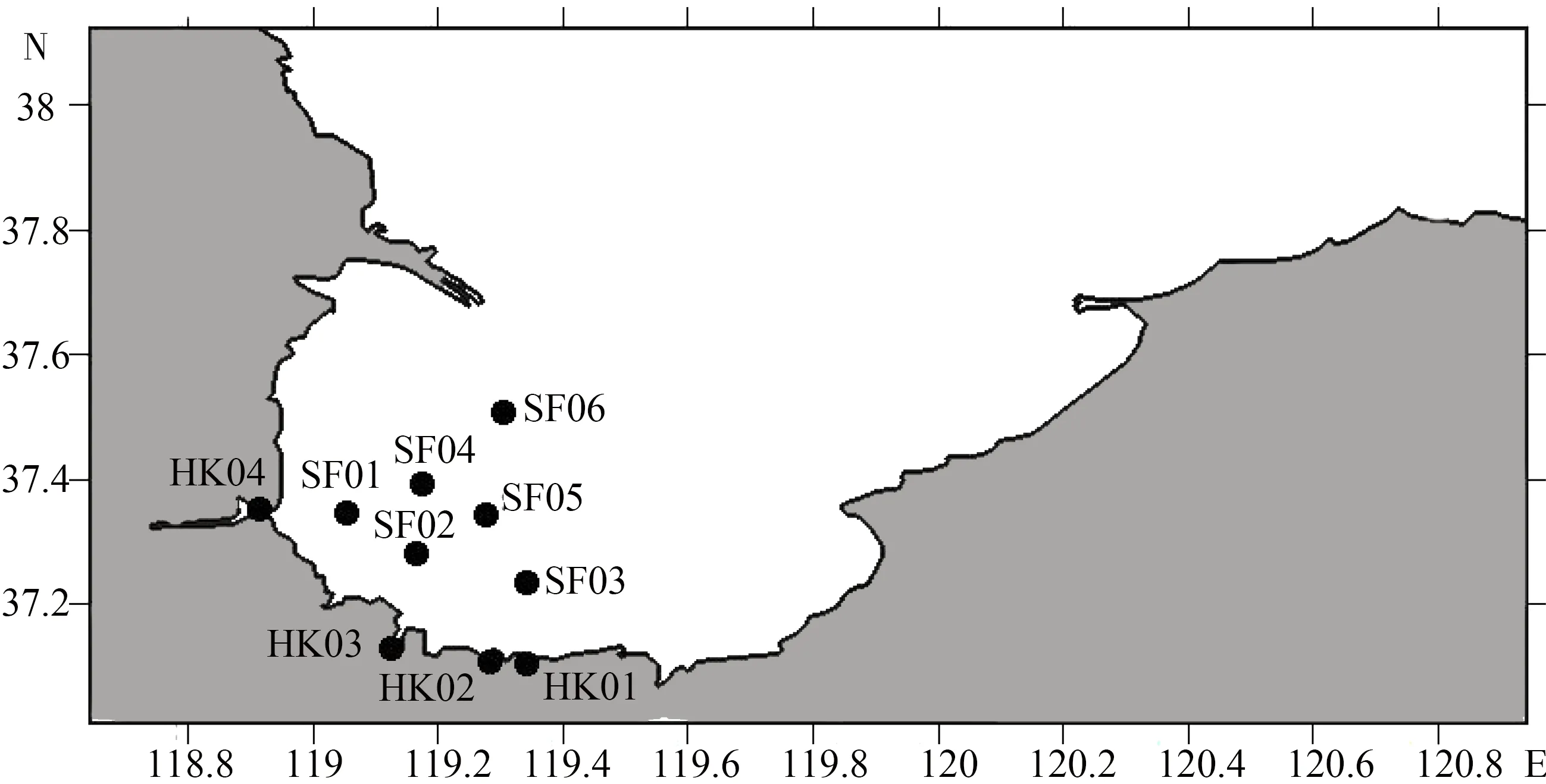
图1 莱州湾采样站位分布图
1.3.2 抗性微生物检测
分别以典型水传病原性微生物E. coli与S. aureus为革兰氏阴性菌与革兰氏阳性菌代表,通过改进传统滤膜法结合MI培养基与VJ培养基进行筛选,并通过侵入不同种类抗生素制成抗性筛选MI-R与VJ-R培养基,依据无抗生素平板上的菌落数作为水体中可培养微生物的总数计算抗性微生物占微生物总量的百分比来评价抗性水平[12]。
1.4 质量保证和质量控制(QA/QC)
既然是天意,就不能违抗。他想,也许这对她来说是一件好事,是一件以后想起来不必矛盾和纠结的好事。还是原配好。她曾经说过。每次在一起面对他的为难甚至是显得虚妄的希望时,她总是这样泼冷水。显然,他们不再是狂躁的孩子。她不会因此离开家庭,虽然因为寂寞她接受了他的追求,并且全身心地享受着这份另类的激情。而他显出的虚妄多是在她矛盾愧疚的时候出现。我是好女人吗?会遭到唾弃吗?等高涨的潮水退去的时候,突兀的岩层理性地裸露出来。于是,在她无序的自责中,他会挺身而出,骑士般地说,不要等下辈子了,让我这辈子就娶你吧。我什么都可以舍得。
替代标准用于补偿被分析物质在前处理过程中的损失,水体、沉积物样品中抗生素的平均回收率分别为72.8%和67.5%,水体相对标准偏差(n=3)低于15%,沉积物相对标准偏差(n=3)低于13%。分析样品过程中,同时分析QA/QC样品,包括方法空白、空白加标和空白加标平行样。抗性菌株的筛选利用没有抗性的对照菌株作为阴性对照,每组实验设置3个平行,使用单方差显著性差异(P<0.05)。微生物实验操作需在超净无菌工作台中完成,确保无外界环境杂菌污染。数据分析用SPSS19.0统计软件进行,采用线性回归进行相关性分析,P<0.05表示显著相关。
2 结果与讨论(Results and discussion)
2.1 莱州湾近岸海域中磺胺类抗生素分布特征
莱州湾近岸海域中磺胺类抗生素(SAs)浓度总含量分析结果显示,15种SAs在河水样品中检出率多在80%以上,普遍高于海水样品,SMX和SMP是主要的磺胺类污染物质。河水和海水中SAs浓度范围分别在ND~9.15 ng·L-1和ND~0.42 ng·L-1,说明莱州湾区域水体中存在一定量的磺胺类药物残留,且河流入海口处SAs浓度高于海洋水体中抗生素浓度(如图2),与Na等[12]和秦延文等[13]研究北黄海近岸水体和大辽河表层水体中SAs检测量分别为ND~584 ng·L-1和ND~91 ng·L-1相比含量偏低。这可能与该区域内SAs的使用量较小或者研究河段水量较大、自净能力较强以及抗生素降解率高等作用有关[13]。
所有沉积物样品中,SP均有检出,除SDX (91%)和SAAM (82%)外,其余检出率均低于50%。15种SAs总浓度最高值出现在HK04,为4.88 ng·g-1·,且该采样点SMX浓度也最高,为1.91 ng·g-1,这也反应了SMX在莱州湾区域的使用较为广泛。沉积物样品中检出率与平均浓度普遍低于水样,可能是由于磺胺类药物亲水性强,稳定性较高,很容易通过排泄和雨水冲刷等方式进入到水环境中[14]。沉积物中SAs浓度较低进一步表明该类抗生素在莱州湾海域使用较少。
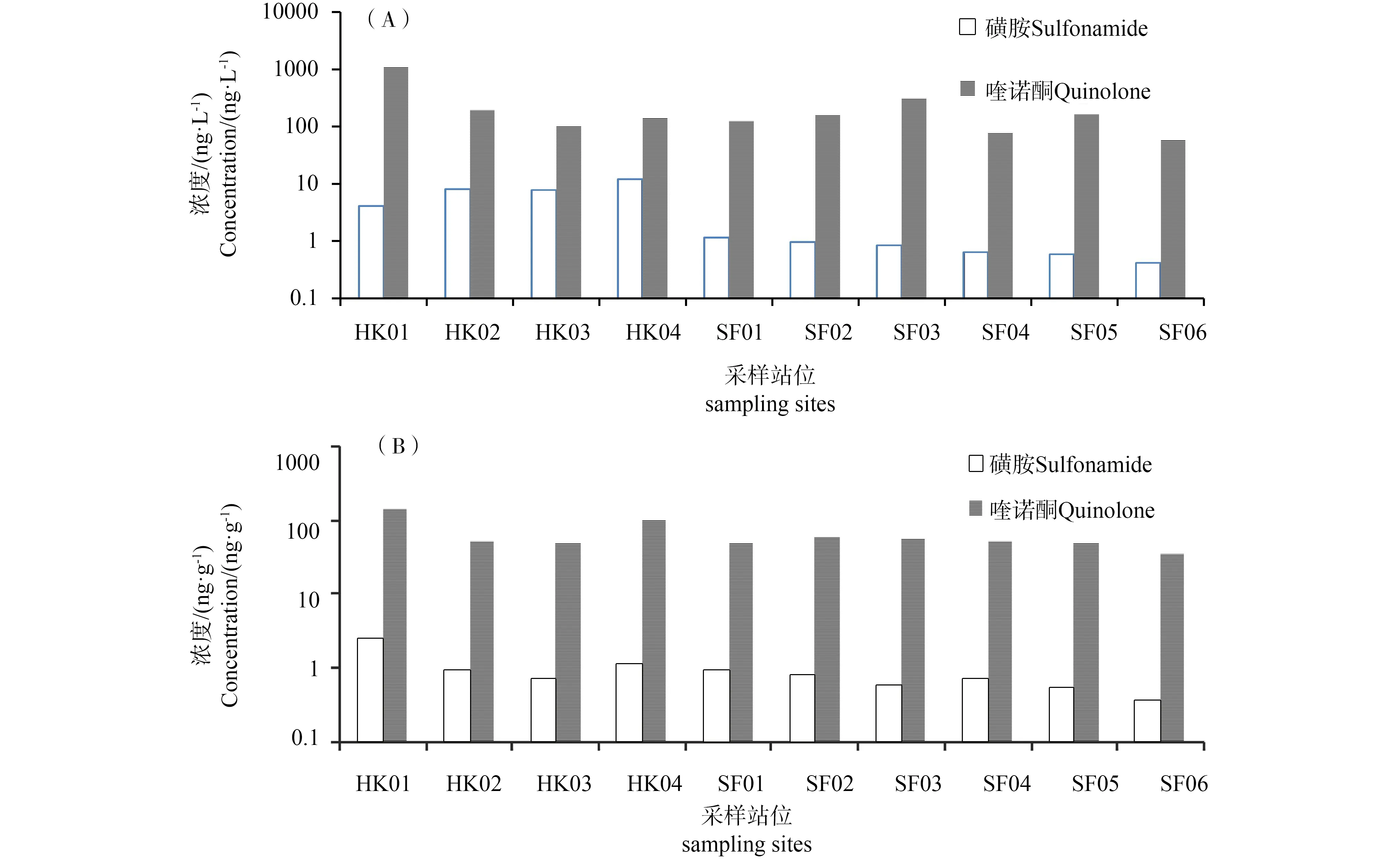
图2 莱州湾中水样(A)和沉积物(B)中磺胺类和喹诺酮类抗生素含量分布状况
由图2进一步分析发现,水和沉积物中SAs浓度分布均呈现:河口区 >近海区(SF01、SF02、SF03)>较远海区(SF04、SF05、SF06),且同一纵断面均呈现浓度递减趋势(HK04>SF01>SF04>SF06,HK01>SF03>SF05>SF06),SF06浓度值均最低,可能是由于随着离岸距离的增加,抗生素浓度被海水稀释,造成含量较低。
2.2 莱州湾近岸海域中喹诺酮类抗生素分布特征
6种喹诺酮类抗生素(QNs)在水样中除了LOME(53%)其余检出率均在80%以上,NOR、SARA和CPFX的平均浓度分别为86 ng·L-1、71 ng·L-1和20 ng·L-1,最高浓度分别为172 ng·L-1、108 ng·L-1和37 ng·L-1,均高于ENRO、OFL和LOME(如图3)。与Zhang等[15]2009年莱州湾的研究结果相比,QNs检出率及污染趋势基本一致,河流入海口中QNs浓度高于海洋中浓度。此外,相较于其他河流环境,莱州湾喹诺酮类抗生素的平均浓度高于海河及其支流[16],低于白洋淀河流[17]进水浓度,与大辽河表层水体中QNs的浓度处于同一水平。
如图3所示,QNs沉积物样品检出率和平均浓度趋势与水样中基本保持一致,但ENRO在沉积物中及大多数水样中含量偏低,但在HK01、SF03、SF05这3个站位水样中浓度却远高于其他化合物,尤其HK01残留量最高,这是由于HK01处于入海排污口及养殖区,污染较大,这也导致同一纵断面的站位浓度也普遍高于其他化合物,表明河流输入是莱州湾区域抗性污染的主要来源。进一步分析还发现,河口区浓度与海洋区浓度存在差异,只是未出现明显的递减趋势,但同一纵断面均呈现类似的浓度递减趋势,且靠近HK01、HK02附近同一纵断面采样点的污染较重,可能是由于该区域位于莱州湾南部,不仅有堤河、虞河、弥河等多条河流入海,而且在沿岸流的作用下也会受到西南部小清河入海的影响,即会受到沿岸农业非点源和水产养殖污染物排放的影响。
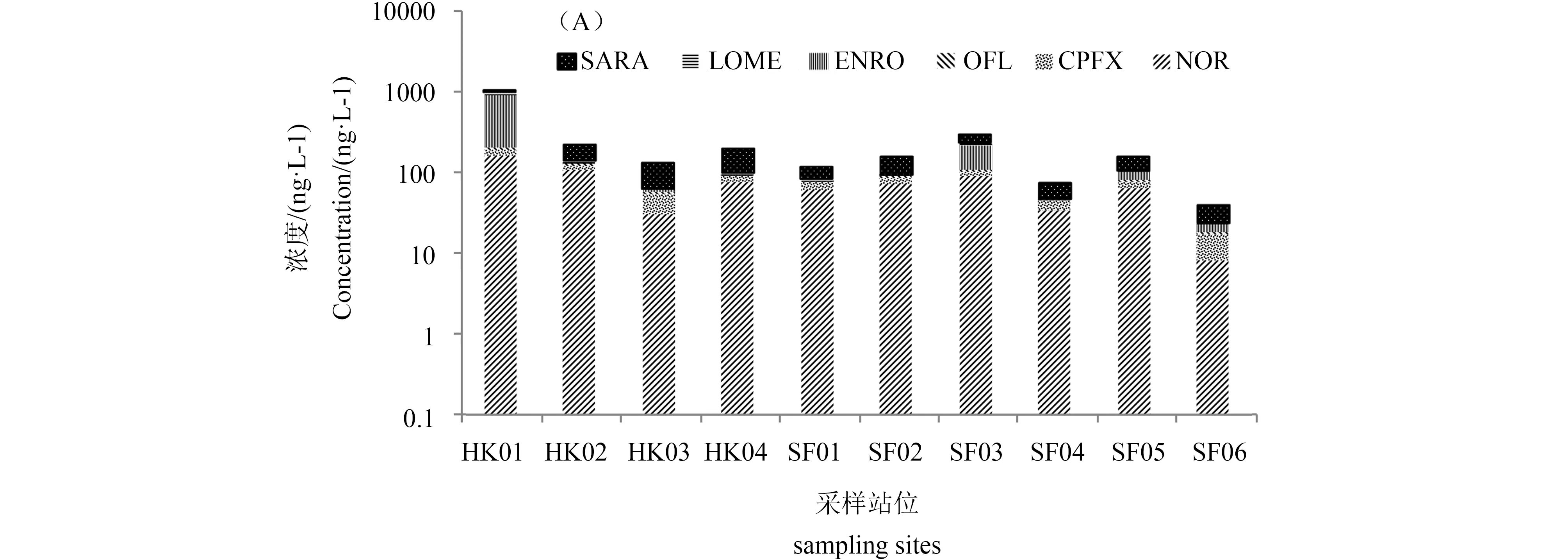
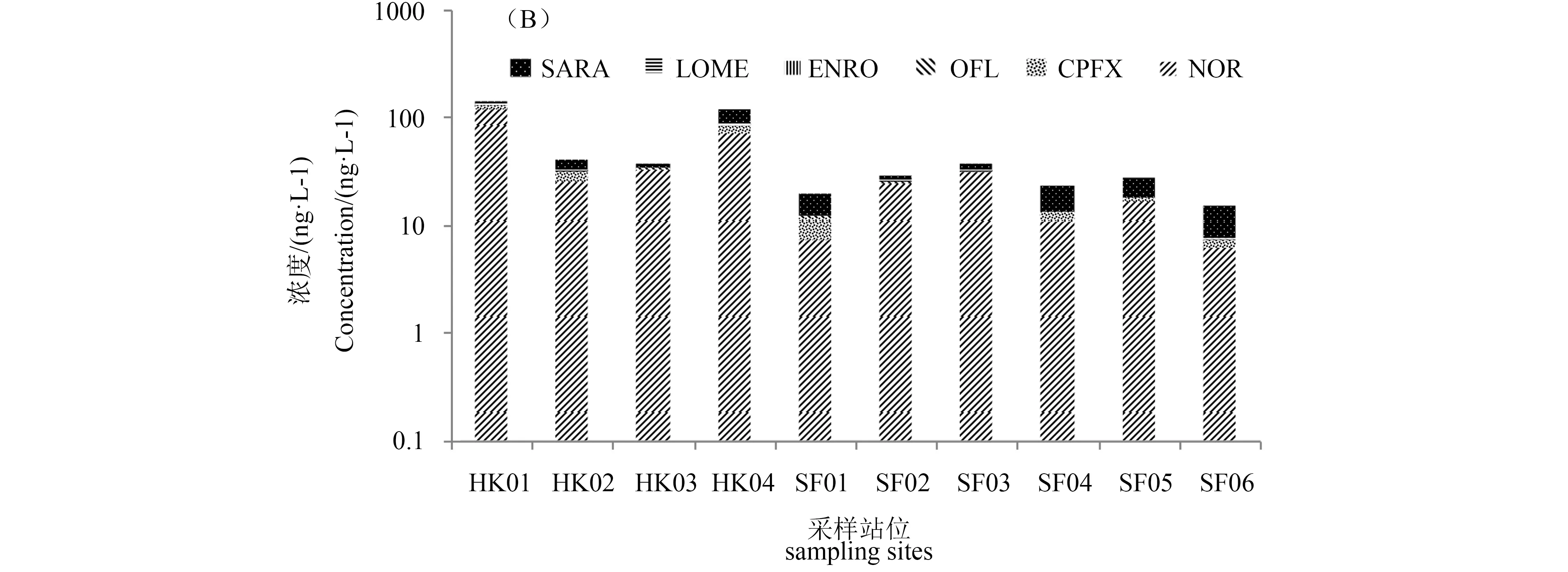
图3 莱州湾水样(A)和沉积物(B)中不同喹诺酮类抗生素的浓度分布
莱州湾区域QNs含量差异,可能与周边抗生素使用量或环境行为有关,如NOR和CPFX医疗用量排名居前[18],且作为兽药在畜牧养殖中被广泛使用,因此在环境中分布广泛[15]。而ENRO与OFL作为新型抗菌药应用范围相对较窄,使用量有限,因此其在环境中检出率与检出量较低。同时,抗生素残留时间及污染源离采样点距离的差异可引起抗生素不同程度上的衰减,导致局部残留出现差异性。
2.3 莱州湾近岸海域中抗性微生物分布特征
2.3.1 水体中抗性细菌分布特征
莱州湾近岸海域表层水体中大肠杆菌与金黄色葡萄球菌含量如图4所示,发现各站位点检出率及菌体丰度存在一定的差异。河口水体中E. coli与S. aureus平均菌体丰度分别为14 950 CFU·L-1与47 725 CFU·L-1;海洋水体中E. coli与S. aureus平均菌体丰度分别为367 CFU·L-1与10 290 CFU·L-1。2种水传病原微生物的空间分布具有明显的区域特征,即近海区<河口区,随着盐度的增加水体中的E. coli与S. aureus丰度均表现出不同程度的衰减,如图4所示。抗性评估实验表明,河口海岸带环境中典型水传病原微生物普遍存在抗生素抗性污染问题(表1)。河口区E. coli磺胺抗性率在0%~37.3%之间,平均抗性率为15.62%,其中虞河入海口(HK02)最高。S. aureus磺胺抗性率在10.6%~45.8%之间,平均抗性率为19.2%,其中弥河入海口(HK03)最高。E. coli和S. aureus喹诺酮抗性率分别在9.1%~50%和3.4%~20.8%范围内,平均抗性率为19.28%和8.42%,弥河入海口仍处于较高水平。与施嘉琛等[19]报道的北京温榆河流域内大肠杆菌抗生素抗性率(10%~35%)结果相似,而略低于Watkinson等[20]调查美国Brisbane River中E. coli磺胺类平均抗性率(37% ± 5%),表明不同的水质环境所导致的抗生素对抗性细菌的效应也不同,抗性率的高低可能与河口海岸带环境的复杂性以及周围环境抗生素的使用水平密切相关。海洋区磺胺平均抗性率分别为13.57%和27.77%,E. coli和S. aureus的喹诺酮抗性菌株普遍无检出。由此可见,与相邻海洋区抗生素抗性污染状况相比,河口区域病原性微生物的抗生素抗性污染情况更加严重。
2.3.2 沉积物中抗性细菌分布特征
沉积物中各站位点抗性细菌的检出率及菌体丰度值均低于水体样品,河口沉积物中,E. coli与S. aureus平均菌体丰度分别为3 390 CFU·g-1与1 010 CFU·g-1;海洋沉积物中E. coli与S. aureus平均菌体丰度分别为70 CFU·g-1与600 CFU·g-1。分布特征如图4所示,呈现近海区<河口区趋势,与水样保持一致。抗性评估实验表明(表1),河口区E. coli磺胺抗性率和S. aureus磺胺抗性率分别在0%~29.8%和20.8%~43.2%范围内,平均抗性率为7.2%和31.2%;E. coli喹诺酮抗性率和S. aureus喹诺酮抗性率分别在0%~40.3%和17.2%~31.3%范围内,平均抗性率为9.26%和18.54%。与张婉茹等[12]研究北黄海近岸海域沉积物中E. coli抗性率0%~33%范围内,其平均抗性率为15%,处于同一水平。海洋区E. coli的抗性菌株普遍均无检出,而S. aureus抗性检出率较高,喹诺酮和磺胺的平均抗性率分别为18.48%和21.6%。海水中普遍存在磺胺类抗性E. coli,而在沉积物中无检出,这可能是由于SAs浓度较低且吸附能力弱,由于海水中盐度、温度的变化,抗性微生物生物适应性降低,从而导致抗性率偏低。
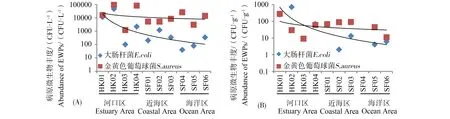
图4 莱州湾水样(A)和沉积物(B)中两种水传病原微生物丰度
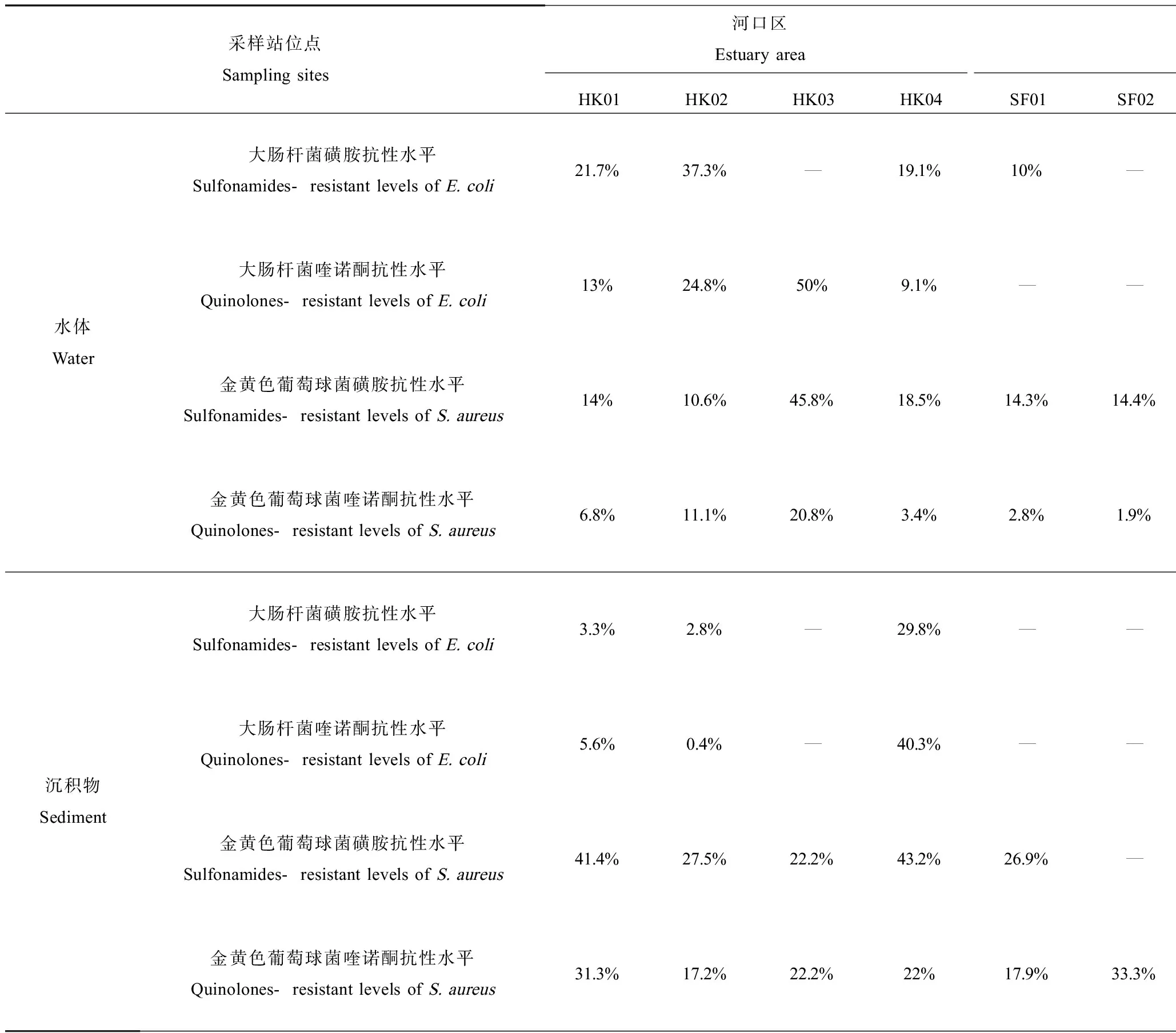
表1 莱州湾抗性微生物抗性水平在水和沉积物中的分布情况Table 1 Distribution of the resistant level of antibiotic resistance bacteria in water and sediment of Laizhou Bay
2.4 抗生素浓度与抗生素抗性细菌分布的关系
抗生素不但会对环境微生物生物量、群落结构及其相关生态功能产生影响,而且能加速抗生素抗性基因在细菌之间的传播与扩散,不断导致抗性耐药菌产生。研究发现,海洋站位点(SF04、SF05、SF06)位于离岸边较远海域,人类活动较少,结果显示15种SAs浓度较低,但仍可以筛选出磺胺类抗性E. coli且抗性率较高,抗性污染普遍存在,可能是由于抗生素的低浓度诱导耐药菌的产生,同时也存在抗性基因传播的可能性,其具体机制有待进一步研究。
为了研究不同类型的抗生素残留对抗性微生物丰度的影响,采用线性回归分析发现,水体中SAs浓度与磺胺类抗性微生物总量之间具有良好的线性关系,如图5所示,与Gao等[21]研究发现的磺胺甲恶唑抗性细菌和总体所测磺胺类药物线性相关,结果一致。然而,水和沉积物中QNs浓度与喹诺酮抗性微生物量之间均无良好线性关系,与欧丹云等[22]对九龙江下游河口水域调查发现的抗性细菌的丰度与抗生素浓度不具有良好线性关系结果相似。为了进一步探讨河口海岸带环境中抗生素残留量对典型病原微生物抗生素抗性水平的影响,我们应用统计分析软件SPSS 19.0对不同类型抗生素浓度与相应E. coli与S. aureus抗性水平进行双变量相关性分析,通过对多组数据间的两两相关性分析及合并(表2)发现水中与沉积物中E. coli磺胺抗性率、S. aureus磺胺抗性率与SAs的浓度均无显著相关性,E. coli喹诺酮抗性率、S. aureus喹诺酮抗性率与QNs的浓度均无显著相关性。与Na等[12]研究发现北黄海近岸海域E. coli磺胺抗性率与磺胺类抗生素浓度含量存在显著相关性,以及Jiang等[23]对黄浦江各采样点磺胺抗性基因污染水平与SAs总浓度进行分析发现两者具有一定的相关性等结果,并不一致,这可能是由于以往的研究对象多集中于内陆河流、养殖场、市政与医疗废水等,这些区域抗生素含量较高往往能达到几百至几千纳克每升,抗生素能对相应的抗性基因提供较强的选择压力,这种选择压力成为抗生素抗性基因传播的主要推动力。与内陆水环境相比,河口海岸带环境浓度低1到2个数量级,残留水平仅为几十纳克每升,其含量远低于E. coli与S. aureus的最低抑菌浓度,所以其对环境中微生物的抗性变化并未起到决定性作用;另外海陆衔接区物理化学性质更为特殊,存在多种环境因子及其他污染物,且不同河口海岸带的环境条件也不一致,不同的水质环境及内部的选择性压力都会使微生物的生物适应性降低,如水文、盐度等条件均可能会对微生物的抗性产生影响[24]。
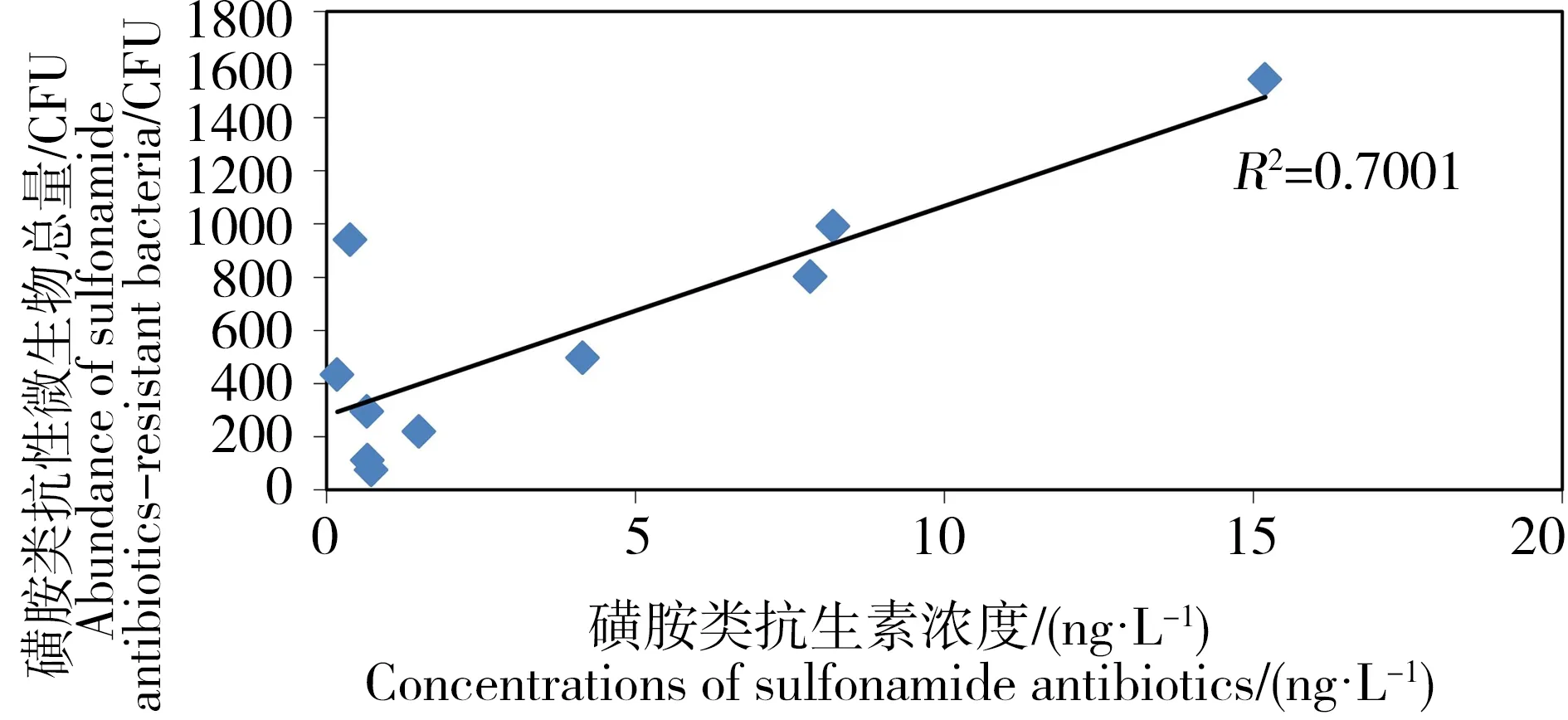
图5 水样中磺胺类抗生素浓度与磺胺类抗性微生物总量的线性关系
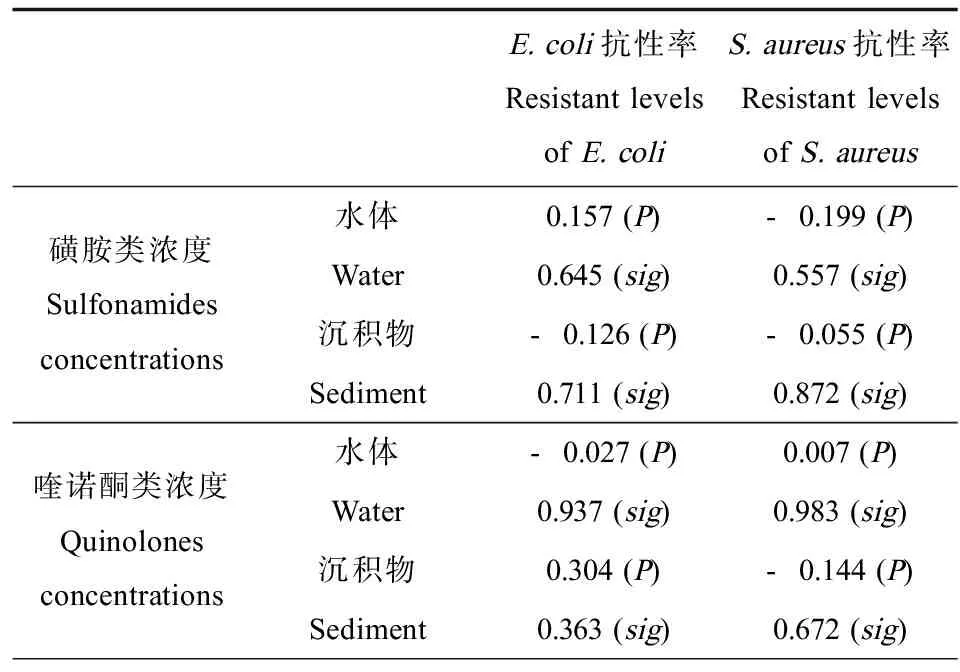
表2 抗生素浓度与不同抗性微生物抗性率相关性分析Table 2 Correlation analysis of antibiotics concentrations and resistant levels
[1] World Health Organization. Antimicrobial resistance: Global report on surveillance [R]. World Health Organization, 2014
[2] Jiang Y H, Li M X, Guo C S, et al. Distribution and ecological risk of antibiotics in a typical effluent-receiving river (Wangyang River) in North China [J]. Chemosphere, 2014, 112: 267-274
[3] Novo A, André S, Viana P, et al. Antibiotic resistance, antimicrobial residues and bacterial community composition in urban wastewater [J]. Water Research, 2013, 47(5): 1875-1887
[4] Carlos N, Ivone V M, Célia M M. Genotypic diversity and antibiotic resistance in Sphingomonadaceae isolated from hospital tap water [J]. Science of the Total Environment, 2014, 466-467: 127-135
[5] Dunlop P S M, Ciavola M, Rizzo L, et al. Effect of photocatalysis on the transfer of antibiotic resistance genes in urban wastewater [J]. Catalysis Today, 2015, 240: 55-60
[6] Luo Y, Mao D Q, Rysz M, et al. Trends in antibiotic resistance genes occurrence in the Haihe River, China [J]. Environmental Science & Technology, 2010, 44(19): 7220-7225
[7] Na G S, Fang X D, Cai Y Q, et al. Occurrence, distribution, and bioaccumulation of antibiotics in coastal environment of Dalian, China [J]. Marine Pollution Bulletin, 2013, 69(1): 233-237
[8] Luo Y, Xu L, Rysz M, et al. Occurrence and transport of tetracycline, sulfonamide, quinolone, and macrolide antibiotics in the Haihe River Basin, China [J]. Environmental Science & Technology, 2011, 45(5): 1827-1833
[9] Jiang L, Hu X L, Yin D Q, et al. Occurrence, distribution and seasonal variation of antibiotics in the Huangpu River, Shanghai, China [J]. Chemosphere, 2011, 82(6): 822-828
[10] US EPA. 821-R-02-024 2002. Total coliforms and Escherichia coli in water by membrane filtration using a simultaneous detection technique [S]. Washington DC: US EPA, 2002
[11] Na G S, Gu J, Ge L K, et al. Detection of 36 antibiotics in coastal waters using high performance liquid chromatography tandem mass spectrometry [J]. Chinese Journal of Oceanology and Limnology, 2011, 29: 1093-1102
[12] Na G S, Zhang W R, Zhou S Y, et al. Sulfonamide antibiotics in the Northern Yellow Sea are related to resistant bacteria: Implications for antibiotic resistance genes [J]. Marine Pollution Bulletin, 2014, 84: 70-75
[13] 秦延文, 张雷, 时瑶, 等. 大辽河表层水体典型抗生素污染特征与生态风险评价[J]. 环境科学研究, 2015, 28(3): 361-368
Qin Y W, Zhang L, Shi Y, et al. Contamination characteristics and ecological risk assessment of typical antibiotics in surface water of the Daliao River, China [J]. Research of Environmental Sciences, 2015, 28(3): 361-368 (in Chinese)
[14] Yang S, Carlson K H. Solid-phase extraction-high-performance liquid chromatography-ion trap mass spetrometry for analysis of trace concentrations of macrolide antibiotics in natural and wastewater matrices [J]. Journal of Chromatography A, 2004, 1038: 141-155
[15] Zhang R J, Zhang G, Zheng Q, et al. Occurrence and risks of antibiotics in the Laizhou Bay, China: Impacts of river discharge [J]. Ecotoxicology and Environmental Safety, 2012, 80: 208-215
[16] Zou S C, Xu W H, Zhang R J, et al. Occurrence and distribution of antibiotics in coastal water of the Bohai Bay, China: Impacts of river discharge and aquaculture activities [J]. Environmental Pollution, 2011, 159(10): 2913-2920
[17] Li W H, Shi Y L, Gao L H, et al. Occurrence of antibiotics in water, sediments, aquatic plants, and animals from Baiyangdian Lake in North China [J]. Chemosphere, 2012, 89(11): 1307-1315
[18] 张波, 刘玉华. 某院2007至2009年度喹诺酮类抗菌药物使用分析[J]. 中国医药指南, 2010, 8(26): 112-113
[19] 施嘉琛, 胡建英, 常红, 等. 北京温榆河流域耐药大肠杆菌的调查研究[J]. 中国环境科学, 2008, 28(1): 39-42
Shi J C, Hu J Y, Chang H, et al. Investigation on the antibiotic-resistance E. coli in Wenyu River in Beijing [J]. China Environmental Science, 2008, 28(1): 39-42 (in Chinese)
[20] Watkinson A J, Micalizzi G R, Bates J R, et al. Novel method for rapid assessment of antibiotic resistance in Escherichia coli isolates from environmental waters by use of a modified chromogenic agar [J]. Applied and Environmental Microbiology, 2007, 73(7): 2224-2229
[21] Gao P P, Mao D Q, Luo Y, et al. Occurrence of sulfonamide and tetracycline-resistant bacteria and resistance genes in aquaculture environment [J]. Water Research, 2012, 46(7): 2355-2364
[22] 欧丹云, 陈彬, 陈灿祥, 等. 九龙江下游河口水域抗生素及抗性细菌分布[J]. 中国环境科学, 2013, 33(12): 2243-2250
Ou D Y, Chen B, Chen C X, et al. Distribution of antibiotics residue and resistant bacteria in the downstream and estuarine area in Jiulong River [J]. China Environmental Science, 2013, 33(12): 2243-2250 (in Chinese)
[23] Jiang L, Hu X L, Xu T, et al. Prevalence of antibiotic resistance genes and their relationship with antibiotics in the Huangpu River and the drinking water sources, Shanghai, China [J]. Science of the Total Environment, 2013, 458: 267-272
[24] Pouliquen H, Delépée R, Larhantec-Verdier M, et al. Comparative hydrolysis and photolysis of four antibacterial agents (oxytetracycline oxolinic acid, flumequine and florfenicol) in deionised water, freshwater and seawater under abiotic conditions [J]. Aquaculture, 2007, 262(1): 23-28
◆
Distribution and Correlation of Typical Antibiotics and Antibiotic-Resistant Bacteria in the Coastal Marine Environment of Laizhou Bay, China
He Chunming1,2, Na Guangshui2,*, Lu Zihao2, Gao Hui2,#, Ge Linke2, Zhang Linxiao3, Li Ruijing2, Li Jun1,2, Yao Yao1,2
1. College of Marine Science, Shanghai Ocean University, Shanghai 201306, China 2. Key Laboratory of Coastal Ecology and Environment of State Oceanic Administration, National Marine Environmental Monitoring Center, Dalian 116023, China 3. College of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China
Received 18 May 2015 accepted 17 August 2015
To study the distribution and correlation of antibiotics and antibiotic-resistant bacteria in the coastal adjacent land environment, 15 kinds of sulfonamides (SAs) and 6 kinds of quinolones (QNs) in water and sediment were analyzed by a multi-residue chemical analysis methodology, using solid phase extraction coupled with liquid chromatography tandem mass spectrometry, sampled from the rivers discharging to the Laizhou Bay and the seawater of the bay. Furthermore, the resistant levels of E. coli and S. aureus in the water and sediment were assessed by the improved Method 1604 (EPA). Results showed that antibiotic residues and resistance pollution problems were widespread in water and sediment of Laizhou Bay. The mean concentrations of SAs and QNs were 3.89 ng·L-1and 234.68 ng·L-1in water, and 0.91 ng·g-1and 49.37 ng·g-1in sediment. For further analysis, a gradually decreasing trend of antibiotics distribution showed from the river to the sea, which indicated that river was a statistically significant source of antibiotics. Meanwhile, high prevalence of antibiotic resistance bacteria was found in the Laizhou Bay. The levels of resistance to SAs were 0%~37.3% (E. coli) and 10.6%~45.8% (S. aureus) in water. The mean concentrations of SAs-resistant E. coli (S-Re-E. coli) and SAs-resistant S. aureus (S-Re-S. aureus) were high up to 2 018 and 4 683 CFU·L-1. Moreover, the mean concentration of QNs-resistant E. coli (Q-Re-E. coli) and QNs-resistant S. aureus (Q-Re-S. aureus) were 1 315 and 1 461 CFU·L-1in water. The resistant levels of the E. coli and S. aureus were 0%~50.0% and 0%~20.8%. Moreover, S. aureus was the main resistant bacteria in sediment, and the detection rate of the S-Re-S. aureus strains and Q-Re-S. aureus strains were all above 80%. The mean concentration of S-Re-S. aureus and Q-Re-S. aureus were 24 and 18 CFU·g-1, and the resistant levels were 0%~ 54.5% and 0%~33.3% in sediment. Correlation analysis showed that a good linearity between the concentrations of SAs and the abundance of SAs-resistant bacteria in water. Nevertheless, no significant correlations were found between antibiotic concentrations and resistant levels, which indicated that antibiotic residues were not the only factor to affect the abundance of antibiotic-resistant bacteria in the coastal adjacent land environment.
sulfonamide; quinolones; antibiotic-resistant bacteria; Laizhou Bay; correlation
国家自然科学基金(No.41406088,No.21377032);国家海洋局海洋公益性科研专项(No.201105013)
何春明(1991-),男,硕士研究生,研究方向为新型污染物环境行为研究,E-mail: hechunming331@163.com;
*通讯作者(Corresponding author),E-mail: gsna@nmemc.org.cn;
(Co-corresponding author),E-mail: hgao@nmemc.org.cn
10.7524/AJE.1673-5897.20150518001
2015-05-18录用日期:2015-08-17
1673-5897(2015)5-115-10
X171.5
A
那广水(1977—),男,博士,研究员,硕士生导师,主要从事新型污染物环境行为及其毒理学研究。
高会(1985—),女,硕士,工程师,主要从事污染物毒理及环境行为方面的研究。
共同
何春明, 那广水,陆紫皓, 等. 莱州湾近岸海域中典型抗生素与抗性细菌分布特征及其内在相关性[J]. 生态毒理学报,2015, 10(5): 115-123
He C M, Na G S, Lu Z H, et al. Distribution and correlation of typical antibiotics and antibiotic-resistant bacteria in the coastal marine environment of Laizhou Bay, China [J]. Asian Journal of Ecotoxicology, 2015, 10(5): 115-123 (in Chinese)

