鸟类Leptin及其受体的研究进展
王丹丹,李艳敏,蒋瑞瑞,康相涛,刘小军
(河南农业大学牧医工程学院,河南省家禽种质资源创新工程研究中心,河南省家禽育种国际联合实验室,郑州 450002)
鸟类Leptin及其受体的研究进展
王丹丹,李艳敏,蒋瑞瑞,康相涛,刘小军*
(河南农业大学牧医工程学院,河南省家禽种质资源创新工程研究中心,河南省家禽育种国际联合实验室,郑州 450002)
自1998年首次报道从鸡的肝组织中克隆获得“鸡Leptin基因”以来,鸡Leptin基因序列的正确性以及Leptin在家禽中的存在性就一直备受争议。虽然家禽Leptin受体的存在被广泛证实,但对其功能的研究也由于内源性Leptin的缺乏而受到限制。随着后基因组学研究时代的到来,使得在更大范围、更深层次上探寻鸟类Leptin基因的存在与否成为可能。2014年,3个独立的实验室先后报道了部分野生鸟类Leptin基因的克隆和功能验证,将鸟类Leptin及其受体的研究又推向了新的高潮。本文综述了鸟类Leptin及其受体基因的结构特征、起源进化、组织分布及“生理功能”的最新研究进展。
鸟类;Leptin;基因克隆;起源进化;生理功能
Leptin也称瘦素,是主要由脊椎动物(非鸟类)白色脂肪组织分泌的小肽类激素,通过与其受体(LEPR)结合发挥其调控动物采食、能量代谢、生长发育、免疫活性和繁殖等生物学过程。自Leptin和LEPR基因分别于1994年和1995年首次成功克隆以来[1-2],有关Leptin与LEPR的生理功能已进行了广泛深入的研究,但这些研究大多集中在哺乳动物,尤其是人和鼠上。虽然鸡的Leptin及其受体(cLEPR)基因的cDNA序列在小鼠和人Leptin和LEPR基因克隆后也相继被报道,但Leptin在家禽中是否存在一直备受争议,对其受体cLEPR的功能研究也由于禽内源性Leptin的缺乏而受到限制。随着后基因组学研究时代的到来,使得在更大范围(不同种属的鸟类)、更深层次(转录组、蛋白组)上探寻鸟类Leptin基因的存在与否成为可能。2014年,3个独立的实验室相继报道了部分野生鸟类的Leptin基因的克隆和功能验证,将鸟类Leptin及LEPR的研究又推向了新的高潮。本文就鸟类Leptin及LEPR基因的结构特征、起源进化、组织分布及“生理功能”的最新研究进展做一概述。
1 鸟类Leptin/LEPR基因的分子克隆及结构特点
1994年,鼠Leptin基因的首次成功克隆[1],敲开了探索生物体Leptin基因生物学功能的大门。Leptin在哺乳动物能量平衡、采食、繁殖、造血、免疫等生物学过程中表现出的重要调控作用,激发了人们对Leptin在其他物种中生理功能研究的热情,在随后的几年里,Leptin基因的克隆在很多非哺乳类脊椎动物中被相继报道。
1.1 鸟类Leptin基因的分子克隆及结构特点
1998年和1999年,两个独立实验室先后报道了禽类中鸡Leptin基因的cDNA序列[3-4]。这些报道的“鸡的Leptin基因”在核苷酸和氨基酸序列上与鼠和人的相似性非常高,其CDS区序列与鼠和人Leptin基因的CDS区序列一致性分别达94.6%和83%,氨基酸序列的一致性分别达97%和83%。用现有的物种进化的理论推导,这种与哺乳动物高度一致的基因序列在鸡基因组中出现的可能性小于百万分之一[5]。同时,多个研究团队根据已报道的“鸡Leptin基因”核苷酸序列设计试验不能重复获得相同的结果,因此对其存在的真实性产生了质疑[6-11]。虽然,后来也不断有关于鸡或鸭Leptin基因克隆的报道[12-13],也有通过试验证明已报道的“鸡Leptin基因”在家鸡中的确存在且序列正确的研究[14],但并没有打消人们对已报道的禽类Leptin基因真实性的疑问。
长期的争议限制了禽类Leptin基因研究的步伐。最近,3个独立的实验室运用已报道脊椎动物的Leptin基因作为参考序列(如:非洲爪蟾Leptin基因的cDNA)在鸟类的基因组、转录组、Sequence-Read-Archive(SRA)等数据库中进行同源序列查找和分析,在野生鸟类(斑胸草雀GenBank Accession No.:JN120790、虎皮鹦鹉GenBank Accession No.:KJ196275和原鸽GenBank Accession No.:HG797022)基因组或肝、脑部等组织中克隆获得了Leptin基因,经基因结构分析,生物学功能验证,被鉴定为是真正的Leptin基因[15-17],这使存在近16年争议的有关鸟类Leptin基因的研究又一次推向高潮。
目前克隆得到鸟类Leptin基因的核苷酸序列与先前报道的“鸡Leptin基因”的核苷酸序列有很大的不同。先前报道的“鸡Leptin基因”的核苷酸序列中GC含量为53.7%,而真正的鸟类Leptin基因GC含量极高,超过70%(原鸽76%、斑胸草雀80%)[15-17],二者氨基酸序列的一致性也仅为28%~29%。进一步的分析表明,真正的鸟类Leptin基因包含4个外显子,其中仅外显子3和4编码蛋白质(图1)。其中,斑胸草雀的Leptin基因编码的蛋白质前体由172个氨基酸残基组成,原鸽的Leptin基因的蛋白质前体由181个氨基酸残基组成,虎皮鹦鹉的Leptin基因预测蛋白质前体由173个氨基酸残基组成。氨基酸序列分析表明,已获得鸟类Leptin与人Leptin的一致性为26%~30%,与爬行类的一致性为48%~54%。而且这些最近注释的鸟类Leptin之间的序列一致性也仅有50%~68%[18]。通过对公开数据库(NCBI:ESTs,NR,WGS,SRA;Ensembl,DNA/RNA-seq Data)中脊椎动物Leptin或Leptin-like基因氨基酸序列的查找,并进行必要的序列组装,进一步得到了9个鸟类物种的Leptin或Leptin-like的全部或部分氨基酸序列(表1)。从氨基酸序列比对分析可以看出,Leptin在物种间的保守性并不高,但变异主要发生在Loop区,且它们都包含一对与二硫键形成至关重要的半胱氨酸残基和公认的4个α螺旋束典型结构(图2);这种鸟类Leptin氨基酸序列的差异并没有引起其构象的改变。然而,鸟类不同种间Leptin生理功能的差异以及鸟类与其他脊椎动物相比Leptin生理功能的改变都需要在获得鸟类Leptin基因结构的基础上进一步深入研究。
为了确定鸟类的Leptin是否与其他脊椎动物的Leptin直系同源,G.Huang等[17]通过在草雀、虎皮鹦鹉、人、鼠、热带爪蟾和斑马鱼的基因组中寻找位于Leptin基因两侧的基因来进行共线性分析(Synteny analysis)。分析发现草雀和虎皮鹦鹉的Leptin基因位于共线性区域(该区域在所有受检测的脊椎动物中保守),表明鸟类的Leptin基因与其他脊椎动物的Leptin基因是直系同源的基因。运用上述公开数据库进行各物种基因查找发现在人、鼠、游隼和猎隼的Leptin基因上游共同存在SND1、LRRC4和MiR129基因,下游共同存在RBM28、PRRT4、IMPDH1、ATP6V1P和FLNC基因[16];然而在斑胸草雀和虎皮鹦鹉Leptin基因临近区域仅找到了MiR129基因,其核苷酸序列在脊椎动物上相当保守,一致性达到85%以上,这或可做为一个标记基因来检测鸟类Leptin基因的存在与否,但还需进一步证实。在水禽中,鸭的基因组中虽存在MiR129基因但还不能确定其Leptin基因的存在[17-18],在陆禽中,鸡、火鸡中还没有找到任何对应序列。鸟类Leptin基因共线性分析结果表明,鸟类Leptin基因及其临近区域GC含量过高导致测序艰难,数据库中无该区段基因注释;或者有些鸟类的Leptin基因连同其临近区域基因一同丢失。

灰色区域为编码Leptin氨基酸的区域The regions coding for Leptin amino acids are grayed图1 斑胸草雀、原鸽和人类Leptin基因的外显子组成[12,14]Fig.1 Exons of Leptin gene in zebra finches,dove and human[12,14]

A、B、C、D.α-螺旋 A,B,C,D.α-helix图2 斑胸草雀Leptin蛋白(a和b)和鼠Leptin蛋白(c和d)的三级结构[14]Fig.2 Tertiary structure of zebra finch Leptin(a and b) and mouse Leptin(c and d)[14]
表1 鸟类Leptin氨基酸序列GenBank号及序列完整性[15]
Table 1 The GenBank number and sequence integrity of Leptin amino acid sequence in avian[15]

物种名称SpeciesnameGenBank登录号GenBankaccessionNo.序列完整性Sequenceintegrity斑胸草雀TaeniopygiaguttataAFK25168Yes西藏地问PseudopodoceshumilisHG425120Yes虎皮鹦鹉MelopsittacusundulatesAHZ86931Yes猎隼FalcocherrugHG425122Yes金鹰AquilachrysaetosCanadensisJDSB01143511,SRR1016445.84242652,SRR1016445.37770192,JDSB01163119,SRR1017148.40189562Yes原鸽ColumbaliviaHG797022Yes绒啄木鸟PicoidespubescensJJRU01076739Yes美洲鹑ColinusvirginianusAWGU01372785No日本鹌鹑CoturnixjaponicaERR125582.247893.2,DRR002300.424669919.1,DRR002301.19253882.1,DRR002301.124106485.1,DRR002301.44847625.1No
1.2 鸟类LEPR基因的分子克隆及结构特点
与鸟类的Leptin基因不同,鸟类的LEPR基因在鼠LEPR基因[2]被克隆之后也很快被克隆并得到验证。到目前家禽中鸡、火鸡、鸭和鹅,以及野生鸟类草雀、原鸽等的LEPR基因相继被克隆[15-17,19-23]。这些已获得的鸟类LEPR基因的核苷酸序列和氨基酸的序列一致性达70%以上,与哺乳动物LEPR的序列一致性约50%,预测获得的蛋白质氨基酸序列中拥有脊椎动物LEPR具有的所有基序、结构域和重要的基本残基[15-17,19-23]。共线性分析表明所有脊椎动物(包括鸟类)的LEPR基因直系同源,所有受检脊椎动物的LEPR基因的临近区域都包含基因AK4、DNAJC6和PDE4b[17]。
LEPR是一种跨膜受体,属于I类细胞因子受体家族,由细胞外区、跨膜区及胞内区3部分组成。胞外区包含多个CK 结构域和F3 结构域,一个C2 结构域和一对WSXWS 基序。其中两个WSXWS 基序间的区域是公认的配体结合域,但研究表明仅CK and F3 结构域是Leptin结合所必需的[24-25]。胞内域包含与JAK-STAT信号转导紧密相关的box 1、box 2和box 3 3个基序以及JAK激活所必需的3个保守的酪氨酸残基,其结构模式如图3所示。

图3 脊椎动物LEPR结构模式图Fig.3 The structure model of LEPR in vertebrate
LEPR在脊椎动物体内表现为多种剪接变体,包含完整型受体(LEPR-b)、短型受体(LEPR-a,c,d,f)和可溶型受体(LEPRe),但仅LEPR-b包含有激活JAK-STAT信号通路所必需的box1~3 基序[26]。短型受体的生物学功能尚不确定,但可能参与体内某些生理过程,如LEPR-a可以与LEPR-b形成异源聚合物参与Leptin的信号传导[27]。可溶型受体缺乏跨膜区和胞内区,以前的研究表明其具有抑制Leptin的生物学活性的作用[28-29];然而最近的研究表明,过表达LEPRe的转基因鼠,能量输出增加,体重降低[30]。在鸟类中,到目前仅报道在鸡中存在3种类型的LEPR剪接变体,即一种完整型受体,一种短型受体和一种可溶型受体[31-32],而且鸡可溶型受体与对应的哺乳动物的可溶型受体不同,它缺乏公认的Leptin结合域。进一步通过对GenBank中鸟类LEPR序列分析发现,鸭LEPR也至少存在有两种剪接变体,一种为完整型,另一种为短型(GenBank Accession No.:EU807933.1)[21]。最近,对鹌鹑LEPR的研究发现,鹌鹑LEPR存在有至少4种类型的剪接变体,一种为完整型受体,另外3种均为可溶型受体(GenBank Accession No.:KJ639904,KJ639905,KM066117)(图4)。可见鸟类LEPR的可变剪接模式与哺乳动物有很大不同。目前,鸟类LEPR短型和可溶型受体的研究还仅停留在组织表达层面,尚无深层次的有关生物学功能的研究报道。
2 鸟类Leptin/LEPR的起源进化
物种间的进化分析是追本溯源的过程。根据脊椎动物的Leptin基因(19个物种)和LEPR基因(16个物种)的氨基酸序列,运用MEGA6.06软件和Neighbor-joining 算法构建分子系统进化树(图5)。可见,按照LEPR的氨基酸序列进行分析,所有鸟类来源于同一分支,亲缘关系较近,且家禽间的进化关系近于家禽与野生鸟类的进化关系(图5B);如果按照目前已获得或预测的鸟类Leptin的氨基酸序列进行分析,所有鸟类也来源于同一分支,亲缘关系较近;而如果按照早先报道的鸡、鸭和火鸡的Leptin的氨基酸序列进行分析,鸡、鸭和火鸡与人、鼠划为同一分支(图5A),这显然不符合脊椎动物在物种间的进化关系。从而也表明,已公布的鸡、鸭和火鸡的Leptin基因序列在各自基因组中的存在是不可能的。
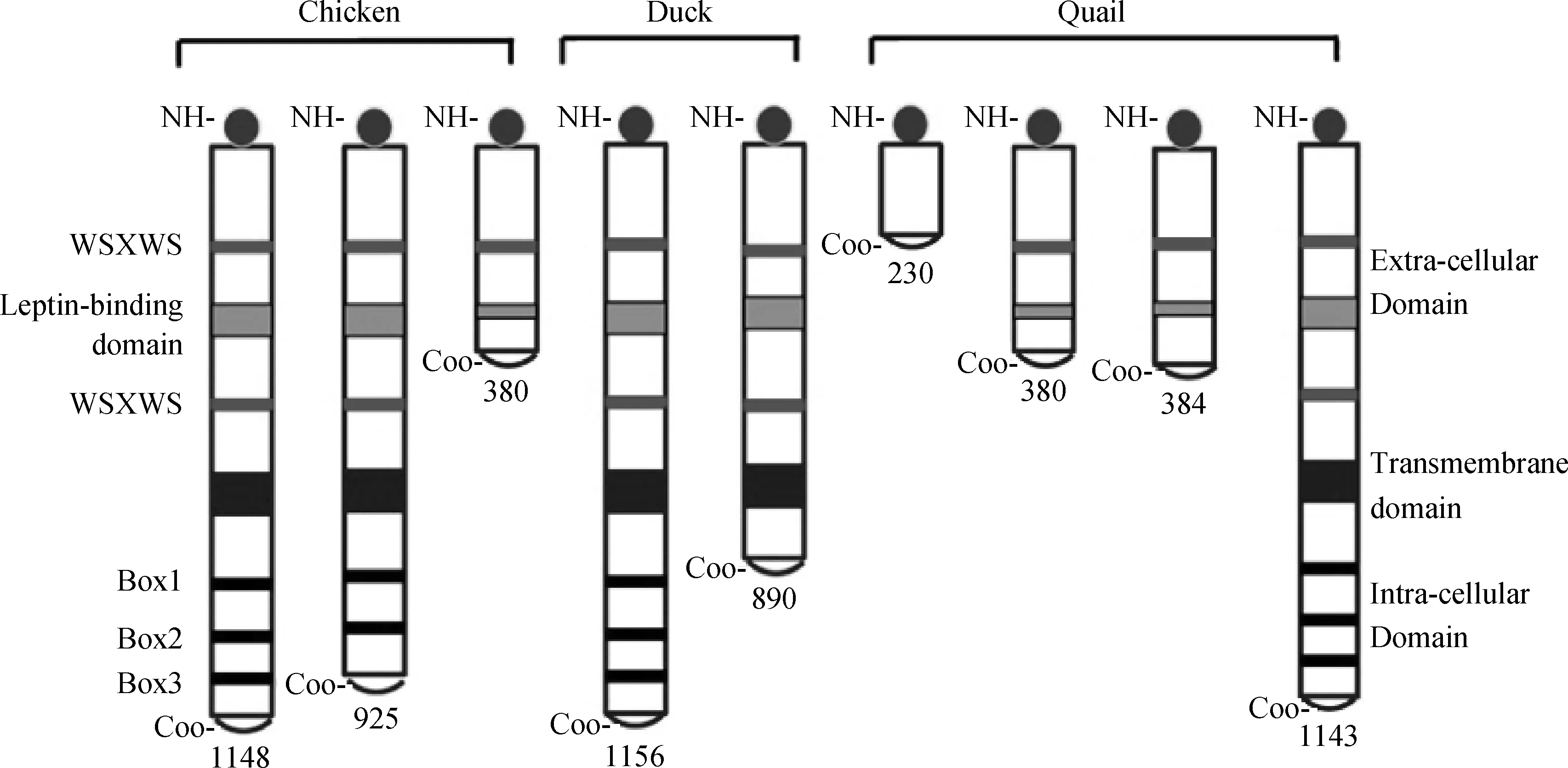
图4 鸡、鸭和鹌鹑中已获得的不同亚型的LEPRFig.4 The obtained different isforms of LEPR in chicken,duck and quail
如前所述,最近获得的鸟类Leptin之间的氨基酸序列一致性并不高,仅为50%~68%。鸟类Leptin间的这种差异或许可以从鸟类进化上得到一定的解释。最近由多个国家研究者组成的鸟类基因组及演化生物学研究团队已完成了对48种鸟类(覆盖了鸟类几乎所有的目)全基因测序(http://avian.genomics.cn/),通过对其进行系统发育[33]和比较基因组学分析[34]进而构建了更为可信的鸟类演化树。从整个基因组进化上来看,原鸽、斑胸草雀和虎皮鹦鹉被分别划分到Passerea(斑胸草雀和虎皮鹦鹉)和Columbea(原鸽)的两大分支中独立演化;斑胸草雀和虎皮鹦鹉虽均属于雀总目和鸣禽,但它们的分支点不同,虎皮鹦鹉的演化分支点要比斑胸草雀的演化分支点早150万年左右;而另一大分支中的原鸽,其演化分支点更早,比斑胸草雀的演化分支点早250万年左右。可见,与其他哺乳或非哺乳动物相比,虽然原鸽、斑胸草雀和虎皮鹦鹉间的亲缘关系较近,但实际上它们间已经经历了漫长的独立进化过程,这与Leptin氨基酸序列的进化相一致(图5A)。鸟类整个基因组的进化在一定程度反映了鸟类的生物多样性,表现在地理分布、食性、生殖等许多方面的差异,以适应生存环境的挑战。
一直以来就有很多基因组学、分子进化等的证据支持在进化过程中Leptin基因在家禽鸡中丢失的观点[9]。最近,N.Dakovic等通过对脊椎动物的进化和共线性分析发现,在动物进化过程中包括Leptin基因在内的一些脂肪因子基因在鸡和其他家禽的基因组中可能丢失,但却存在于野生鸟类的基因组中,这些丢失基因的功能可通过其旁系同源基因进行功能性弥补[35]。然而鹌鹑和绿头鸭Leptin-like部分氨基酸序列的存在让人们不得不考虑如果Leptin基因在鸟类驯化过程中丢失,那么如何来寻找丢失的临界物种,这对于家禽Leptin的研究也是至关重要的,虽然目前已完成了48个鸟类物种全基因组的测序,但仍不包括鹌鹑等驯化的家禽,而且该基因在已有测序鸟类中的信息挖掘还很欠缺。
3 鸟类Leptin/LEPR独特的组织表达模式
最近克隆得到的鸟类的Leptin虽与哺乳动物的Leptin直系同源,却有其独特的表达模式。对雀形目斑胸草雀和鸽形目原鸽的Leptin/LEPR表达模式的研究发现,斑胸草雀的Leptin基因mRNA几乎在垂体和脑部的不同区域专一性表达,在脂肪和肝等外周组织没有检测到其存在[17];在原鸽中,肝、睾丸和卵巢组织的Leptin表达量较高,腹脂、垂体、下丘脑和心肌的Leptin处于较低的表达水平,而大脑、腺胃、胰腺和十二指肠中未检测到Leptin的存在[15]。目前,鸟类Leptin基因表达模式的研究有限,虽不能完全反应鸟类Leptin基因整体的表达规律,但人们可以看出其与哺乳动物Leptin基因表达模式间的鲜明差异。在哺乳动物中,脂肪组织是Leptin最主要的来源,然而在鸟类中脑垂体或肝是Leptin基因显著表达的组织,在脂肪组织中或是检测不到Leptin的存在,或是Leptin基因表达水平很低。在鸟类中,不同物种间Leptin基因的表达也存在差异,不同鸟类Leptin基因在表达模式上的这种差异或许正反应了它们在长期进化过程中适应环境变化的特点,比如斑胸草雀原产于澳大利亚东部等热带森林,而原鸽主要集中在我国西北和内蒙地区,这种地理分布的不同,导致了它们在食性、繁殖特性等方面的差异,而Leptin基因对这些生物学过程可能都起重要的调节作用。另外,从鸟类Leptin基因结构上可以看出,与哺乳动物的Leptin基因3个外显子结构相比,鸟类Leptin基因多出一个非编码的外显子结构(图1),这使得其可能存在一个可变的启动子或适应性调控机制来调控其组织表达[15,17]。先前研究表明,一些进化程度低的鱼类中存在‘A lineage’Leptin的多个拷贝来实现不同的生物学功能[36-37]。然而到爬行类后,由于Leptin基因及临近区域发生基因组重组,使得Leptin基因的拷贝数和结构发生了变化[38],这种变化可能形成一个更适合特定物种的调控机制来适应其所处的内外环境。可见,脊椎动物Leptin基因组织表达上的不同在某种程度上恰恰反映出其多功能性和进化保守性[39-42];但不同物种Leptin基因的具体调控机制仍需进一步研究。

图5 脊椎动物Leptin(A)和LepR(B)的系统进化树Fig.5 The phylogenetic tree of Leptin(A) and LepR(B) in vertebrate
相对于鸟类Leptin基因的研究,鸟类尤其是家禽LEPR基因的研究更为成熟,其总体的表达模式基本相同,在垂体和脑部表达量较高,而在肝、脂肪和小肠等外周组织表达量较低[15,17,19-20,22-23,31],这说明LEPR基因在鸟类中差异并不大,反映出其与Leptin进化的不平行性。而鸟类不同剪接变体LEPR的组织表达研究鲜有报道,仅X.Liu等对鸡的LEPR短型受体做了RT-PCR分析,初步表明其组织选择性表达特点[31]。
鸟类Leptin/LEPR基因的这种表达模式给这一领域的研究者带来一些新的思考。N.Eikelis等研究表明,人体全身Leptin释放进血浆Leptin池时,脑部Leptin的贡献率很大(>40%全身Leptin的释放)[43]。还有一些研究表明Leptin或LEPR缺乏的鼠表现为脑部发育不正常,包括脑重的降低、髓鞘形成障碍、中枢神经系统发育延迟等[44-47]。所有的这些研究,在某种程度上支持脑是脊椎动物Leptin的另外一个来源[43,48]。Leptin基因在鱼、蛙、鸟和哺乳类中的表达以及LEPR基因在所有脊椎动物脑部的表达[20,31,49],表明Leptin在调控正常脑部发育和功能方面可能扮演至关重要的角色,并且这种调控角色在脊椎动物中很可能是保守的[50]。而鸟类Leptin/LEPR在垂体中的显著表达或许表明其对生长、繁殖、能量平衡的调控更加直接。
4 鸟类“Leptin/LEPR的生理功能”
鸟类Leptin基因序列的正确性从其报道之日起就倍受争议,但在真正的鸟类Leptin基因被克隆之前,有的研究人员对所谓的“鸡Leptin基因”进行了体外表达,制备了相应的抗体[8],并利用这些体外表达的“鸡Leptin”或鼠源、人源Leptin对鸟类“Leptin/LEPR的生理功能”进行了研究。这些研究虽然只能说明鸟类LEPR具有生物学功能,并不能反映鸟类真正内源性Leptin的生理功能[9],但对今后开展真正鸟类Leptin/LEPR的生理功能的研究从某种程度上也具有一定的借鉴意义。
4.1 采食与能量调控
Leptin通过与LEPR结合启动信号的转导进而行使其多种生物学功能[51]。在哺乳动物中,Leptin是通过位于下丘脑多个核团GLP-1神经元上的LEPR-b来实现减少摄食和增加能量输出的[52]。一般认为Leptin调控动物体内能量代谢的途径包括调控神经中枢,使能量转变成热能释放;抑制NPY mRNA的表达及分泌,进而抑制食欲和减少食物的摄取[53];增加脂肪酸分解酶的合成,抑制脂肪的沉积;直接作用于体内的脂肪细胞抑制脂肪的沉积,增加脂肪的分解[54]。在家禽中,至今还没有获得内源性的Leptin。虽然有人对所谓的“鸡Leptin基因”进行了体外表达,获得了重组的“鸡Leptin”蛋白,但由于“鸡Leptin基因”与小鼠的Leptin基因的序列一致性高达94%以上,这些重组的“鸡Leptin”蛋白实际上可以认为是小鼠的Leptin。通过外源注射的方式对这些重组的Leptin 蛋白在鸡中生理功能的研究表明,无论通过脑室注射还是腹腔注射都对蛋鸡或肉鸡的采食量和体重有一定的降低作用,并且脑室注射还具有一定的剂量依赖效应[55-56]。此外,肌注外源Leptin也能够有效调控野生鸟类的采食量[57-58]。鸡LEPR基因多态性与采食效率的相关研究表明,LEPR可能在调控肉鸡采食和饲料转化效率等方面具有一定作用[59]。另外,用抗鸡LEPR胞外域抗体免疫激活LEPR信号通路,可导致鸡腹脂沉积减少,却增加了采食量,这可能是由于抗鸡LEPR胞外域抗体不能通过血脑屏障进入大脑发挥与Lepin同样的功能所致[60]。然而,A.Gertler等把鼠的Leptin拮抗剂注射到白来航母鸡体内进行研究时,并没有发现其体重和食欲的显著增加[61]。可见不同的试验得到的结论并不一致。由于Leptin/LEPR在野生鸟类垂体中均有较高水平的表达,这或许表明其调控摄食的机制与传统认为的哺乳动物的调控机制不同,还有待进一步深入研究。
4.2 生长发育
Leptin/LEPR在脊椎动物生长发育方面扮演重要的角色,正如文献[44-47]提到的Leptin或LEPR缺乏会导致鼠脑部发育不正常。此外,有研究表明,Leptin能够调控脊椎动物一些垂体激素如生长激素(GH)的分泌[62-66]。动物体内试验表明,Leptin对GH释放的影响是多变的,其取决于不同生理阶段Leptin的敏感性;而GH剂量的高低又会影响信号通路中SOCS-3基因的表达,进而对动物的生长发育产生影响[67-68]。在家禽中,用生长和发育都较快的日本鹌鹑作为模型的研究表明,经外源Leptin处理过的鹌鹑出壳时间早于对照组,且出壳后有更高的体重,这种体重上的优势一直持续到性成熟;进一步研究发现处理组出壳后血液生化指标(T3、T4、总脂和甘油三酯)发生显著改变,这表明Leptin在鹌鹑神经内分泌系统中可能作为一个低能状态的信号可以提高生长发育过程中对营养物质的利用[69]。然而,与在鹌鹑中的研究不同,胚胎期经Leptin处理过的鸡与对照组相比出壳后体重降低,肝重升高[70]。鸡LEPR基因多态性与生长的相关研究表明,LEPR可能对肉鸡的生长速度具有一定的影响[59]。用抗鸡LEPR胞外域抗体免疫激活LEPR信号通路,可导致鸡增重减少[60]。从以上研究来看,外源注射重组的Leptin或用抗鸡LEPR胞外域抗体进行免疫,并不能真实反映鸟类本身Leptin/LEPR的生理调控作用,但鸟类Leptin/LEPR垂体组织高表达或许反应了其与生长发育间可能存在紧密的联系。
4.3 繁殖调控
LEPR在鸟类生殖轴上的广泛表达提示人们Leptin可能是一个联系营养代谢与生殖内分泌之间的纽带。研究表明,注射外源重组Leptin能促进母鸡的性成熟[71],减弱由于禁食对卵巢功能造成的负面效应如卵黄囊衰退、卵泡细胞的凋亡和产蛋终止[71-73];也有研究发现,随着鸡卵泡的分化,卵巢颗粒细胞中LEPR mRNA表达水平会下降,而限制进食会在一定程度上恢复卵泡的分化进而表明Leptin/LEPR可能参与卵泡分化的调控[74];另外,长光照虽然能够诱导家禽性成熟提前,但这些性成熟提前的母鸡,其血清Leptin、下丘脑LEPR基因的表达及下丘脑-垂体-性腺轴上基因的表达均没有增加[75],这与注射外源重组Leptin与母鸡性成熟之间关系的研究大不相同。最近,通过设计具有Leptin生物学活性的免疫抗体模拟物对LEPR在繁殖调控中的生物学功能的研究表明,用针对鸡LEPR胞外域设计的具有Leptin生物学活性的免疫抗体模拟物对母鸡进行免疫,上调了卵泡上凋亡基因的表达,进而反向调控促进卵泡发育和激素分泌的基因的表达,导致卵泡闭锁和产蛋终止,而且孕酮的分泌抑制也降低了母鸡的采食[76],这一研究方法虽不能真实反应鸡内源性Leptin/LEPR相互作用和信号传导的过程,但至少从一个侧面表明了鸡体内Leptin/LEPR对鸡繁殖性能的调控机制。
虽然Leptin/LEPR在鸟类中生理功能的研究取得了一定进展,但Leptin在鸟类体内发挥功能的真正信号转导机制只有在得到鸟类LEPR的天然配体基础上才能更清晰更深入地进行研究。最近,野生鸟类Leptin基因的成功克隆将鸟类Leptin/LEPR生理功能的研究推向新的研究阶段。野生鸟类Leptin在信号通路中的活性检测[15,17]为今后鸟类尤其是家禽Leptin/LEPR更进一步的生理功能研究奠定了基础。
5 小 结
自1998年从鸡的肝脏中克隆得到“鸡Leptin基因”以来,Leptin在家禽中是否真实存在备受争议。虽然鸟类Leptin/LEPR的研究从未停止,但多年来并未获得可靠的突破性进展。最近野生鸟类Leptin基因的成功克隆,部分回答了鸟类中是否存在Leptin基因这一长久困扰鸟类Leptin/LEPR研究的问题,克服了鸟类Leptin/LEPR研究的瓶颈,掀起新一轮鸟类Leptin/LEPR功能研究的热潮。然而从现有的知识积累可以看出,鸟类Leptin与其他脊椎动物的Leptin相比,无论是分子结构还是表达模式都相去甚远,反映出Leptin基因的多功能性,因此其生理功能还需要进一步验证[77]。此外,迄今为止尚未获得家禽如鸡、鸭、鹅和火鸡等的Leptin基因序列,家禽中Leptin存在与否的争论依然存在,而鸟类基因组及演化生物学项目对48种鸟类全基因组测序的完成,必将推动鸟类Leptin基因的研究进程。目前,人们已成功从唯一发现可能存在Leptin基因的鹌鹑(鸡形目)中克隆获得Leptin-like部分序列,并进行了相关的功能研究,但仍需要从分子进化、生物信息学、分子生物学等不同角度对其生理功能进行进一步的深入探讨。
[1] ZHANG Y,PROENZA R,MAFFEI M,et al.Positional cloning of the mouse obese gene and human homologue[J].Nature,1994,372(6505):425-432.
[2] TARTAGLIA I A,DEMBSKI M,WENG X,et al.Identification and expression cloning of a leptin receptor,OB-R[J].Cell,1995,83(7):1263-1271.
[3] TAOUIS M,CHEN J W,DAVIAUD C,et al.Cloning the chicken leptin gene[J].Gene,1998,208(2):239-242.[4] ASHWELL C M,CZERWINSKI S M,BROCHT D M,et al.Hormonal regulation of leptin expression in broiler chickens[J].AmJPhysiol,1999,276(1 Pt 2):R226-232.
[5] DUNN I C,GIRISHVARMA G,TALBOT R T,et al.Evidence for lowhomology between the chicken and mammalian leptin genes[A].Dawson A,Chaturvedi CM.VII International Symposium on Avian Endocrinology[C].New Delhi:Narosa Publishing House,2001:327-336.
[6] FRIEDMAN-EINAT M,BOSWELL T,HOREV G,et al.The chicken leptin gene:has it been cloned?[J].GenCompEndocrinol,1999,115(3):354-363.
[7] 李 辉,顾志良,赵建国,等.鸡瘦蛋白基因克隆中的若干问题研究[J].东北农业大学学报,2004,35(6):72-78. LI H,GU Z L,ZHAO J G,et al.Issues on the cloning of chickenLeptingene[J].JournalofNortheastAgriculturalUniversity,2004,35(6):72-78.(in Chinese)
[8] SHARP P J,DUNN I C,WADDINGTON D,et al.Chicken leptin[J].GenCompEndocrinol,2008,158(1):2-4.
[9] PITEL F,FARAUT T,BRUNEAU G,et al.Is there a leptin gene in the chicken genome? Lessons from phylogenetics,bioinformatics and genomics[J].GenCompEndocrinol,2010,167(1):1-5.
[10] PITEL F,MONBRUN C,GELLIN J,et al.The chicken LEP(OB) gene has not been mapped[J].AnimGenet,2000,31(4):281.
[11] SCANES C G.Absolute and relative standards-the case of leptin in poultry:first do no harm[J].PoultSci,2008,87(10):1927-1928.
[12] CASSY S,DEROUET M,CROCHET S,et al.Leptin and insulin downregulate leptin receptor gene expression in chicken-derived leghorn male hepatoma cells[J].PoultSci,2003,82(10):1573-1579.
[13] 戴汉川,龙良启.鸭肥胖基因的分子克隆序列分析及原核表达[J].畜牧兽医学报,2005,36(7):641-647. DAI H C,LONG L Q.Molecular cloning of the obese gene from duck and its expression inE.coli[J].ActaVeterinariaetZootechnicaSinica,2005,36(7):641-647.(in Chinese)
[14] 邵西兵,施振旦,于迎春,等.鸡Leptin基因正确性的免疫验证[J].动物学研究,2005,26(2):168-173. SHAO X B,SHI Z D,YU Y C,et al.Immuno-verification of correctness of cloned chickenLeptingene[J].ZoologicalResearch,2005,26(2):168-173.(in Chinese)
[15] FRIEDMAN-EINAT M,COGBURN L A,YOSEFI S,et al.Discovery and characterization of the first genuine avian leptin gene in the rock dove(Columbalivia)[J].Endocrinology,2014,155(9):3376-3384.
[16] PROKOP J W,SCHMIDT C,GASPER D,et al.Discovery of the elusive leptin in birds:identification of several ‘missing links’ in the evolution of leptin and its receptor[J].PLoSONE,2014,9(3):e92751.
[17] HUANG G,LI J,WANG H,et al.Discovery of a novel functional Leptin protein(LEP) in zebra finches:evidence for the existence of an authentic avian Leptin gene predominantly expressed in the brain and pituitary[J].Endocrinology,2014,155(9):3385-3396.
[18] FRIEDMAN-EINAT M,SEROUSSI E.Quack leptin[J].BMCGenomics, 2014(15):551.
[19] HOREV G,EINAT P,AHARONI T,et al.Molecular cloning and properties of the chicken leptin-receptor(CLEPR) gene[J].MolCellEndocrinol,2000,162(1-2):95-106.
[20] RICHARDS M P,POCH S M.Molecular cloning and expression of the turkey leptin receptor gene[J].CompBiochemPhysiolBBiochemMolBiol,2003,136(4):833-847.
[21] 宋岳强.家鸭leptin受体cDNA的克隆分析及外源leptin对家鸭生殖机能的影响[D].厦门:厦门大学,2008. SONG Y Q.Cloning and characterization of duck Leptin receptor cDNA and effect of exogenous Leptin on duck reproductive function[D].Xiamen:Xiamen University,2008.(in Chinese)
[22] WANG F,LU L,YUAN H,et al.Molecular cloning,expression,and regulation of goose leptin receptor gene in adipocytes[J].MolCellBiochem,2011,353(1-2):267-274.
[23] OHKUBO T,TANAKA M,NAKASHIMA K.Structure and tissue distribution of chicken leptin receptor(cOb-R ) mRNA[J].BiochimBiophysActa,2000,1491(1-3):303-308.
[24] FONG T M,HUANG R R,TOTA M R,et al.Localization of leptin binding domain in the leptin receptor[J].MolPharmacol,1998,53(2):234-240.
[25] SANDOWSKI Y,RAVER N,GUSSAKOVSKY E E,et al.Subcloning,expression,purification,and characterization of recombinant human leptin-binding domain[J].JBiolChem,2002,277(48):46304-46309.
[26] MYERS M G,COWLEY M A,MUNZBERG H.Mechanisms of leptin action and leptin resistance[J].AnnuRevPhysiol,2008,170:537-556.
[27] BACART J,LELOIRE A,LEVOYE A,et al.Evidence for leptin receptor isoforms heteromerization at the cell surface[J].FEBSLett,2010,584(11):2213-2217.
[28] YANG G,GE H,BOUCHER A,et al.Modulation of direct leptin signaling by soluble leptin receptor[J].MolEndocrinol,2004,18(6):1354-1362.
[29] ZASTROW O,SEIDEL B,KIESS W,et al.The soluble leptin receptor is crucial for leptin action:evidence from clinical and experimental data[J].IntJObesRelatMetabDisord,2003,27(12):1472-1478.
[30] LOU P H,YANG G,HUANG L,et al.Reduced body weight and increased energy expenditure in transgenic mice over-expressing soluble leptin receptor[J].PLoSONE,2010,5(7):e11669.
[31] LIU X,DUNN I C,SHARP P J,et al.Molecular cloning and tissue distribution of a short form chicken leptin receptor mRNA[J].DomestAnimEndocrinol,2007,32(3):155-166.
[32] LIU X,SHARP P J.Deletions in mRNA encoding the chicken leptin receptor gene binding domain[J].CompBiochemPhysiolBBiochemMolBiol,2006,146(2):250-255.
[33] JARVIS E D,MIRARAB S,ABERER A J,et al.Whole-genome analyses resolve early branches in the tree of life of modern birds[J].Science,2014,346(6215):1320-1331.
[34] ZHANG G,LI C,LI Q,et al.Comparative genomics reveals insights into avian genome evolution and adaptation[J].Science,2014,346(6215):1311-1320.
[35] DAKOVIC N,TEREZOL M,PITEL F,et al.The loss of adipokine genes in the chicken genome and implications for insulin metabolism[J].MolBiolEvol,2014,31(10):2637-2646.
[36] GORISSEN M,BERNIER N J,NABUURS S B,et al.Two divergent leptin paralogues in zebrafish(Daniorerio) that originate early in teleostean evolution[J].JEndocrinol,2009,201(3):329-339.
[37] KUROKAWA T,MURASHITA K.Genomic characterization of multiple leptin genes and a leptin receptor gene in the Japanese medaka,Oryzias latipes[J].GenCompEndocrinol,2009,161(2):229-237.
[38] BOORSE G C,LIBBON J V.Genomic characterization of two leptin genes and a leptin receptor gene in the Green Anole,Anoliscarolinensis[J].IntCompBiol,2010,50:E207.
[39] RONNESTAD I,NILSEN T O,MURASHITA K,et al.Leptin and leptin receptor genes in Atlantic salmon:Cloning,phylogeny,tissue distribution and expression correlated to long-term feeding status[J].GenCompEndocrinol,2010,168(1):55-70.
[40] BERNIER N J,GORISSEN M,FLIK G.Differential effects of chronic hypoxia and feed restriction on the expression of leptin and its receptor,food intake regulation and the endocrine stress response in common carp[J].JExpBiol,2012,215(Pt 13):2273-2282.
[41] INGVARTSEN K L,BOISCLAIR Y R.Leptin and the regulation of food intake,energy homeostasis and immunity with special focus on periparturient ruminants[J].DomestAnimEndocrinol,2001,21(4):215-250.[42] DENVER R J,BONETT R M,BOORSE G C.Evolution of leptin structure and function[J].Neuroendocrinology,2011,94(1):21-38.
[43] EIKELIS N,LAMBERT G,WIESNER G,et al.Extra-adipocyte leptin release in human obesity and its relation to sympathoadrenal function[J].AmJPhysiolEndocrinolMetab,2004,286(5):744-752.
[44] BEREITER D A,JEANRENAUD B.Altered neuroanatomical organization in the central nervous system of the genetically obese(ob/ob) mouse[J].BrainRes,1979,165(2):249-260.
[45] STEPPAN C M,SWICK A G.A role for leptin in brain development[J].BiochemBiophysResCommun,1999,256(3):600-602.
[46] AHIMA R S,BJORBAEK C,OSEI S,et al.Regulation of neuronal and glial proteins by leptin:implications for brain development[J].Endocrinology,1999,140(6):2755-2762.
[47] BOURET S G,DRAPER S J,SIMERLY R B.Trophic action of leptin on hypothalamic neurons that regulate feeding[J].Science,2004,304(5667):108-110.
[48] ESLER M,VAZ M,COLLIER G,et al.Leptin in human plasma is derived in part from the brain,and cleared by the kidneys[J].Lancet,1998,351(9106):879.
[49] UDAGAWA J,HATTA T,NAORA H,et al.Expression of the long form of leptin receptor(Ob-Rb) mRNA in the brain of mouse embryos and newborn mice[J].BrainRes,2000,868(2):251-258.
[50] BOURET S G.Neurodevelopmental actions of leptin[J].BrainRes,2010,1350:2-9.
[51] HEGYI K,FULOP K,KOVACS K,et al.Leptin-induced signal transduction pathways[J].CellBiolInt,2004,28(3):159-169.
[52] MEISTER B.Control of food intake via leptin receptors in the hypothalamus[J].VitamHorm,2000,59:265-304.
[53] WANG Q,BING C,Al-BARAZANJI K,et al.Interactions between leptin and hypothalamic neuropeptide Y neurons in the control of food intake and energy homeostasis in the rat[J].Diabetes,1997,46(3):335-341.[54] 吴 玲,王 敏,占秀安.脂肪沉积的分子调控机制[J].中国饲料,2006(12):15-17. WU L,WANG M,ZHAN X A.Molecular regulatory mechanisms of fat deposition[J].ChinaFeed,2006(12):15-17.(in Chinese)
[55] DENBOW D M,MEADE S,ROBERTSON A,et al.Leptin-induced decrease in food intake in chickens[J].PhysiolBehav,2000,69(3):359-362.[56] CASSY S,PICARD M,CROCHET S,et al.Peripheral Leptin effect on food intake in young chickens is influenced by age and strain[J].DomestAnimEndocrinol,2004,27(1):51-61.
[57] LOHMUS M,SUNDSTROM L F,SILVERIN B.Chronic administration of leptin in Asian Blue Quail[J].JExpZoolACompExpBiol,2006,305(1):13-22.[58] LOHMUS M,SUNDSTROM L F,El-HALAWANI M,et al.Leptin depresses food intake in great tits(Parus major)[J].GenCompEndocrinol,2003,131(1):57-61.
[59] EL MOUJAHID EL M,CHEN S,JIN S,et al.Association of leptin receptor gene polymorphisms with growth and feed efficiency in meat-type chickens[J].PoultSci,2014,93(8):1910-1915.
[60] LEI M M,WU S Q,SHAO X B,et al.Creating leptin-like biofunctions by active immunization against chicken leptin receptor in growing chickens[J].DomestAnimEndocrinol,2015,50:55-64.
[61] GERTLER A,SHINDER D,YOSEFI S,et al.Pegylated leptin antagonist with strong orexigenic activity in mice is not effective in chickens[J].JExpBiol,2014,217(Pt 2):180-184.
[62] YU W H,KIMURA M,WALCZEWSKA A,et al.Role of leptin in hypothalamic-pituitary function[J].ProcNatlAcadSciUSA,1997,94(3):1023-1028.
[63] YU W H,WALCZEWSKA A,KARANATH S,et al.Nitric oxide mediates leptin-induced luteinizing hormone-releasing hormone(LHRH) and LHRH and leptin-induced LH release from the pituitary gland[J].Endocrinology,1997,138(11):5055-5058.
[64] ROH S,CLARKEl I J,XU R,et al.The effect of leptin on basal and growth hormone-releasing hormone-stimulated growth hormone secretion from the ovine pituitary gland[J].Neuroendocrinology,1998,68(6):361-364.
[65] AMSTALDEN M,GARCIA M R,STANKO R L,et al.Central infusion of recombinant ovine leptin normalizes plasma insulin and stimulates a novel hypersecretion of luteinizing hormone after short-term fasting in mature beef cows[J].BiolReprod,2002,66(5):1555-1561.
[66] LIU Q,CHEN Y,COPELAND D,et al.Expression of leptin receptor gene in developing and adult zebrafish[J].GenCompEndocrinol,2010,166(2):346-355.
[67] BJORBAEK C,LAVERY H J,BATES S H,et al.SOCS3 mediates feedback inhibition of the leptin receptor via Tyr 985[J].JBiolChem,2000,275(51):40649-40657.
[68] SZCZESNA M,KIRSZ K,KUCHARSKI M,et al.Obesity and leptin resistance:The role of growth hormone[J].Health,2013,5:29-39.
[69] LAMOSOVA D,MACAJOVA M,ZEMAN M,et al.Effect ofinovoleptin administration on the development of Japanese quail[J].PhysiolRes,2003,52(2):201-209.
[70] HU Y,ZHANG R,ZHANG Y,et al.In ovo leptin administration affects hepatic lipid metabolism and microRNA expression in newly hatched broiler chickens[J].JAnimSciBiotechnol,2012,3(1):16.
[71] PACZOSKA-ELIASIEWICZ H E,PROSZKOWIEC-WEGLARZ M,PROUDMAN J,et al.Exogenous leptin advances puberty in domestic hen[J].DomestAnimEndocrinol,2006,31(3):211-226.
[72] PACZOSKA-ELIASIEWICZ H E,GERTLER A,PROSZKOWIEC M,et al.Attenuation by Leptin of the effects of fasting on ovarian function in hens[J].Reproduction,2003,126(6):739-751.
[73] SONG Y,WANG C,WANG C,et al.Exogenous Leptin promotes the recovery of regressed ovary in fasted ducks[J].AnimReprodSci,2009,110(3-4):306-318.[74] CASSY S,METAYER S,CROCHET S,et al.Leptin receptor in the chicken ovary:potential involvement in ovarian dysfunction of ad libitum-fed broiler breeder hens[J].ReprodBiolEndocrinol,2004(2):72-79.
[75] NI Y,LV J,WANG S,et al.Sexual maturation in hens is not associated with increases in serum leptin and the expression of leptin receptor mRNA in hypothalamus[J].JAnimSciBiotechnol,2013,4(1):24.
[76] LEI M M,WU S Q,LI X W,et al.Leptin receptor signaling inhibits ovarian follicle development and egg laying in chicken hens[J].ReprodBiolEndocrinol,2014,12:25.
[77] ROBERT P.Millar identification of genuine/authentic avian Leptin:Some answers and more questions[J].Endocrinology,2014,155(9):3203-3205.
(编辑 郭云雁)
Research Advances on Avian Leptin and Its Receptor
WANG Dan-dan,LI Yan-min,JIANG Rui-rui,KANG Xiang-tao,LIU Xiao-jun*
(InternationalJointResearchLaboratoryforPoultryBreedingofHenan,HenanInnovativeEngineeringResearchCenterofPoultryGermplasmResource,CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou450002,China)
The authenticity of the so-called “chickenLeptingene” was questioned since it was first reported in 1998.Actually it is not sure whether theLeptingene exists in poultry genome until now.Although Leptin receptor gene had been widely confirmed in poultry,its physiological functions were still ambiguous due to the lack of endogenous Leptin.With the coming of the post genome age,it’s possible to look into theLeptingene matter of avian species in wide scale and great depth.In 2014,3 laboratories independently reported the cloning and functional verification ofLeptingene in some wild birds.The findings greatly stimulated research interests in avian Leptin and Leptin receptor.We reviewed the latest advances in structure characteristics,origin and evolution,tissue distribution and “physiological functions” ofLeptinandLeptinreceptor gene in avian.
avian;Leptin;gene cloning;origin and evolution;physiological function
10.11843/j.issn.0366-6964.2015.11.001
2015-01-09
河南省国际合作项目(144300510044);河南省重大科技攻关计划项目(112101110800);国家蛋鸡产业技术体系遗传育种岗位专项资金(CARS-41-K04)
王丹丹(1989-),女,河南柘城人,硕士生,主要从事家禽分子遗传育种研究,E-mail:wdd13938406174@163.com
*通信作者:刘小军,教授,主要从事动物遗传育种研究,E-mail:xjliu2008@hotmail.com
S83
A
0366-6964(2015)11-1905-11

