食品蛋白质的琥珀酰化修饰研究进展
杨 敏,杨继涛,杨 晰,张 媛
(甘肃农业大学理学院,甘肃兰州 730070)
食品蛋白质的琥珀酰化修饰研究进展
杨 敏,杨继涛,杨 晰,张 媛
(甘肃农业大学理学院,甘肃兰州 730070)
琥珀酰化修饰是一种常用的蛋白质结构修饰手段,其通过增加蛋白质分子净负电荷含量而改变蛋白质结构,从而使蛋白质性质显著改善。本文综述了蛋白质的琥珀酰化修饰条件以及修饰后蛋白质主要功能性质的变化程度,为蛋白质改性研究提供参考依据。
蛋白质,琥珀酸酐,琥珀酰化修饰,功能性质
蛋白质的化学修饰技术主要是蛋白质的氨基酸残基修饰技术,是通过化学试剂对蛋白质肽链上的特定活性基团衍生化,使部分肽键断裂或引入各种功能基团,包括对氨基酸残基的酰化、去酰胺、磷酸化、糖基化、共价交联、水解以及氧化等。蛋白质肽链上的活性基团主要有氨基、羟基、巯基等。化学修饰的本质是通过新基团的引入而改变蛋白质的结构、构象以及净电荷、疏水性等,从而改善其功能性质,如溶解性、表面性质、吸水性、凝胶性以及热稳定性等[1]。目前,关于食品蛋白质的化学修饰研究报道主要有酰化、磷酸化、脱酰胺、糖基化、烷基化等方面[1],其中,酰化修饰因其显著的修饰效果而备受关注。
在蛋白质的侧链引入羧酸基即为蛋白质的酰化修饰,该修饰技术反应条件温和,修饰程度高,部分酰化试剂可显著改善蛋白质净电荷,从而使其部分功能性质发生较大变化,是目前研究较多的一种化学修饰技术。酰化修饰常用试剂有乙酸酐、琥珀酸酐(丁二酸酐)、丁二酸等,其中琥珀酸酐为最常用试剂,其反应活性高,反应条件温和,易于控制,反应程度高,改性效果显著。由于琥珀酰化修饰后,琥珀酸以酰胺键与蛋白质相连,使得其净负电荷增加显著,从而相关性质发生显著改变[2]。
1 琥珀酰化对蛋白质的修饰机理
蛋白质的琥珀酰化反应主要是肽链中的亲核基团攻击琥珀酸酐的羰基碳原子,从而诱发的一类亲核取代反应。琥珀酸酐与蛋白质氨基反应原理如下:

图1 蛋白质的琥珀酰化修饰机理Fig.1 The mechanism of succinylation on proteins
赖氨酸(Lys)ε-氨基具有较低的pK值和较弱的空间位阻,表现出较强的亲核能力。脂肪族羟基(苏氨酸,丝氨酸)和巯基(半胱氨酸)也有一定的亲和能力,但不如氨基反应活性高。其他侧链基团,如酪氨酸(Tyr)的酚羟基及组氨酸的咪唑基均可以参与琥珀酰化反应,但酰化产物不稳定[3]。由于琥珀酰基带有负电荷,酰化修饰后蛋白质侧链净负电荷增加,分子间静电斥力增大,位阻效应增强,蛋白质结构伸展,构象发生变化,因此性质显著改变。
2 蛋白质琥珀酰化修饰的影响因素
琥珀酰化修饰程度影响着修饰后蛋白质的功能性质。目前,琥珀酰化程度常用的测定方法有茚三酮比色法和邻苯二甲醛法[2]。琥珀酰化对蛋白质的修饰程度与琥珀酸酐用量密切相关。随着琥珀酸酐用量的增加,蛋白质酰化程度迅速增大;当酸酐用量达到一定程度以后,酰化程度增加缓慢甚至不再变化。当琥珀酸酐用量未过量时,酰化反应主要发生在ε-氨基上,当绝大多数氨基被酰化后,羟基和巯基才会被酰化。
由于不同类型蛋白质琥珀酰化的活性基团含量不同,蛋白质分子结构和结构柔韧性不同,即使在酸酐相同用量的情况下酰化程度也会不同。几种蛋白质的琥珀酰化程度见表1。
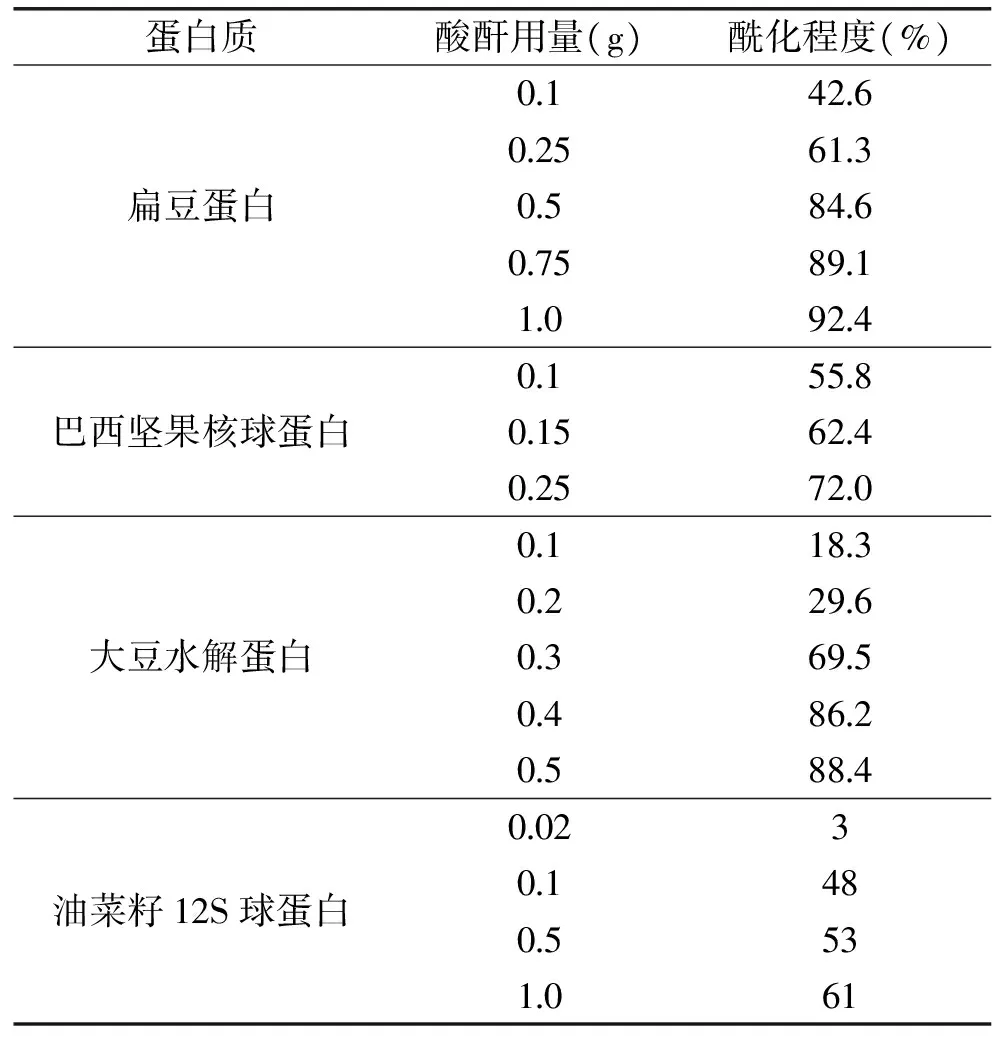
表1 不同蛋白质的琥珀酰化程度[4-8]Table 1 Degree of succinylation on different proteins[4-8]
也有研究指出,琥珀酸酐和蛋白质质量配比的对数值与酰化程度表现为近似线性关系,牛血清白蛋白、酪蛋白和两种鱼蛋白均表现出这样的特性[9]。
当琥珀酸酐严重过量时,琥珀酰化修饰程度可高达95%以上。例如,当琥珀酸酐用量是氨基含量的100倍时,溶菌酶酰化程度可达到99%[10];β-乳球蛋白(β-lg)在琥珀酸酐用量为2.5∶1g/g蛋白质时,酰化程度为93%[11]。由此可见,琥珀酰化修饰程度较高,不同程度修饰产物可通过调节琥珀酸酐用量而获得。
蛋白质琥珀酰化修饰过程温度多为室温或30~50℃,pH为8~9,反应至pH稳定即可,反应条件温和,易于实现和控制[4,11-12]。
3 琥珀酰化修饰对蛋白质空间结构的影响
琥珀酰化修饰后,蛋白质多表现为结构伸展,吲哚基发色团暴露,三级结构改变,二级结构也会因此受到影响,不同蛋白质结构变化程度具有差异。研究指出,溶菌酶酰化99%时,结构发生变化,Stokes半径增大,构象稳定性显著降低,盐酸胍对其变性程度增加;由于负电荷的增加,其自由能降低[10]。然而,也有人指出,溶菌酶琥珀酰化后二级结构变化与温度有关,室温下其二级结构与未酰化相似[13]。β-乳球蛋白(β-lg) 经过琥珀酰化修饰后色氨酸荧光强度下降,最大发射波长发生红移,盐酸胍和尿素实验显示其构象稳定性降低,三级结构变化;圆二色光谱(CD)实验显示,β-lg琥珀酰化后α-螺旋、β-折叠、β-转角3种有序结构含量降低,无规结构增加,二级结构发生变化[11]。
琥珀酰化修饰后,酪蛋白胶束结构被破坏,胶束解离程度随着酰化程度的增加而增加,粒径逐渐减小[3]。酰化修饰后,酪蛋白和牛血清蛋白的二级结构变化不显著,但三级结构变化,乳清蛋白二级结构由规则结构向无规结构转化[14]。大豆水解蛋白酰化修饰后内源荧光值降低,最大发射波长红移,CD测定结果显示折叠结构减少,转角和无规结构增加[6]。葵花籽蛋白琥珀酰化修饰后内源荧光值降低,最大发射波长红移,三级结构改变[15]。
β-lg经过琥珀酰化修饰后通过ANS荧光实验测得其疏水性降低[11]。酰化修饰后,酪蛋白、牛血清白蛋白、乳清蛋白表面疏水性增加[14]。也有研究指出,表面疏水性与酰化程度有关,当酰化程度为30%~40%时,琥珀酰化蚕豆蛋白表面疏水性几乎不变;当酰化程度为50%~80%时,表面疏水性降低[16]。大豆水解蛋白在酰化程度低于86.2%时,表面疏水性降低,之后升高,这与电荷密度的增加和蛋白质构象变化有关[6]。随着酰化程度的增加,油菜籽12S球蛋白的表面疏水性显著降低[8]。
综上所述,蛋白质琥珀酰化后荧光强度降低,最大发射波长红移,三级结构发生变化,二级结构具有由有序转变为无序的趋势,结构变化程度与蛋白质本身的结构及酰化程度有关。
4 琥珀酰化修饰对蛋白质功能特性的影响
经过琥珀酰化修饰后,由于琥珀酰基的引入,蛋白质电荷、结构发生变化,从而引起性质改变。
4.1 琥珀酰化修饰对蛋白质溶解性的影响
琥珀酰化使蛋白质负电荷增加,修饰肽段与水的相互作用增强,蛋白质的溶解性得以改善。然而,蛋白质的溶解性与pH密切相关。琥珀酰化修饰使蛋白质等电点以上溶解性增强,等电点以下有所降低,如扁豆蛋白[4]、黎豆蛋白[17]和巴西坚果核球蛋白[5]。琥珀酰化修饰后,在pH4~11范围内大豆水解蛋白的溶解性显著增加[7]。燕麦蛋白经过琥珀酰化(0.2∶1g/g蛋白质)修饰后,溶解性在pH为7时增加3.79倍[10]。琥珀酰化修饰使酪蛋白在pH 5和7时溶解性增加,而在pH9时基本不变[18]。
4.2 琥珀酰化修饰对蛋白质乳化性的影响
在油-水界面,蛋白质亲脂性基团在油相中定向排列,亲水性基团在水相中定向排列,从而降低界面张力,表现出乳化性[19]。蛋白质经过琥珀酰化修饰后,溶解性得到改善,促进了蛋白质在油滴表面形成蛋白层,可以更好地与水相作用以发挥乳化性[20]。另一方面,琥珀酰化使蛋白质构象变化,包埋于内部的疏水性基团暴露,增强了蛋白质与油相的相互作用。然而,由于琥珀酰化修饰增加了蛋白质的负电荷,使蛋白质之间的斥力增加,阻碍了蛋白质之间的相互作用,因而不易在油水相界面形成稳定性较高的蛋白质膜,从而影响乳化稳定性[21],例如,燕麦蛋白经过琥珀酰化(0.2∶1g/g蛋白质)修饰后,乳化性提高了3.85倍,乳化稳定性仅为酰化前的45%;蚕豆蛋白琥珀酰化后乳化活性显著提高[22]。
也有研究指出,琥珀酰化蛋白质的乳化性变化与蛋白质浓度及体系pH有关。扁豆蛋白在浓度为4%~6%时,琥珀酰化后乳化活性增加,而当浓度超出6%时乳化活性反而有所下降[4]。在pH为2时,扁豆蛋白乳化稳定性降低,在pH4~10时,由于蛋白质的溶解性显著增强,乳化稳定性增加[4]。巴西坚果核球蛋白的乳化活性和乳化稳定性经过琥珀酰化修饰后在pH 3时有所降低,在pH>3时均得到改善[5]。黎豆蛋白经琥珀酰化修饰后乳化活性和乳化稳定性在pH 4以上均得到改善[17]。
蛋白质经过琥珀酰化修饰后乳化性变化还与酰化程度有关。例如,酰化程度较低时,大豆水解蛋白的乳化活性降低,之后随着酰化程度的增加而增大;酰化后乳化稳定性显著增大[7]。
4.3 琥珀酰化修饰对蛋白质发泡性的影响
蛋白质发泡性受到诸多因素的影响,如溶解性、表面疏水性、电荷等。Mirmoghtadaie(等)指出,琥珀酰化修饰虽然增加了蛋白质的溶解性,有利于发泡性的改善,但是,由于蛋白质之间静电斥力的增加,又使发泡性得以降低,因此琥珀酰化修饰对发泡性影响不显著[21]。扁豆蛋白琥珀酰化后泡沫稳定性降低,除了pH 2以外,其他pH条件下发泡性均增强[4]。豆薯蛋白琥珀酰化后在不同pH下发泡性和泡沫稳定性均降低[23]。由于琥珀酰化修饰后表面疏水性增强,大豆水解蛋白的发泡性显著增加,且随着酰化程度增大而增强,但泡沫稳定性极差[7]。
4.4 琥珀酰化修饰对蛋白质吸水性和吸油性的影响
琥珀酰化修饰使蛋白质连接了带有负电荷的琥珀酰基,琥珀酰基与羧基间静电斥力增加,蛋白质结构展开,使其与水的相互作用增强,吸水性增加[24-26]。蛋白质的吸油性受到蛋白质含量、表面积、疏水性、电荷、形貌等诸多因素的影响,一般归结为物理诱捕。由于琥珀酰基占有一定空间体积,因而会使蛋白质体积增大,空隙增大,比表面积增大,因此吸油性增强[17,24,26-29]。燕麦蛋白经琥珀酰化(99%)修饰后吸水性和吸油性分别增加了3.46和1.29倍[21]。巴西坚果核球蛋白琥珀酰化修饰程度为55.8%时吸水性提高了2.04倍,吸油性提高了1.89倍;酰化程度为72%时吸水性提高了2.15倍,吸油性提高了2.04倍[5]。可见,琥珀酰化后蛋白质的吸水性和吸油性增强。
蛋白质琥珀酰化后吸水性与吸油性的变化还与酰化程度有关。随着酰化程度的增加,蛋白质的吸水性增强[5,30]。然而,El-Adawy研究绿豆蛋白时指出,吸水性随酰化程度呈现降低趋势[26]。Bora研究扁豆蛋白发现,酰化程度对吸水性不产生影响[25]。坚果核球蛋白[5]、烟草蛋白[28]吸油性随酰化程度的增大而增加,而油菜籽蛋白[27]、大豆水解蛋白[7]吸油性随着酰化程度的增加而降低。
由此可见,由于不同蛋白质具有不同结构,琥珀酰化修饰后其吸水性和吸油性改变程度不同。
4.5 琥珀酰化修饰对蛋白质凝胶性的影响
由于琥珀酰化修饰增加了蛋白质的净负电荷,因而对其凝胶性影响显著。研究指出,琥珀酰化修饰使酪蛋白的凝胶性遭到破坏[31],延长了酪蛋白的凝胶时间,降低了凝胶强度[2]。
5 展望
综上所述,琥珀酰化修饰可使蛋白质负电荷增加,结构发生变化,从而使其功能性质显著改善,其变化程度与琥珀酰化程度有关。众多研究一致认为,蛋白质琥珀酰化修饰后等电点以上溶解性增强,有利于蛋白质功能性质在水溶液中的充分发挥。食品蛋白质通常是食品中的主要成分,在食品加工过程中经受高温处理、酸度变化、高压均质等加工过程。然而,迄今为止,琥珀酰化修饰后的蛋白质在加工过程中的稳定性,如热稳定性、高压稳定性,及其与加工体系中的其他物质之间的相互作用尚不明确,有待进一步研究。
[1]赵新淮,徐红华,姜毓君. 食品蛋白质-结构、性质与功能[M]. 北京:科学出版社,2009.
[2]Vidal V,Marchesseau S,Lagaude A,et al. Influence of chemical agents on casein interactions in dairy products:chemical modification of milk proteins[J]. Colloids and Surfaces B:Biointerfaces,1998,12(1):7-14.
[3]Vidal V,Marchesseau S,Cuq JL. Physicochemical Properties of Acylated Casein Micelles in Milk[J]. Journal of Food Science,2002,67(1):42-47.
[4]Lawal OS. Functionality of native and succinylated Lablab bean(Lablab purpureus)protein concentrate[J]. Food Hydrocolloids,2005,19(1):63-72.
[5]Ramos CMP,Bora PS. Functionality of Succinylated Brazil Nut(Bertholletia excelsa HBK)Kernel Globulin[J]. Plant Foods for Human Nutrition,2005,60(1):1-6.
[6]Achouri A,Zhang W. Effect of succinylation on the physicochemical properties of soy protein hydrolysate[J]. Food Research International,2001,34(6):507-514.
[7]Achouri A,Zhang W,Shiying X. Enzymatic hydrolysis of soy protein isolate and effect of succinylation on the functional properties of resulting protein hydrolysates[J]. Food Research International,1998,31(9),617-623.
[8]Gruener L,Ismond MAH. Effects of acetylation and succinylation on the physicochemical properties of the canola 12S globulin[J]. Part I Food Chemistry,1997,60(3):357-363.
[9]Hamada M,Nagai T,Kai N,et al. Influence of added amounts of succinic anhydride on the succinylation level for some proteins[J]. Journal of National Fisheries University,1999,46(2),95-99.
[10]Ong HN,Arumugam B,Tayyab S. Succinylation-induced conformational destabilization of lysozyme as studied by guanidine hydrochloride denaturation[J]. J Biochem,2009,146(6):895-904.
[11]Chakraborty J,Das N,Das KP,et al. Loss of structural integrity and hydrophobic ligand binding capacity of acetylated and succinylated bovine β-lactoglobulin[J]. International Dairy Journal,2009,19(1):43-49.
[12]杨敏,梁琪,杨继涛,等. 牦牛乳酪蛋白胶束琥珀酰化修饰研究[J].食品工业科技,2013,34(15):200-204.
[13]van der Veen M,Norde W,Stuart M C. Electrostatic interactions in protein adsorption probed by comparing lysozyme and succinylated lysozyme[J]. Colloids Surf B Biointerfaces,2004,35(1):33-40.
[14]Lakkis J,Villota R. Effect of acylation on substructural properties of proteins:a study using fluorescence and circular dichroism[J]. J Agric Food Chem,1992,40(4):553-560.
[15]Venktesh A,Praka V. Total proteins and 11s protein fraction(Helianthinin)of sunflower seed(Helianthus annuus L.)Effect of acetylation and succinylation[J]. Nahrung,1994,38(4):359-368.
[16]Knopfe C,Schwenke KD,Mothes R,et al. Acetylation and succinylation of faba bean legumin:Modification of hydrophobicity and conformation[J]. Nahrung/Food,1998,42(3-4):194-196.
[17]Lawal OS,Adebowale KO. Effect of acetylation and succinylation on solubility profile,water absorption capacity,oil absorption capacity and emulsifying properties of mucuna bean(Mucuna pruriens)protein concentrate[J]. Nahrung/Food,2004,48(2):129-136.
[18]Santos CV,Tomasula PM. Acylation and Solubility of Casein Precipitated by Carbon Dioxide[J]. Journal of Food Science,2000,65(2):227-230.
[19]Lawal OS,Adebowale KO,Adebowale YA. Functional properties of native and chemically modified protein concentrates from bambarra groundnut[J]. Food research international,2007,40(8),1003-1011.
[20]Ponnampalam R,Delisle J,Gagne Y,et al. Functional and nutritional properties of acylated rapeseed proteins[J]. Journal of the American Oil Chemists Society,1990,67(8):531-535.
[21]Mirmoghtadaie L,Kadivar M,Shahedi M. Effects of succinylation and deamidation on functional properties of oat protein isolate[J]. Food Chemistry,2009,114(1):127-131.
[22]Krause JP,Krfigel J,Schwenke KD. Properties of interfacial films formed by succinylated legumin from faba beans(VieiafabaL.)[J]. Colloids Surfaces B:Biointerfaces,1997,8(6):279-286.
[23]Arogundade L A,Eromosele C O,Eromosele I C,et al. Effect of glycosylation via maillard reaction and acylation on African yam bean(Sphenostylis stenocarpa)protein functionality[J]. Food Science and Biotechnology,2013,22(4):951-960.
[24]Zaghloul M,Prakash V. Effect of succinylation on the functional and physicochemical properties of a-globulin,the major protein fraction from Sesamum indicum L[J]. Nahrung/Food,2002,46(5):364-369.
[25]Bora PS. Functional properties of native and succinylated lentil(Lens culinaris)globulins[J]. Food Chemistry,2002,77(2):171-176.
[26]El-Adawy TA. Functional properties and nutritional quality of acetylated and succinylated mung bean protein isolate[J]. Food Chemistry,2000,70(1):83-91.
[27]Dua S,Mahajan A,Mahajan A. Improvement of functional properties of rapeseed(Brassica campestris Var. Toria)preparations by chemical modification[J]. Journal of agricultural and food chemistry,1996,44(3):706-710.
[28]Monteiro PV,Prakash V. Alteration of functional properties of peanut(ArchishipogaeaL.)protein fractions by chemical and enzymatic modification[J]. J Food Sci Technol(India),1996,33:19-26.
[29]Sheen SJ. Effect of succinylation on molecular and functional properties of soluble tobacco leaf proteins[J]. Journal of agricultural and food chemistry,1991,39(6):1070-1074.
[30]Ponnampalam R,Goulet G,Amiot J,et al. Some functional properties of acetylated and succinylated oat protein concentrates and a blend of succinylated oat protein and whey protein concentrates[J]. Food chemistry,1988,29(2):109-118.
[31]Lieske B,Konrad G,Faber W. Effect of succinylation on the renneting properties of raw milk[J]. Milchwissenschaft,2000,55(2):71-74.
Review on succinylated modification of food proteins
YANG Min,YANG Ji-tao,YAN Xi,ZHANG Yuan
(College of Science,Gansu Agricultural University,Lanzhou 730070,China)
Succinylation is one of the modification method of protein,which increase the net charge of protein and change its structure,resulting in improvement of its functional properties. In this paper,the reaction condition,level of succinylation and change of functional properties of protein were reviewed. It would provide the references for protein modification.
protein;succinic anhydride;succinylated modification;functional properties
2014-06-10
杨敏(1981-),女,在读博士,讲师,研究方向:乳品科学与技术。
TS201.2
A
1002-0306(2015)05-0396-04
10.13386/j.issn1002-0306.2015.05.076

