猪APOBEC3F基因真核表达载体的构建及其在MARC145细胞中的表达定位
孟春花, 王春玲, 李静心, 李隐侠, 朱前明, 曹少先
(1.江苏省农业科学院畜牧研究所,江苏 南京 210014;2.江苏省农业科学院动物品种改良与繁育重点实验室,江苏 南京210014;3.南京农业大学动物科技学院,江苏 南京 210095)
载脂蛋白B mRNA编辑酶催化多肽3F(Apolipoprotein B mRNA-editing enzyme cayalytic polypeptide 3F,APOBEC3F)属于细胞胞嘧啶脱氨酶家族的重要成员,为固有免疫系统中的一个重要蛋白,包括APOBEC1、APOBEC2、APOBEC3A~APOBEC3G以及AID(活化诱导脱氨酶)等11个成员[1-2]。近年来的研究发现APOBEC家族蛋白对包括人免疫缺陷病毒(Human immunodeficiency virus,HIV)[2-4]、泡沫病毒(Foamy virus,PFV)、乙型肝炎病毒(Hepatitis B virus,HBV)[5]等多种病毒具有抑制或超突变作用,是具有广谱抗病毒活性的天然免疫分子[1-6]。APOBEC3F对病毒复制的抑制作用可以利用其胞嘧啶脱氨基酶活性,通过DNA、RNA编辑途径和非编辑途径将HIV、HBV复制过程中cDNA或RNA上的胞嘧啶(C)突变为尿嘧啶(U),也可使5′甲基胞嘧啶(5′mC)转化为5′甲基尿嘧啶(5′mU),引起从G到A的超突变,从而产生大量致死突变,如色氨酸密码子TGG突变为终止子TAA,降低病毒的复制效率[7-9]。但APOBEC3F是否在猪体内具有抗病毒作用未见报道。
猪繁殖与呼吸综合征(PRRS)俗称“猪蓝耳病”,由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染引发,已在全世界范围内引起养猪业的巨大经济损失[10]。PRRSV的增殖对细胞有严格的选择性,MARC145细胞是猴胚胎肾上皮细胞,近年来常用于体外增殖PRRSV。本研究拟构建含增强型绿色荧光蛋白(Enhanced green fluorescence protein,GFP)的真核表达载体pEGFP-APOBEC3F,并转染MARC145细胞,检测APOBEC3F蛋白在MARC145细胞中的表达、定位,为体外研究APOBEC3F对PRRSV的作用奠定基础。
1 材料与方法
1.1 载体和细胞
MARC145细胞、大肠杆菌菌株Top10为本实验室保存,pEGFP-CMV载体(图1)由本实验室构建; MARC145细胞培养条件为:DMEM培养液添加10%胎牛血清和100 mmol/L的谷氨酰胺,胰蛋白酶消化传代。

图1 pEGFP-CMV质粒图谱Fig.1 The profile of plasmic pEGFP-CMV
1.2 主要试剂
DMEM液体培养基、Trypsin/EDTA、胎牛血清、Opti-MEM、LipofectaminTMLTX Reagent、PLUSTMReagent、Trizol等试剂购自Invitrogen公司,DMSO为Sigma公司产品,M-MLV Reverse Transcription反转录酶购自Promega公司,各种限制性内切酶和PrimeSTAR®HS DNA Ploymerase购自TaKaRa大连宝生物工程有限公司,快速胶回收试剂盒、质粒DNA提取试剂盒购自南京卡罗登生物科技有限公司,其余试剂均为国产分析纯。
1.3 APOBEC3F基因的克隆
取-80℃保存的二花脸猪脾脏,Trizol法提取猪脾脏组织总RNA,M-MLV反转录获得cDNA。根据GenBank中猪APOBEC3F cDNA序列(DQ974647.1),利用Primer Premier 5.0软件辅助设计引物,扩增猪APOBEC3F cDNA。引物序列如下:上游引物5′-GG AGATCTGGGCTCTTCCTACATGG-3′(下划线部分为BglⅡ酶切位点);下游引物5′-GTCGACGGAACTGTCTGTCATCTCGA-3′(下划线部分为SalⅠ酶切位点),由上海英潍捷基生物公司合成。
PCR反应体系为20.0 μl,包括5×Primer star缓冲液4.0 μl,dNTP mix 1.6 μl,上下游引物(10 μmol/L)各0.5μl,cDNA模板2.0 μl,Primer star聚合酶(5 U/μl)0.2 μl,以及ddH2O 11.2 μl。反应程序:98℃10 s,59℃退火5 s,72℃延伸80 s,共40个循环;72℃延伸10 min。目的片段大小约1 350 bp。扩增产物用1%琼脂糖凝胶电泳检测,参照卡罗登DNA纯化回收试剂盒说明书回收PCR产物,所得PCR产物用T4 DNA连接酶与pMD19-T载体连接为pMD-APOBEC3F,然后,将连接产物转化Escherichia coli DH5α感受态细胞后,在含有氨苄青霉素抗性的平板培养基上培养,挑取阳性克隆菌落摇菌。提取质粒,经PCR鉴定后,阳性克隆菌液送上海美吉生物科技有限公司测序。
1.4 APOBEC3F表达载体构建
将pEGFP-CMV载体和测序验证后的pMD-APOBEC3F分别用BglⅡ和SalⅠ双酶切,琼脂糖凝胶电泳后回收目的片段DNA。将回收的片段用T4 DNA Ligase连接后转化至大肠杆菌中,取转化好的菌液铺板在含氨苄青霉素的LB平板上,于37℃静置培养12 h左右,挑取单克隆,培养菌液提取质粒,用BglⅡ和SalⅠ双酶切鉴定。鉴定正确的克隆送上海美吉生物医药科技有限公司测序,命名为 pEGFP-APOBEC3F。
1.5 重组质粒转染及转染细胞的观察
MARC145细胞接种至24孔培养板,于37℃、5%CO2、饱和湿度条件下培养18~24 h,细胞汇合至80%左右时,用脂质体LTX介导pEGFP-APOBEC3F,pEGFP-CMV转染MARC145细胞,对照组细胞不转染质粒,荧光显微镜下观察转染结果[11]。
1.6 APOBEC3F基因表达水平的Q-PCR检测
分别于转染后12 h、24 h、48 h和72 h收集pEGFP-APOBEC3F、pEGFP-CMV转染组及对照组的MARC145细胞,Trizol法提取总RNA。DNase I处理后,参照TaKaRa公司试剂盒说明书反转录获得cDNA,设计合成APOBEC3F基因的Q-PCR检测引物:上游引物5′-CGGAACCGCTCCTACATC-3′;下游引物5′-GGAACTGAGCCACCTTCG-3′。实时荧光定量PCR参照TaKaRa大连宝生物公司的SYBR Green试剂盒说明书进行,反应体系为20.0 μl,包括SYBR Green Mix 10.0 μl,上、下游引物(10 μmol/L)各0.8 μl,cDNA模板2.0 μl,ROX 0.4 μl,以及ddH2O 6.0 μl。反应程序:95℃30 s,95℃5 s,60℃34 s,共40个循环。数据通过7500 Software v 2.0.5软件分析。
1.7 APOBEC3F蛋白的细胞免疫化学检测
吸去MARC145细胞培养液,用预冷的4%多聚甲醛固定细胞15 min,用0.2%TritonX-100处理10~15 min,然后用1%BSA封闭1 h,加入兔来源单克隆抗APOBEC3F抗体(1∶100倍稀释)于4℃孵育过夜;HRP标记山羊抗兔IgG(1∶100倍稀释),37℃孵育1 h;室温下DAB显色0.5~3.0 min,在光学显微镜下观察,棕色为APOBEC3F阳性区域。
1.8 统计分析
使用SPSS17.0统计软件one-way ANOVA进行显著性分析。
2 结果
2.1 APOBEC3F基因的克隆
APOBEC3F基因PCR产物经琼脂糖凝胶电泳显示约1 300 bp(图1),大小与预期相符合。
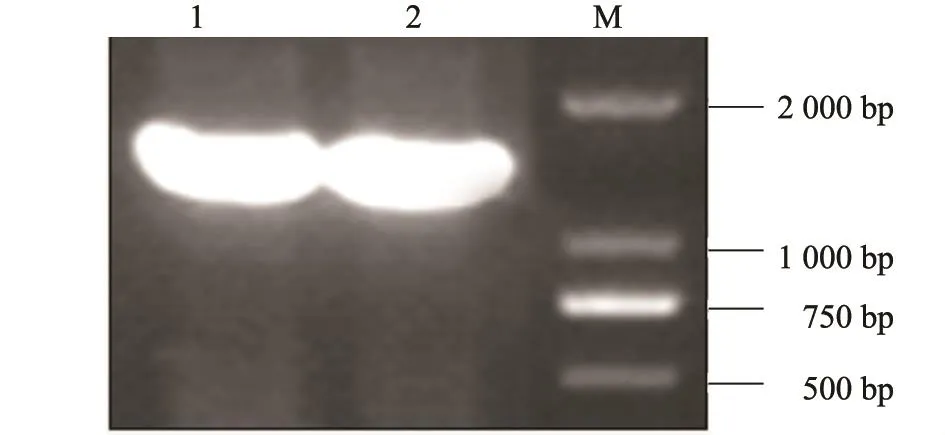
图1 APOBEC3F基因的PCR扩增Fig.1 Amplification of APOBEC3F gene by PCR
2.2 pMD-APOBEC3F质粒的鉴定和测序
扩增后的APOBEC3F片段与pMD19-T载体连接后转化大肠杆菌DH5α,从抗性平皿上挑取阳性菌落,经PCR鉴定为阳性的菌液(图2)送上海美吉生物公司测序。经测序分析,获得的APOBEC3F序列与参考序列一致。
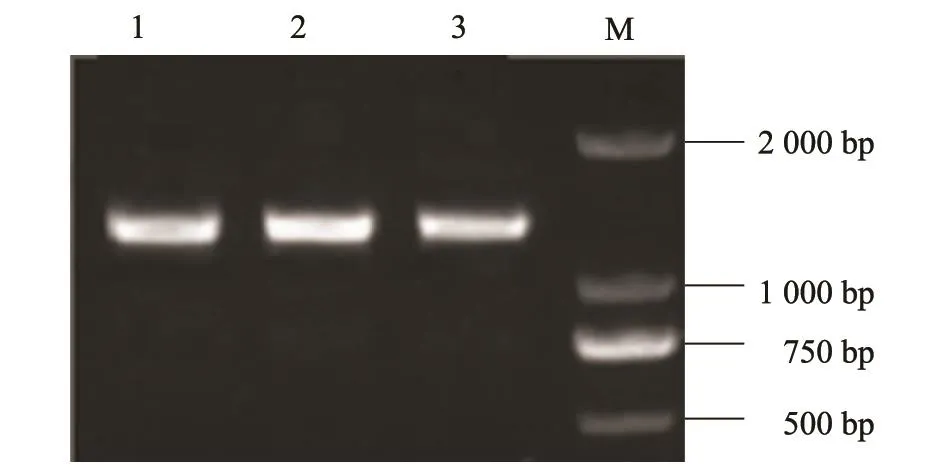
图2 pMD-APOBEC3F质粒的PCR鉴定Fig.2 Identification of plasmid pMD-APOBEC3F by PCR
2.3 pEGFP-APOBEC3F的酶切鉴定及测序
对阳性质粒用BglⅡ和SalⅠ进行酶切鉴定,可得到2个片段(图3),片段大小与预计相符。经测序,获得的APOBEC3F序列与参考序列一致。
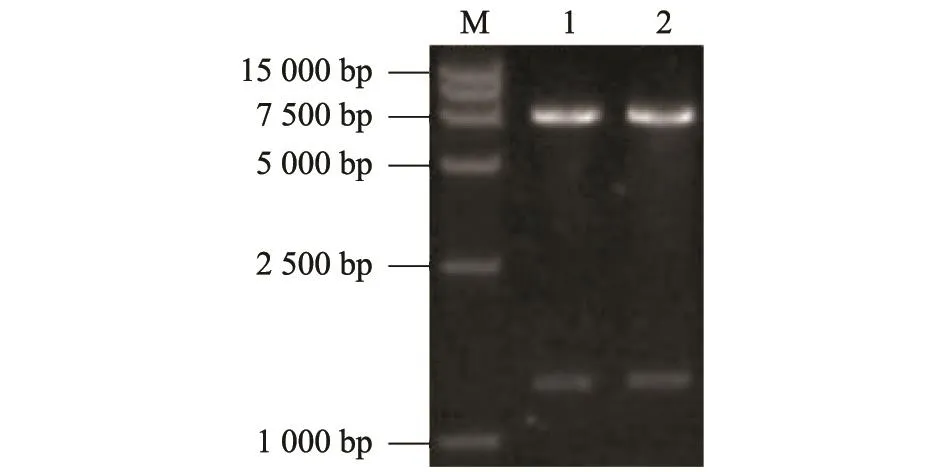
图3 pEGFP-APOBEC3F的酶切鉴定Fig.3 Identification of plasmid pEGFP-APOBEC3F by restriction endonucleaes digestion
2.4 pEGFP-APOBEC3F在MARC145中的转染效率
荧光显微镜下观察到MARC145细胞转染pEGFP-APOBEC3F和pEGFP-CMV 24 h后有绿色荧光(图4A),对照组细胞未见绿色荧光(图4B)。转染后48 h pEGFP-APOBEC3F组转染效率为82.9%,略低于pEGFP-CMV转染组(84.4%),两组差异不明显。
2.5 APOBEC3F在MARC145细胞中的表达水平变化
Q-PCR结果显示,MARC145细胞中APOBEC3F mRNA水平在pEGFP-APOBEC3F转染后24 h达到最高,随后呈下降趋势;转染空载体pEGFP-CMV组和未转染阴性对照组中APOBEC3F cDNA的表达水平极显著低于转染pEGFP-APOBEC3F组(P<0.01)。

图4 pEGFP-APOBEC3F质粒转染MARC145细胞Fig.4 Transfection ofplasmid pEGFP-APOBEC3F in MARC145 cells
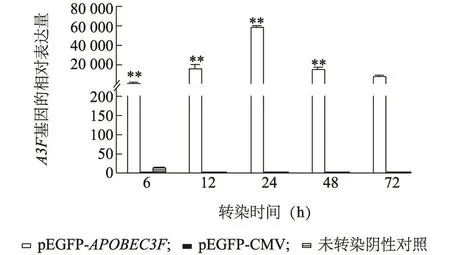
图5 APOBEC3F基因在MARC145细胞中的表达Fig.5 Expression of APOBEC3F gene in MARC145 cells
2.6 APOBEC3F蛋白在MARC145中的表达、定位
细胞免疫化学检测表明,pEGFP-APOBEC3F转染组MARC145细胞中APOBEC3F蛋白主要在细胞质中表达,pEGFP-CMV转染组MARC145细胞中未发现APOBEC3F蛋白的表达(图6)。
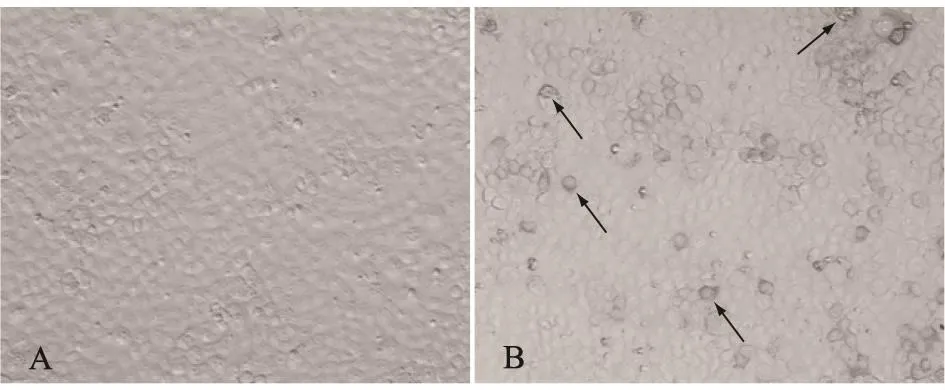
图6 APOBEC3F蛋白在MARC145中的表达定位Fig.6 Cellular localization of APOBEC3F in MARC145 cells
3 讨论
APOBEC3F具有广谱的抗病毒活性,可有效抑制HIV、HBV、PREV等病毒的复制,在宿主抗病毒天然免疫应答中发挥着重要作用,因此受到广泛关注[1-6,12-17]。APOBEC3F含N端模体脱氨基作用较弱,主要与APOBEC分子衣壳化、RNA结合及二聚体的形成有关,C端脱氨基模体是其发挥脱氨基作用的主要活性区域,但两者都是发挥脱氨基功能必不可少的部分[18-20]。APOBEC3F的作用机制是通过gag蛋白[19]、病毒RNA[20]、细胞RNA[21]的媒介进入成熟病毒粒子的核心,并在随后感染的靶细胞中使新合成的负链cDNA发生C→T突变,从而导致新合成的DNA降解或产生大量致死性的G→A突变来抑制病毒的复制与感染[22-25]。
猪繁殖与呼吸综合征病毒(PRRSV)是传染性极强的的反义正链RNA病毒,可以造成仔猪死亡和妊娠母猪流产及死胎、木乃伊胎。目前,PRRS的防控尚无理想方法,因为PRRSV灭活疫苗免疫后不能产生足够的保护抗体,弱毒活疫苗也只能保护同种毒株的感染,而PRRSV变异很快。宿主自身免疫能力对该病毒的复制具有重要抑制作用,因此筛选抗PRRSV能力强的个体进行抗性选育是PRRS防控的重要途径,可以从根源上解决PRRS防控难的问题。我们的前期研究结果表明:APOBEC3F的外显子8及内含子6的SNP与猪抗PRRS的能力显著相关,提示APOBEC3F可能与猪对PRRSV的易感性/抗性相关[26]。MARC145细胞是PRRSV在猪体外增殖的常用细胞系,本研究成功构建了APOBEC3F的真核表达载体并研究了其在MARC145细胞中的表达,对研究APOBEC3F对PRRSV的作用,以及探索猪PRRSV抗性差异的机制和抗PRRSV猪的选育具有重要意义。
Jonsson[16]的研究发现偶蹄动物牛、羊和猪APOBEC3F主要定位在细胞质,并能抑制HIV-1和MLV的 复 制。本 研 究 中,APOBEC3F转 染MARC145细胞后也主要在细胞质中表达,这与Jonsson等的研究结果一致。本研究中使用脂质体介导法将外源DNA导入真核细胞,是一种常用的表达外源基因的方法,这种方法具有结果可靠、重复性好、便于操作等特点,而且所携带的DNA片段大小不受限制[27]。本研究中采用的脂质体介导转染贴壁细胞系MARC145细胞的条件为本实验室建立的成熟体系[11],在该体系中pEGFP-APOBEC3F的转染效率达到82.9%,且基本没有细胞因为转染死亡,而电穿孔法转染后细胞死亡率较高,病毒介导转染法存在安全风险[11]。
[1] LEE J,CHOI J Y,LEE H J,et al.Repression of porcine endogenous retrovirus infection by human APOBEC3 proteins[J].Biochem Biophys Res Commun,2011,407(1):266-270.
[2] HARRIS R S,DUDLEY J P.APOBECs and virus restriction[J].Virology,2015,479-480C:131-145.
[3] ZHENG Y H,DAN I,TAKESHI K,et al.Human APOBEC3F is another host factor that blocks human immunodeficiency virus type 1 replication[J].J Virol,2004,78(11):6073-6076.
[4] LAND A M,SHABAN N M,EVANS L,et al.APOBEC3F determinants of HIV-1 Vif sensitivity[J].J Virol,2014,88(21): 12923-12927.
[5] SUSPENE R,GUETARD D,HENRY M,et al.Extensive editing of both hepatitis B virus DNA strands by APOBEC3 cytidine deaminases in vitro and in vivo[J].Proc Natl Acad Sci USA,2005,102(23):8321-8326.
[6] FRANCA R,SPADARI S,MAGA G.APOBEC deaminases as cellular antiviral factors:a novel natural host defense mechanism[J].Med Sci Monit,2006,12(5):RA92-98.
[7] MANGEAT B,TURELLI P,CARON G,et al.Broad antiretroviral defence by human APOBEC3G through lethal editing of nascent reverse transcripts[J].Nature,2003,424(6944):99-103.
[8] BISHOP K N,HOLMES R K,SHEEHY A M,et al.APOBEC-mediated editing of viral RNA[J].Science,2004,305(5684): 645.
[9] WIJESINGHE P,BHAGWAT A S.Efficient deamination of 5-methylcytosines in DNA by human APOBEC3A,but not by AID or APOBEC3G[J].Nucleic Acids Res,2012,40 (18):9206-9217.
[10]NIEUWENHUIS N,DUINHOF T F,VANNES A.Economic analysis of outbreaks of porcine reproductive and respiratory syndrome virus in nine sow herds[J].Vet Rec,2012,170 (9):225.
[11]丰秀静,曹少先,孟春花,等.脂质体LTX介导高效转染山羊胎儿成纤维细胞(gFFCs)条件的优化[J].江苏农业学报,2011,27(3):561-565.
[12]HULTQUIST J F,LENGYEL J A,REFSLAND E W,et al.Human and rhesus APOBEC3D,APOBEC3F,APOBEC3G,and APOBEC3H demonstrate a conserved capacity to restrict Vif-deficient HIV-1[J].J Virol,2011,85(21):11220-11234.
[13]XIANG S L,MA Y,YAN Q,et al.Construction and characterization of an infectious replication competent clone of porcine en-dogenous retrovirus from Chinese miniature pigs[J].Virol J,2013,10:228.
[14]HARRIS R S,BISHOP K N,SHEEHY A M,et al.DNA deamination mediates innateimmunity to retroviral infection[J].Cell,2003,113(6):803-809.
[15]ZHENG Y H,IRWIN D,KUROSU T,et al.Human APOBEC3F is another host factor that blocks human immunodeficiency virus type 1 replication[J].J Virol,2004,78(11):6073-6076.
[16]JONSSON S R,HACHE G,STENGLEIN M D,et al.Evolutiona ry conserved and non-conserved retrovirus restriction activities of artiodactyl APOBEC3F proteins[J].Nucleic Acids Res,2006,34(19):5683-5694.
[17]REBECCA K H,FRANSJE A K,KATE N B,et al.APOBEC3F can inhibit the accumulation of HIV-1 reverse transcription products in the absence of hypermutation[J].J Biol Chem,2007,282(4):2587-2595.
[18]HACHE G,LIDDAMENT M T,HARRIS R S.The retroviral hypermutation specificity of APOBEC3F and APOBEC3G is governed by the C-terminal DNA cytosine deaminase domain[J].J Biol Chem,2005,280(12):10920-10924.
[19]CEN S,GUO F,NIU M,et al.The interaction between HIV-1 gag and APOBEC3G[J].J Biol Chem,2004,279(32):33177-33184.
[20]LUO K,LIU B,XIAO Z,et al.Amino-terminal region of the human immuno-deficiency virus type 1 nucleocapsid is required for human APOBEC3G packaging[J].J Virol,2004,78(21): 11841-11852.
[21]IWATANI Y,TAKEUCHI H,STREBEL K,et al.Biochemical activities of highly purified,catalytically active human APOBEC3G:correlation with antiviral effect[J].J Virol,2006,80 (12):5992-6002.
[22]WANG T,ZHANG W,TIAN C,et al.Distinct viral determinants for the packaging of human cytidine deaminases APOBEC3G and APOBEC3C[J].Virology,2008,377(1):71-79.
[23]HARRIS R S,LIDDAMENT M T.Retroviral restriction by APOBEC proteins[J].Nat Rev Immunol,2004,4(11):868-877.
[24]LACKEY L,LAW E K,BROWN W L,et al.Subcellular localization of the APOBEC3 proteins during mitosis and implications for genomic DNA deamination[J].Cell Cycle,2013,2(5): 762-772.
[25]SONG C,SUTTON L,JOHNSON M E,et al.Signals in APOBEC3F N-terminal and C-terminal deaminase domains each contribute to encapsidation in HIV-1 virions and are both required for HIV-1 restriction[J].J Biol Chem,2012,287(20): 16965-16974.
[26]朱前明,孟春花,茆达干,等.猪APOBEC3F基因外显子8单核苷酸的多态性及其与猪繁殖和呼吸综合征病毒易感性的关联性[J].江苏农业学报,2014,10(5):1051-1057.
[27]李 扬,吴凯峰,郭旭东,等.脂质体介导外源基因体外转染牛胎儿成纤维细胞条件的优化[J].遗传,2002,24(6): 653-655.

