胰腺癌组织COX-2、VEGF、MMP-9的表达及塞来布昔对人胰腺癌BXPC-3细胞VEGF、MMP-9表达的影响
苏春永 霍华治 杨晓光
胰腺癌是常见的消化道恶性肿瘤,该病恶性度极高,早期侵袭和转移率高,病情进展快,预后严重不良[1]。因此,从肿瘤过度增殖、侵袭和转移的分子机制角度寻找有效的阻断靶点对于胰腺癌的临床治疗具有重要指导意义。环氧合酶-2(COX-2)是花生四烯酸代谢过程中的限速酶之一,在细胞有丝分裂、细胞粘附、疼痛发生发展等病生理过程中发挥重要调控作用。研究表明,胃癌、结肠癌、乳腺癌等恶性肿瘤组织高表达COX-2,参与肿瘤发生、发展、侵袭和转移等多个环节,且与患者预后及存活时间高度相关[2]。最新研究发现,选择性COX-2抑制剂塞来布昔通过抑制恶性肿瘤细胞的增殖、侵袭和转移发挥明显的抗肿瘤作用[3,4]。然而,塞来布昔是否通过抑制血管内皮生长因子(VEGF)、基质金属蛋白酶-9(MMP-9)的表达发挥抗肿瘤作用的报道笔者所见目前尚少。本研究观察胰腺癌组织 COX-2、VEGF、MMP-9的表达状况,并通过体外实验检测VEGF、MMP-9 mRNA和蛋白表达的变化探讨塞来布昔的抗肿瘤机制。
1 资料与方法
1.1 一般资料 选取2009年9月至2011年3月我院手术切除的原发性胰腺导管腺癌组织标本50例,均经病理确诊,临床病理资料及随访资料完整。其中男30例,女20例;年龄29~67岁,平均年龄(50±7)岁;病程1~9年,平均(3.2±0.5)年。
1.2 主要试剂 胰腺癌BXPC-3细胞购自上海中科院细胞库。兔抗人COX-2、VEGF、MMP-9多克隆抗体购自美国Santa Cruz公司。Trizol、Real Time-PCR试剂盒购自美国Promega公司。免疫组化SP试剂盒购自北京中杉金桥技术有限公司。
1.3 实验方法
1.3.1 免疫组织化学SP法:采用免疫组化法检测胰腺组织COX-2、VEGF、MMP-9蛋白表达水平,参照说明书操作。将手术切除的癌组织及癌旁正常组织置于4%多聚甲醛中固定,依次进行脱蜡、水化、高压锅热修复后加入特异性一抗4℃过夜;加入生物素标记的二抗,室温孵育1 h;加入辣根过氧化物酶(HRP)标记的三抗室温孵育45 min,DAB显色,苏木素染色,封片,光镜观察。结果判定标准:COX-2、VEGF、MMP-9阳性染色的判定以细胞膜(质)中检出棕黄色或深棕色颗粒为标准。随机选取5个有代表性的视野进行观察并计数200个细胞,若阳性细胞数占同类细胞数的比例>5%为阳性,≤5%则为阴性。
1.3.2 细胞培养:在37℃、5%CO2孵箱中用含10%小牛血清的DMEM培养基常规培养BXPC-3细胞。将细胞随机分为对照组和塞来布昔低、中、高剂量组(终浓度分别为 25、50、100 μmol/L)。
1.3.3 Real Time-PCR(qPCR):采用 qPCR 方法检测胰腺癌BXPC-3细胞VEGF、MMP-9 mRNA表达水平,参照说明书操作。Gene Bank网站获取VEGF、MMP-9基因序列,使用Primer Premier 5.0软件设计引物,由上海生工生物工程有限公司合成。Trizol提取组织总RNA,将2.0 μg总RNA 用于后续的Real Time-PCR反应。PCR扩增完毕后,以GAPDH为内参照基因,目的基因VEGF、MMP-9表达的相对定量值(RQ值)用于统计分析。见表1。
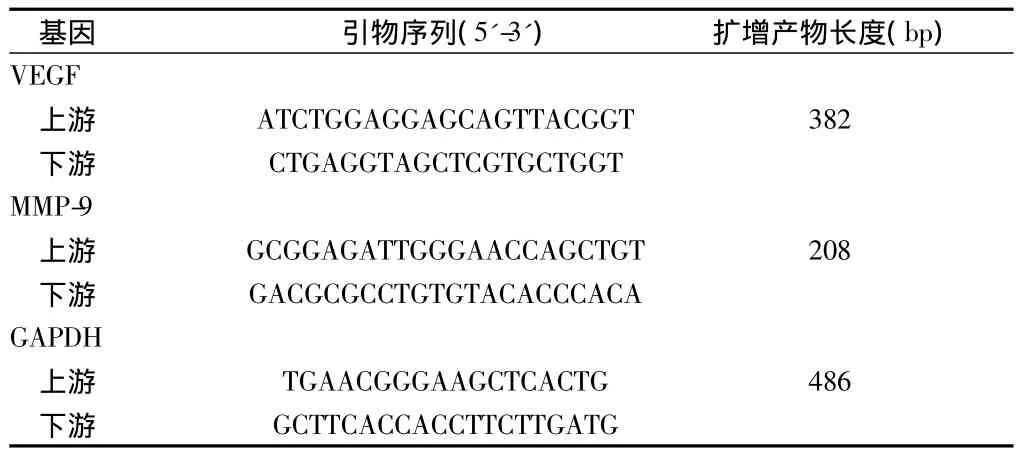
表1 引物序列及扩增产物长度
1.3.4 Western blot:收集并提取细胞总蛋白,BCA 法定量蛋白后进行 SDS-聚丙酰胺凝胶电泳,电转移至PVDF膜上,5%脱脂奶粉封闭2 h,特异性一抗4℃孵育过夜,IgG二抗孵育2 h,ECL显色。采用UVP分析软件对目的条带及内参照条带做灰度值分析。
1.4 统计学分析 应用SPSS 10.0统计软件,计量资料以表示,采用t检验,计数资料采用χ2检验,相关性采用Sperman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 胰腺癌组织 COX-2、VEGF、MMP-9的表达 胰腺癌组织 COX-2、VEGF、MMP-9表达均为阳性,阳性表达率分别为 72.00%(36/50)、78.00%(39/50)、74.00%(37/50),与癌旁组织 6.00%(3/50)、8.00%(4/50)、6.00%(3/50)的阳性表达率比较,差异有统计学意义(P<0.05)。见表2。

表2 胰腺癌组织、癌旁组织COX-2、VEGF、MMP-9表达的比较n=50,例(%)
2.2 COX-2、VEGF、MMP-9 蛋白表达与胰腺癌临床病理特征的关系 免疫组化结果显示,COX-2、VEGF、MMP-9在低增殖活性组和高增殖活性组的阳性表达率分别为 38.46%(5/13)、23.08%(3/13)、30.77%(4/13)和 83.78%(31/37)、89.19%(33/37)、86.49%(32/37),差异有统计学意义(P< 0.05);COX-2、VEGF、MMP-9在TNM分期Ⅰ~Ⅱ期组和Ⅲ~Ⅳ组的阳性表达率分别为 45.00%(9/20)、40.00%(8/20)、35.00%(7/20)和 90.00%(27/30)、93.33%(28/30)、96.67%(29/30),差异有统计学意义(P<0.05);COX-2、VEGF、MMP-9 在有远处转移和无转移的阳性表达率分别为 90.32%(28/31)、93.55%(29/31)、96.77%(30/31)和 42.11%(8/19)、36.84%(7/19)、31.58%(6/19),差异有统计学意义(P<0.05)。COX-2、VEGF、MMP-9 蛋白表达均与胰腺癌患者的年龄、性别、肿瘤位置、病理分级无关(P>0.05)。见表3。
2.3 相关性分析 Sperman相关分析显示,胰腺癌组织COX-2与 VEGF、MMP-9表达均呈正相关(r=0.597、0.623,P<0.05)。
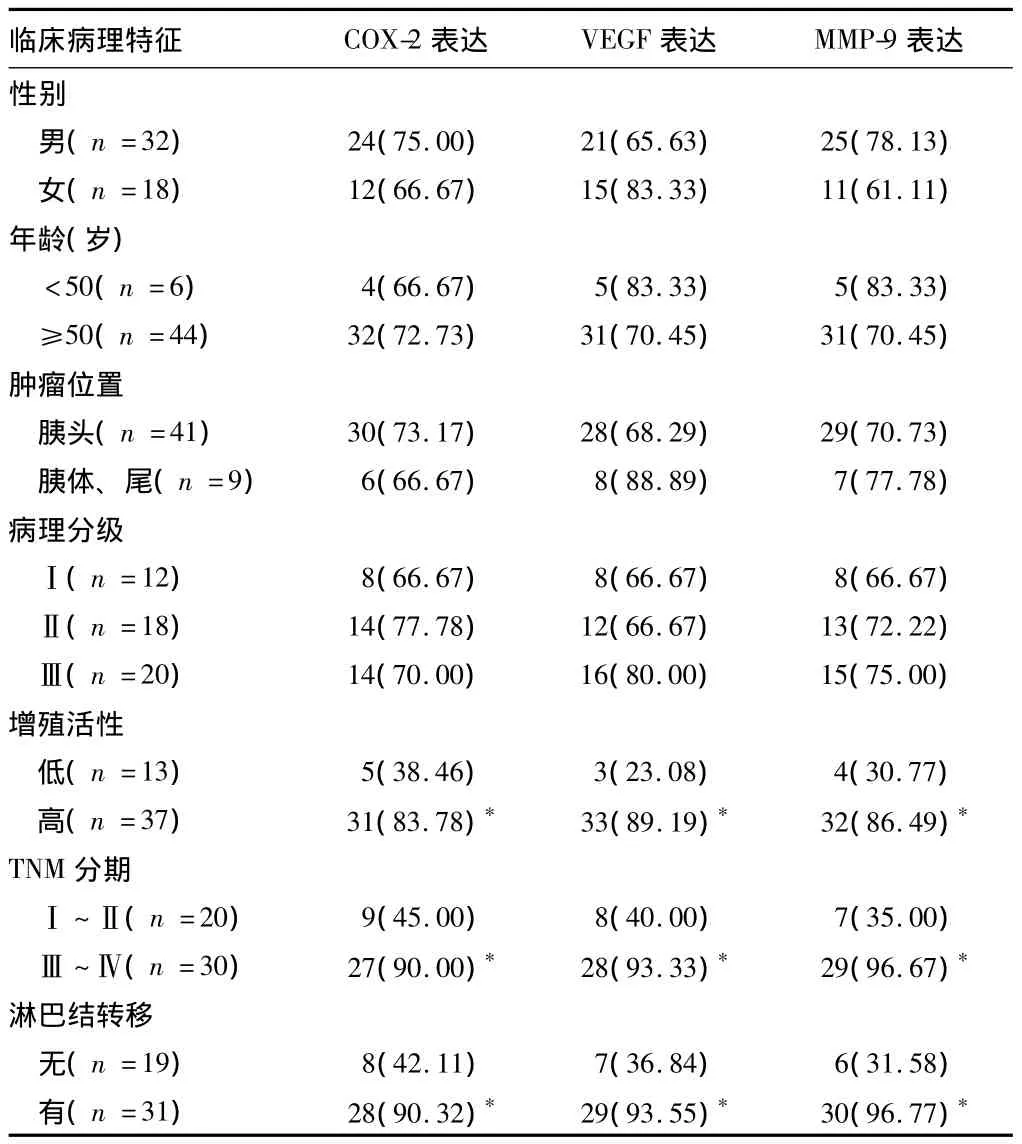
表3 COX-2、VEGF、MMP-9蛋白表达与胰腺癌临床病理特征的关系n=50,例(%)
2.4 COX-2、VEGF、MMP-9 表达与患者预后的关系
通过对50例患者术后随访发现,预后>1年和≤1年的患者COX-2阳性表达率分别为40.00%(6/15)、85.71%(30/35),平均生存时间为(21.12 ±2.11)个月、(9.24±1.35)个月,差异有统计学意义(P<0.05)。预后>1年和≤1年的患者VEGF阳性表达率为 40.00%(6/15)、94.29%(33/35),平均生存时间分别为(21.47 ±2.36)个月、(9.68 ±1.34)个月,差异有统计学意义(P<0.05)。预后 >1年和≤1年的患者 MMP-9阳性表达率为 20.00%(3/15)、97.14%(34/35),平均生存时间为(22.12 ±2.42)个月、(9.13 ±1.25)个月,差异有统计学意义(P<0.05)。说明COX-2、VEGF、MMP-9表达阴性的患者预后明显好于COX-2、VEGF、MMP-9表达阳性的患者。
2.5 塞来布昔对 BXPC-3细胞VEGF、MMP-9 mRNA表达的影响 与对照组比较,塞来布昔处理24 h后,随着剂量增加VEGF、MMP-9 mRNA表达水平均有不同程度下降,呈剂量依赖性(P<0.05)。采用50 μmol/L塞来布昔处理细胞观察不同时间点VEGF、MMP-9 mRNA表达的变化,结果表明随着时间延长VEGF、MMP-9 mRNA表达水平均有不同程度下降,呈时间依赖性(P<0.05)。见表4、5。
表4 塞来布昔对BXPC-3细胞VEGF、MMP-9 mRNA表达的影响 ±s
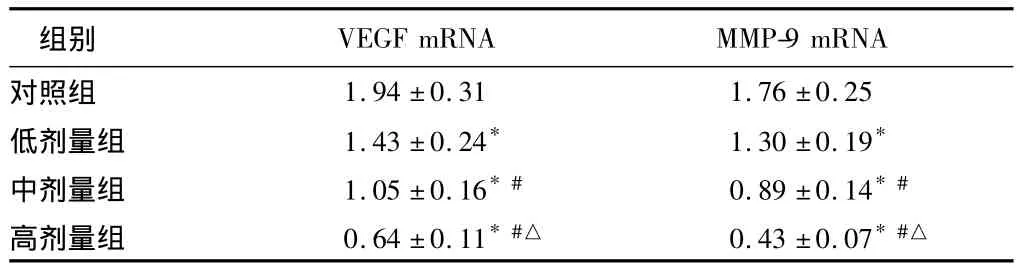
表4 塞来布昔对BXPC-3细胞VEGF、MMP-9 mRNA表达的影响 ±s
注:与对照组比较,*P <0.05;与低剂量组比较,#P <0.05;与中剂量组比较,△P <0.05
组别VEGF mRNA MMP-9 mRNA对照组1.94 ±0.31 1.76 ±0.25低剂量组 1.43 ±0.24* 1.30 ±0.19*中剂量组 1.05 ±0.16*# 0.89 ±0.14*#高剂量组 0.64±0.11*#△ 0.43±0.07*#△
表5 不同时段塞来布昔对BXPC-3细胞VEGF、MMP-9 mRNA表达的影响 ±s

表5 不同时段塞来布昔对BXPC-3细胞VEGF、MMP-9 mRNA表达的影响 ±s
注:与24 h比较,*P <0.05;与48 h 比较,#P <0.05
组别VEGF mRNA 24 h 48 h 72 h MMP-9 mRNA 24 h 48 h 72 h对照组 1.94 ±0.31 1.98 ±0.33 1.95 ±0.30 1.76 ±0.25 1.73 ±0.26 1.75 ±0.28中剂量组 1.05 ±0.16 0.77 ±0.12* 0.58 ±0.08*# 0.89 ±0.14 0.70 ±0.11* 0.51 ±0.07*#
2.6 塞来布昔对BXPC-3细胞VEGF、MMP-9蛋白表达的影响 塞来布昔处理24 h后,随着剂量增加VEGF、MMP-9蛋白表达水平均有不同程度下降,呈剂量依赖性(P<0.05)。采用50 μmol/L塞来布昔处理细胞观察不同时间点VEGF、MMP-9蛋白表达的变化,结果表明随着时间延长VEGF、MMP-9蛋白表达水平均有不同程度下降,呈时间依赖性(P<0.05)。见表6、7。
表6 塞来布昔对BXPC-3细胞VEGF、MMP-9蛋白表达的影响 ±s

表6 塞来布昔对BXPC-3细胞VEGF、MMP-9蛋白表达的影响 ±s
注:与对照组比较,*P <0.05;与低剂量组比较,#P <0.05;与中剂量组比较,△P <0.05
组别 VEGF蛋白 MMP-9蛋白对照组1.72 ±0.27 1.63 ±0.25低剂量组 1.29 ±0.21* 1.17 ±0.19*中剂量组 0.87 ±0.14*# 0.69 ±0.11*#高剂量组 0.50±0.08*#△ 0.38±0.05*#△
表7不同时段塞来布昔对BXPC-3细胞VEGF、MMP-9蛋白表达的影响 ±s

表7不同时段塞来布昔对BXPC-3细胞VEGF、MMP-9蛋白表达的影响 ±s
注:与24 h比较,*P <0.05;与48 h 比较,#P <0.05
组别 VEGF蛋白24 h 48 h 72 h MMP-9蛋白24 h 48 h 72 h对照组 1.72 ±0.27 1.74 ±0.30 1.75 ±0.35 1.63 ±0.25 1.62 ±0.26 1.65 ±0.25中剂量组 0.87 ±0.14 0.61 ±0.10* 0.42 ±0.07*# 0.69 ±0.11 0.52 ±0.08* 0.39 ±0.06*#
3 讨论
COX-2是一种诱导型酶,在正常组织极少表达,而在胃癌、乳腺癌、结肠癌、卵巢癌、喉癌等恶性肿瘤组织高表达,预示患者预后不良、生存期短。研究显示,生长因子、炎性因子、缺氧及致癌物质等因素刺激细胞大量表达COX-2,具有诱导细胞恶变、促进肿瘤细胞过度增殖、侵袭和转移、抑制细胞凋亡等作用[2]。其可能的作用机制:(1)肿瘤细胞PGE2的表达促进了肿瘤细胞的异常增殖,同时抑制机体免疫力,导致肿瘤免疫逃逸;(2)COX-2通过上调抗凋亡蛋白bcl-2、bcl-xl的表达抑制血管内皮细胞的凋亡;(3)COX-2能够促进VEGF的表达及肿瘤新生血管的形成,而VEGF高表达又可正反馈调节COX-2表达,二者对肿瘤血管生成发挥协同促进作用[5];(4)COX-2能够诱导恶性肿瘤细胞表达MMPs,增强肿瘤细胞对细胞外基质的降解能力,从而促进肿瘤细胞的侵袭和扩散[6]。
本研究结果显示,COX-2、VEGF、MMP-9在胰腺癌组织的阳性表达率(分别为72.00%、78.00%、74.00%)显著高于癌旁组织(分别为6.00%、8.00%、6.00%),与Guo等[7]在胃癌﹑乳腺癌等组织的研究结果一致;且三者表达与胰腺癌临床分期、增殖活性、一年期生存率及肿瘤浸润转移等临床病理特征相关(P<0.05),而与年龄、性别、发病部位、病理组织分级无关(P>0.05),表明COX-2、VEGF、MMP-9过表达可能和胰腺癌的发生及预后密切相关。COX-2、VEGF、MMP-9表达互相调节、协同作用,共同导致肿瘤的过度增殖、侵袭和扩散[8,9]。
塞来布昔是选择性COX-2抑制剂,属于非甾体抗炎药。近年来研究显示,塞来布昔通过促进细胞凋亡、阻滞细胞周期、抑制肿瘤新生血管生成等机制发挥抗肿瘤作用,目前已经广泛应用于结肠癌、卵巢癌、乳腺癌等恶性肿瘤的防治中[3,4]。但COX-2抑制剂在胰腺癌组织的作用机制目前尚不清楚。本实验选取BXPC-3细胞为研究对象,采用RT-QPCR和Western blot检测塞来布昔对培养的胰腺癌BXPC-3细胞中VEGF、MMP-9 mRNA和蛋白表达的影响,结果显示,塞来布昔能够显著抑制BXPC-3细胞中VEGF、MMP-9 mRNA和蛋白表达水平,呈剂量和时间依赖性,提示塞来布昔对肿瘤侵袭转移具有明显的抑制作用,这可能是塞来布昔发挥抗肿瘤作用的机制之一。
综上所述,本研究结果表明胰腺癌组织高表达COX-2、VEGF、MMP-9,且三者表达具有正相关性,提示COX-2、VEGF、MMP-9发挥协同作用,共同参与胰腺癌的发生发展。此外,COX-2、VEGF、MMP-9与胰腺癌临床分期、增殖活性、淋巴结及远处转移状况及预后密切相关。COX-2可能通过促进VEGF、MMP-9等基因表达增强了胰腺癌细胞的侵袭转移能力。选择性COX-2抑制剂塞来昔布能够显著抑制胰腺癌BXPC-3细胞中VEGF、MMP-9的表达,从而发挥抗肿瘤作用。
1 Mihaljevic AL,Michalski CW,Friess H,et al.Molecular mechanism of pancreatic cancer-understanding proliferation,invasion,and metastasis.Langenbecks Arch Surg,2010,395:295-308.
2 Menter DG,Schilsky RL,DuBois RN.Cyclooxygenase-2 and cancer treatment:understanding the risk should be worth the reward.Clin Cancer Res,2010,16:1384-1390.
3 Vosooghi M,Amini M.The discovery and development of cyclooxygenase-2 inhibitors as potential anticancer therapies.Expert Opin Drug Discov,2014,9:255-267.
4 Li WW,Long GX,Liu DB,et al.Cyclooxygenase-2 inhibitor celecoxib suppresses invasion and migration of nasopharyngeal carcinoma cell lines through a decrease in matrix metalloproteinase-2 and-9 activity.Pharmazie,2014,69:132-137.
5 Li ZR,Li YP,Lin ML,et al.Activated macrophages induce neovascularization through upregulation of MMP-9 and VEGF in rat corneas.Cornea,2012,31:1028-1035.
6 Scoditti E,Calabriso N,Massaro M,et al.Mediterranean diet polyphenols reduce inflammatory angiogenesis through MMP-9 and COX-2 inhibition in human vascular endothelial cells:a potentially protective mechanism in atherosclerotic vascular disease and cancer.Arch Biochem Biophys,2012,527:81-89.
7 Guo HF,Chen XC,Zhu J,et al.Expressions of COX-2 and VEGF-C ingastric cancer:correlations with lymphangiogenesis and prognostic implications.J Exp Clin Cancer Res,2011,32:1037-1044.
8 Zhang H,Li X,Ding J,et al.Delivery of ursolic acid(UA)in polymeric nanoparticles effectively promotes the apoptosis of gastric cancercells through enhanced inhibition of cyclooxygenase 2(COX-2).Int J Pharm,2013,441:261-268.
9 Lai Y,Zhang X,Zhang Z,et al.The microRNA-27a:ZBTB10-specificity protein pathway is involved in follicle stimulating hormone induced VEGF,Cox2 and survivin expression in ovarian epithelial cancer cells.Int J Oncol,2013,42:776-784.

