苜蓿根瘤菌cfp 荧光标记株的 构建及筛选方法
张淑卿,李剑峰,陈力玉,师尚礼,苗阳阳
(1.贵州师范学院 地理与旅游学院,贵州 贵阳550018;2.贵州师范学院 喀斯特生境土壤与环境生物修复研究所,贵州 贵阳550018;3.甘肃农业大学 草业生态系统教育部重点实验室,甘肃 兰州730070;4.中国草学会,北京100193)
细菌间DNA 的转移方式主要有转化、转导、接合及原生质体的细胞融合。三亲本杂交是基于双亲本杂交的接合转移,应用较为广泛。青色荧光蛋白cf p 是绿色荧光蛋白gf p 的突变体,编码基因表达后不损伤宿主细胞也无需底物,适用于活体检测[1],且耗能低,能产生更明亮的蓝-绿色或青色荧光[2],用于检测根瘤菌的占瘤率和示踪根瘤菌侵染结瘤,过程直观、精确而易于操作[3]。凌瑶[4]指出携带cf p 基因的质粒适用于构建豌豆(Phaseol us r hizobia)根瘤菌荧光标记株,且能稳定表达。在接合子的分离和甄选过程中[5],目前多以含抗生素选择平板来分离cf p 供体菌和荧光标记根瘤菌株。而对“假接合子”,则以检测结瘤能力,以及根瘤是否发荧光予以排除[6],大量标记菌株的甄选验证存在一定的困难。
为探讨以三亲本杂交法构建苜蓿根瘤菌cf p 荧光标记株的可行性和适用性,简化后期筛选验证流程,提高标记菌株选育效率并获得优良的荧光标记菌株。本研究拟在三亲本杂交法构建cf p 荧光标记苜蓿根瘤菌的基础上,通过抗生素选择平板和无氮培养基对标记株进行筛选和甄别,对优良菌株进行遗传稳定性验证和宿主回接鉴定,并通过测定回接植株的生物量、结瘤特性和发光根瘤的数量探讨优良标记株的促生能力和荧光表达能力,为苜蓿根瘤菌荧光标记株的构建,甄选和验证方法的优化和改进提供参考和依据,并为苜蓿根瘤菌竞争结瘤及菌体在宿主体内的迁移研究提供优良的标记菌株。
1 材料与方法
1.1 材料
1.1.1 供试菌株
供体菌株为含cf p 荧光基因质粒的大肠杆菌E.coli p MP4517;辅助菌株为大肠杆菌Escherichia coli p RK2073。均由教育部草业生态系统重点实验室提供。
受体菌株为苜蓿根瘤菌Rhizobiu m melil oti GN5,分离自甘农5 号紫花苜蓿(Medicago sativa cv.Gannong No.5)种子,由教育部草业生态系统重点实验室提供,经中科院微生物鉴定与保藏中心鉴定[6];苜蓿中华根瘤菌标准菌Sinor hizobiu m meliloti 12531,购自中科院微生物保藏中心[7]。
1.1.2 培养基 Y MA 培养基参照殷爱华和韩素芬[8]的方法配制,用于根瘤菌的增殖培养。
TY(Yeast Tryptone Agar)培养基参照袁全等[9]的方法配制,用于标记菌株荧光表达能力的观察检测。
LB(Luria Bertani)培养基参照胡元森等[10]的方法配制,用于供体菌及辅助菌的增殖培养。
SM(Supplemental Mediu m)培养基参照陈力玉[11]的方法配制,用于菌体的分离培养。
Winogradsky无氮液体培养基参照Islam 等[12]的方法配制,用于接合子固氮能力的快速检测。
上述培养基均以121 ℃湿热灭菌26 min。
含抗生素固体培养基的配制:抗生素溶液壮观霉素(Spe)和庆大霉素(Gm)各0.005 g,各加入100 mL去离子水溶解后经0.22μm 的无菌滤膜过滤,制成浓度为50μg·mL-1的溶液。待配制的固体培养基冷却至40 ℃左右时加入,制成TY/LB/SM 含药固体平板。
1.1.3 植物材料 甘农5号紫花苜蓿种子由教育部草业生态系统重点实验室提供,种子发芽率90.6%,净度98.5%。
1.2 荧光标记根瘤菌的构建及筛选
1.2.1 感受态细胞的制备 参照杨坤等[13]的方法,将4 ℃下保存的受体菌R.melil oti GN5和S.meliloti 12531转接于Y MA 固体培养基,28 ℃活化24 h后转接于50 mL Y MA 液体培养基。28℃、200 r·min-1振荡培养3~4 h,至菌液OD600为0.4时置于盐水冰上预冷,15 min后将预冷菌液转入已在-1.5 ℃预 冷 的50 mL 离 心 管 中,4 ℃、3 000 r·min-1离心5 min,弃去上清液并加入15 mL 预冷(-1.5 ℃)的0.1 mol·L-1的无菌CaCl2溶液,使菌体重新悬浮后于盐水冰块上处理20~30 min后4 ℃、3 000 r·min-1离心5 min。弃上清液,在菌体沉淀中加入-1.5℃预冷的0.1 mol·L-1无菌Ca Cl2溶液,振荡至菌体充分悬浮后加入适量预冷Ca Cl2溶液至菌液OD600为0.5。
1.2.2 三亲本杂交法荧光标记根瘤菌的构建及筛选 混合菌体准备:在凌瑶[4]的方法基础上予以改进,即在含庆大霉素(Gm)50μg·mL-1和壮观霉素(Spe)50μg·mL-1的LB 固体培养基活化供体菌E.coli 4517 和辅助菌E.coli 2073。28 ℃培养16~18 h,分别转接菌株到含50μg·mL-1Gm 和50μg·mL-1Spe的LB 液体培养基中,37 ℃、120 r·min-1振荡培养至菌体生长对数期(OD600=0.5)。将以上供体菌、辅助菌、受体菌(R.meliloti GN5和S.meliloti 12531的感受态细胞)的菌液各1.5 mL混合,8 000 r·min-1离心5 min得到混合菌体沉淀,弃上清后向沉淀加入1 mL无抗生素TY液体培养基,振荡打匀并8 000 r·min-1离心5 min,弃去上清后留混合菌体沉淀。
混合培养:取0.22μm 无菌滤膜贴于TY 固体平板表面,每皿贴3片;取菌体沉淀加1 mL 无菌水打散成浓菌液,在滤膜中央加0.2 mL浓菌液,28℃正置2 h后倒置培养。2~3 d后取已长出培养物的滤膜置入无菌西林瓶,加5 mL 无菌水洗下菌体,再用无菌水稀释10倍后取0.2 mL 菌液在SM+Gm固体平板上进行涂抹,28 ℃培养7 d后在平板上挑取50个单菌落,编号后分别点接于无抗生素TY 培养基和无氮培养基上,28 ℃培养至菌落出现(每菌株3次重复)。在WFH-204紫外分析仪336 n m 下检测菌落,选择可发青色荧光单菌落的培养物转接于Winogradsky无氮培养基,无氮平板上能正常生长的菌株则为荧光标记根瘤菌(接合子)。
1.3 标记根瘤菌的遗传稳定性检测
将筛选得到的R.meliloti GN5和S.meliloti 12531接合子重新编号后接种于不加抗生素的TY固体培养基上,28℃培养2~3 d后记为第1代。再转接至TY 固体斜面培养基28 ℃培养,每隔36 h传代一次,连续转接7次计8代,检测每代菌株形成单菌落的荧光表达状况并计算荧光质粒的丢失率。
1.4 标记根瘤菌的回接鉴定
参照李剑峰等[14]的方法以甘农5号紫花苜蓿对筛选出的荧光标记菌进行回接鉴定。回接试验参照张志芳和夏叔芳[15]的方法,采用随机区组设计[16]进行盆栽试验,每菌株4次重复,以不接菌的处理为对照。以单个无菌沙培盆栽作为一次重复、每盆栽内播种表面灭菌的苜蓿种子4粒,出苗3 d后留苗1株。盆栽标号后加托盘在光照培养室内随机排列摆放,参照李剑峰等[14]的方法进行日常管理。处理45 d后测定植株的生物量、株高、根长、单株结瘤数和根瘤重。
根瘤固氮酶活性测定:参照Hara等[17]的方法进行。测定参数:柱温175 ℃,进样温度150 ℃,FID 170℃,进样50μL,每处理3次重复。
标记菌占瘤率的测定:以蒸馏水无损清洗回接苗根系,无菌水冲洗3~5次,每单株收集全部根瘤,根瘤表面灭菌后参照张淑卿[18]的方法用WFH-204紫外分析仪在336 n m 下检测,产生青色荧光的根瘤即为荧光标记株侵染形成[11]。根据以上步骤,逐步筛选出荧光表达能力强、荧光质粒遗传稳定、占瘤率高、固氮酶活性高且能使苜蓿植株生物量增加的荧光标记菌株。
1.5 数据分析
参照Muhammad等[19]以SPSS 13.0统计软件对数据进行单因素方差分析,用Duncan法进行数据的多重比较;采用Excel 2007制图。
2 结果与分析
2.1 荧光标记根瘤菌接合子的构建和初选
两种根瘤菌从SM+Gm 平板上选出的各50个能在TY 培养基上形成菌落的接合子,336 n m 紫外光照射下均出现青色荧光(图1)。但S.meliloti 12531菌株的接合子中,8个菌株的3次重复均能在无氮固体培养基上正常生长(表1),R.meliloti GN5的11个菌株的3次重复能在无氮固体培养基上正常生长(表2),表明菌株的固氮能力能够稳定遗传;综合接合子的生长和发光特性,筛选出S.meliloti 12531菌株的8 个接合子,R.meliloti GN 5菌株的1 1个接合子。可见在SM +Gm上获得的大部分接合子在传代过程中固氮性能并不稳定,仅约16%~22%的菌体可稳定遗传。因此,若未经无氮培养基复筛,则可能会有部分固氮性能缺失的菌体进入后期的筛选流程,而3次重复以上的无氮培养基复筛对获得稳定的荧光标记固氮菌株是必要的。
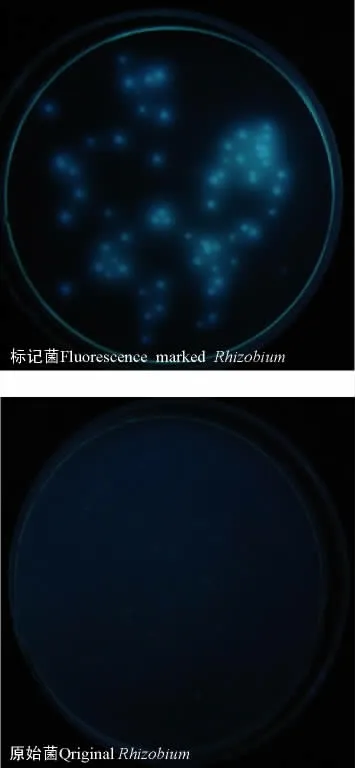
Fig.1 Luminescence conditions for fluorescence mar kedRhizobium str ains and the original Rhizobium stains under portable long wave ultr aviolet lamp(336 n m)

表1 S.meliloti 12531菌株接合子的筛选Table 1 Bacterial conjugant screening for S.meliloti 12531
2.2 荧光标记根瘤菌的遗传稳定性
初选获得的接合子在无抗生素的TY 固体培养基上连续传代8次后,荧光质粒的丢失率均低于10%(表3),可见cf p 荧光质粒随宿主菌的传代能进入下一代菌体,并在次代菌体细胞中稳定复制。表明固氮能力稳定的菌株与荧光质粒的结合能力较好,其 中 丢 失 率 为0 的S.meliloti 12531-cf p6、S.meliloti 12531-cf p8、R.meliloti GN5-cf p5 及R.meliloti GN5-cf p 9荧光表达能力也最强,最终作为荧光标记株进行宿主植株回接试验。说明稳定的固氮能力对菌株维持自身细胞内cf p 标记质粒的荧光表达和质粒伴随宿主继代有积极的作用,这可能与充足的氮素供应有利于蛋白、核酸和酶类合成、进而促进菌体细胞及cf p 基因标记质粒的正常分裂和增殖相关,其具体机理有待进一步研究确定。

表2 R.meliloti GN5菌株接合子的筛选Table 2 Bacterial conjugant screening for R.meliloti GN5
2.3 荧光标记根瘤菌的回接鉴定和筛选
接种标记菌的苜蓿幼苗的生物量和株高与未接种植株(CK)有明显差异(表4)。其中回接S.melil oti 12531-cf p 6、S. melil oti 12531-cf p 8 及R.meliloti GN5-cf p5 菌 株 的 生 物 量 高 出 对 照90.5%~104.8%,与对照差异显著(P<0.05)。S.meliloti 12531-cf p6、S.meliloti 12531-cf p8和R.meliloti GN5-cf p 5回接植株的株高较对照高出56.36%~69.16%,与对照差异显著。4 株标记菌回接植株的根长与对照无显著差异(P>0.05),因此苜蓿根瘤菌荧光标记株能有效促进幼苗地上部分的生长,增加其生物量和干物质积累。可见优良的标记菌尽管具备荧光表达特性,额外的标记质粒需要消耗部分菌体及菌体宿主植物的碳水化合物,但并未显著影响菌体对植株的促生作用。故优良的标记菌中,携带cf p 荧光标记基因的质粒其荧光表达效率较高而能耗较低。
侵染寄主植株形成有效根瘤是根瘤菌的主要特性。尽管未接种的对照处理也出现根瘤,但数量和鲜重等均较低,且无发光根瘤(表5)。4 株荧光标记菌回接植株的根瘤数、单个根瘤鲜重及固氮酶活性均显著高于对照,紫外光下根瘤的荧光表达强度较高(图2)。其中,S.meliloti 12531-cf p6、S.meliloti 12531-cf p 8、R.meliloti GN5-cf p5及R.meliloti GN5-cf p9 的根瘤数高出对照125%~350%,单个根瘤鲜重高出对照300%~750%,固氮酶活性为对照的14.7~30.9 倍。除S.meliloti 12531-cf p 6 处 理 占 瘤 率 高 于S.meliloti 12531-cf p8处理18.6%外,其他根瘤指标与S.meliloti 12531-cf p8 处 理 差 异 不 显 著(P >0.05),R.meliloti GN5-cf p5 处理的所有根瘤指标测定结果均显著高于R.meliloti GN5-cf p9 处理(P<0.05)。根据植物促生能力、结瘤情况和占瘤率,S.meliloti 12531-cf p 6 及R.meliloti GN5-cf p5可分别作为S.meliloti 12531 和R.meliloti GN5的标记菌株用于进一步的研究。上述结果可知,同一出发菌株的三亲本杂交后代中,结瘤及固氮能力差异存在着显著的差异。这说明三亲本杂交时,质粒通过转导进入受体菌株的数量可能是随机的,对菌体能量的消耗也不同。因此,为获得优良的标记菌株,对接合子进行宿主植物的回接验证是必要的。

表3 S.meliloti 12531及R.meliloti GN5菌株接合子荧光质粒丢失率Table 3 Lose rate of fluorescent plasmid derived from the conjugants of S.meliloti 12531 and R.meliloti GN5

表4 标记根瘤菌对苜蓿幼苗生长的影响Table 4 Effects of mar ked Rhizobia on growth of alfalfa seedlings

表5 标记根瘤菌对苜蓿幼苗根瘤的影响Table 5 Effects of mar ked Rhizobia on nodules of alfalfa seedlings

图2 荧光标记菌侵染形成的发光根瘤Fig.2 Lu minescent root nodules induced by mar ked Rhizobia strains
3 讨论与结论
cf p 荧光基因借助宿主范围较广的接合质粒,通过受体菌与质粒供体菌细胞间的紧密接触由供体细胞转移至受体细胞[20]。三亲本杂交是在双亲本杂交的基础上,使质粒在辅助菌的协助下进入受体菌,如将cf p 荧光基因导入到豌豆根瘤菌后能够稳定表达[4]。本研究中,三亲本杂交法可高效构建遗传稳定的cf p 荧光标记苜蓿根瘤菌,构建的标记根瘤菌在TY 固体培养基上连续传代8次后,cf p 荧光质粒的丢失率均低于10%。
三亲本杂交法中,难以区分选择培养基上出现的根瘤菌耐药突变株和供体菌、辅助菌的营养缺陷回复突变株,即“假接合子”。本研究中,假接合子或丧失固氮能力的标记菌株比例较高,若以反复的形态观察和宿主回接试验,以是否结瘤,以及根瘤是否产生荧光来区分,则复杂耗时[11]。因此,借助根瘤菌株在无氮培养基上正常生长的特性,用无氮和TY 固体培养基同步验证菌种的固氮和发光特性,简化了筛选验证流程,提高了标记菌选育效率,具有良好的应用前景。
外源质粒对菌株共生固氮能力的影响可能是促进、也可能是抑制[21]。一些根瘤菌在导入外源质粒后侵染结瘤和共生固氮能力会有显著提升[22],可使宿主植株的根瘤鲜重、生物量及植株含氮量增加[23]。李杰等[22]以l ux AB 和par CBA 基因重组质粒p HN208标记的根瘤菌株,其竞争结瘤能力没有负面影响,遗传性状稳定。一些l ux AB 基因标记的根瘤菌占瘤率可达61.3%,显著优于土著根瘤菌[24]。本研究也发现,源于同一出发菌株的荧光标记株,其结瘤能力和固氮酶活性存在较大差异。因此除荧光表达强度外,对标记菌株的结瘤及促生能力进行验证也是必要的。
通过初选、复选和回接验证,本研究最终获得了理想的标记根瘤菌,其培养物和形成根瘤的荧光表达能力强,与出发菌株易于区分(图1、2)并有良好的促生能力,能使甘农5号紫花苜蓿植株生物量高出对照90.5%~104.8%、株高高出对照56.36%~69.16%,根瘤数高出对照125%~350%,根瘤鲜重高出对照300%~750%,固氮酶活性达到对照的14.7~30.9倍。其中的S.melil oti 12531-cf p 6 和R.meliloti GN5-cf p5荧光表达强度,占瘤率、根瘤的固氮酶活性等均高出其他标记菌株,可用于进一步的根瘤菌示踪研究。
致谢:该论文是第二届全国草业生物技术大会评选出的优秀论文,并得到中国草业生物技术专业委员会提供的版面费支持。
[1] 周俊初,史巧娟,谢波.绿色荧光蛋白基因(gf p)在华癸中生根瘤菌与紫云英共生固氮作用研究中的应用[J].中国科学基金,2001(5):48-51.
[2] Heim R,Tsien R Y.Engineering green fluorescent protein f or improved brightness,longer wavelengths and fluorescence resonance energy transfer[J].Current Biology,1996,6(2):178-182.
[3] 王浩,绳志雅,隋新华.陈文新.用gf p 基因标记法研究大豆根瘤菌在大豆根部定殖结瘤情况[J].微生物学杂志,2006,26(2):1-4.
[4] 凌瑶.用cf p 标记基因法研究菜豆根瘤菌的竞争性和有效性[D].雅安:四川农业大学硕士论文,2005:48-52.
[5] 沈凤英,李亚宁,刘力强,吴伟刚,刘大群.生防链霉菌Men-myco-93-63遗传转化体系的建立和优化[J].中国农学通报,2009,25(13):197-201.
[6] 张淑卿,师尚礼,陈力玉,苗阳阳,李剑峰,霍平慧.LaCl3,IAA 及植物体液对荧光标记根瘤菌生长和增殖的影响[J].草原与草坪,2013,33(2):57-61.
[7] Li J,Zhang S,Shi S,Michalk D,Huo P.Isolation and screening for calcium phosphate solubilizing of Rhizobium meliloti[J].Jour nal of Biobased Materials and Bioener gy,2012,6(6):698-703.
[8] 殷爱华,韩素芬.豆科树种凝集素和根瘤菌胞外多糖结合反应与结瘤的关系[J].南京林业大学学报:自然科学版,2005,29(5):88-90.
[9] 袁全,杨梦华,郑会明,钟增涛,朱军.中慢生型华癸根瘤菌Mesor hizobiu m huakuii AS9自体诱导物合成酶基因的筛选及其功能分析[J].土壤,2009,41(3):459-463.
[10] 胡元森,李翠香,孙富林,吴坤,贾新成.不同培养基组合提高土壤细菌可培养性的研究[J].微生物学报,2007,47(5):882-887.
[11] 陈力玉.基于三亲本杂交的荧光标记根瘤菌的构建及其稳定性检测研究[D].兰州:甘肃农业大学硕士论文,2013:29-33.
[12] Islam M S,Kawasaki H,Nakagawa Y,Hattori T,Seki T.Labr ys okinawensis sp.nov.and Labr ys miyagiensis sp.nov.,budding bacteria isolated fr o m r hizosphere habitats in Japan,and emended descriptions of t he genus Labr ys and Labrys monachus[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(3):552-557.
[13] 杨坤,巩振辉,李大伟.大肠杆菌高效感受态细胞的制备及快捷转化体系的建立[J].北方园艺,2010,14:127-13.
[14] 李剑峰,张淑卿,师尚礼.微波诱变选育高产生长素及耐药性根瘤菌株研究[J].核农学报,2009,6:981-985.
[15] 张志芳,夏叔芳.几种豆科牧草根瘤的分离与接种试验[J].草业科学,1994,11(5):29-33.
[16] 高永革,李黎,刘祥,李和平,朱伟然,王磊,王彦华.黄河滩区紫花苜蓿生产性能比较研究[J].草业科学,2008,25(7):59-64.
[17] Hara S,Hashidoko Y,Desyatkin R V,Hatano R,Tahara S.High rate of N2fixation by east siberian cr yophilic soil bacteria as deter mined by measuring acetylene reduction in nitrogen-poor medium solidified with gellan gu m[J].Applied Environ ment Micr obiology,2009,75:2811-2819.
[18] 张淑卿.根瘤菌在苜蓿植株体内的运移及影响因素[D].兰州:甘肃农业大学博士论文,2012:37-42.
[19] Muhammad Z,Asif T,Ata C Z,Ashraf M.Weed-crop competition effects on growth and yield of sugarcane planted using t wo met hods[J].Pakistan Jour nal of Botany,2010,42(2):815-823.
[20] Elhai J,Vepritskiy A,Muro-Pastor A M,Flores E,Wolk C P,Flores E,Peter Wolk C.Reduction of conjugal transfer efficiency by three restriction activities of Anabaena sp.strain PCC 7120[J].Jour nal Bacteriology,1997,179(6):1998-2005.
[21] 朱光富,周俊初,陈华癸.外源质粒(基因)导入花生根瘤菌的行为分析[J].遗传学报,1996,23(2):131-141.
[22] 李杰,陈丽华,李希臣,朱延明.一种应用l ux AB 基因标记大豆根瘤菌的新方法[J].大豆科学,2003,22(3):172-175.
[23] 李友国,周俊初.导入dct ABD 和nif A 基因对费氏中华根瘤菌共生固氮的影响研究[J].遗传学报,2002,29(2):181-188.
[24] 罗明云,张小平,李登煜,陈强,周俊初.用发光酶基因(Lux AB)标记法研究慢生型花生根瘤菌的竞争结瘤能力[J].生态学报,2003,23(2):278-283.

