WOX转录因子家族研究进展
王俞程,何瑞萍,彭献军,沈世华
(1.北方资源植物重点实验室 中国科学院植物研究所,北京100093;2.中国科学院大学,北京100049)
WUSCHEL-related homeobox(WOX)转录因子家族是植物特有的一类转录因子。他的同源异型结构域(Ho meodomain,HD)由65个氨基酸残基组成[1]。该家族基因在植物发育关键时期发挥重要作用,如胚的形成、干细胞稳定性和器官的形成。这些功能的发挥与他们能够促进细胞分裂或阻止未成熟细胞的提前分化密不可分[2]。WUSCHEL(WUS)基因是WOX 家族中最早发现的基因,1996年Laux等[3]研究表明拟南芥(Ar abidopsis thaliana)wus突变体的茎尖分生组织(Shoot Apical Meristem,SA M)和花序分生组织(Floral Meristem,FM)异常,不断产生有缺陷的茎尖分生组织,仅仅产生几片叶后,芽原基停止生长,导致在茎上产生许多成簇状的叶序混乱的叶片,花数目减少且花器官异常,该基因虽然不影响干细胞的发生,但对维持其功能稳定性起重要作用。2004年,Haecher等[1]在全面研究拟南芥基因组后,发现了15个编码与WUS结构相似的蛋白的基因,并将他们命名为WOX 基因。
1 WOX结构特点
WOX 转录因子家族是属于 Ho meobox(HOX)超家族中的一员,在HOX 超家族中,典型的同源异型结构域由60个氨基酸残基组成,这60个氨基酸残基序列折叠形成“螺旋-环-螺旋-转角-螺旋(helix-loop-helix-tur n-helix)”的空间结构,其中由第2 个和第3 个螺旋组合形成的“螺旋-转角-螺旋(helix-turn-helix)”能够与特定DNA序列结合[4]。这一结构域在不同物种不同蛋白中都非常保守,说明这个结构对维持HD 功能完整性起重要的作用[5]。WOX蛋白家族的HD含有65个(WUS是66)氨基酸残基,增加的5 个或6 个分别在第1个和第2个螺旋间多了1个或2个残基,在第2个和第3个螺旋间多了4 个残基[4]。HD 结构域在WOX 蛋白家族不同成员中的位置变化较大。该家族分为WUS支(WUS Clade)、中间支(Inter mediate Clade)和远古支(Ancient Clade)3个支,各成员除含有HD 外,还含有其他功能元件,如WUS支的成员在HD 的羧基端一侧含有一个WUS-box结构域(一般形式是T-L-X-L-F-P-X-X,X 代表任意氨基酸),其他两支也存在相似结构域。另外,WUS 支成员WUS-box起始氨基酸为T-L,远古支和中间支起始氨基酸并不固定。WUS-box结构域在调控茎尖干细胞群的稳定性和花器官的发育过程中起重要的作用[6]。
一些WOX 蛋白在其HD 和WUS-box之间存在着一连串酸性氨基酸残基,可能作为一个转录激活结构域行使其功能;另外,在拟南芥中WUS、WOX5和WOX7在其羧基端末尾存在着一个与乙烯响应因子(Ethylene Response Factor,ERF)相关的两性抑制结构域,具有转录抑制功能[7],除了这三个成员,其他WOX 蛋白也都含有形式不太严格的EAR结构域其形式大多是[LVI]-X-[LVI]-X-[LVI],存在位置也并不限定在蛋白序列的羧基末端,有时候会与其他结构域发生重叠,并且可能存在多个拷贝(如在WOX8中有3个拷贝)。远古支的WOX 蛋白(WOX10、WOX13和WOX14)在其羧基端存在着一个由60个左右的氨基酸组成的结构域。Lian等[8]选择7个物种的56个WOX 蛋白进行比对,发现除HD 以外还存在7个保守的结构域,这些结构域的功能未知,尚未有研究报导,他们认为这些未知的结构域的形成可能与这些WOX 蛋白的功能分化相关。
2 WOX亚细胞定位与转录激活活性
尽管WOX 蛋白都是作为转录因子而发挥其作用,然而该家族所有的成员都无法预测到明显的信号肽序列。已有的亚细胞定位试验表明,拟南芥的At-PRS(WOX3)[9]、At WOX4[10]、At WUS[11]、At WOX6[12]和At WOX11[13]定位在细胞核内,At WOX1同时定位在细胞核内和细胞质中[14]。水稻的Os WOX3,Os WOX9(DWT1)[15],Os WOX11[13],毛白杨(Populus tomentosa)的Pto WUSa、Pto WOX4a、Pto WOX5a、Pto WOX11/12a和Pto WOX13c都定位在核内[16]。既然他们都能定位到核内,说明他们的信号肽序列可能只是无法被现有的算法所预测到,或者他们还需要和其他具有核定位信号序列的蛋白发生相互作用才能定位到核内。有些HOX 蛋白需要同其他蛋白质形成异源二聚体才能进入到核内,例如HOX 家族的KNOTTED1-LIKE homeobox(KNOX)需要和BLH 蛋白通过MEINOX 和BELL 这两个结构域相互作用形成复合体才能一起进入到核内[17]。
研究表明,Os WOX3 A 具有转录激活活性,并且其氨基端的HD和羧基端的WUS-box 是Os WOX3 A发挥转录激活活性所必需的结构[18]。目前只有这一个WOX 转录因子有转录激活活性试验研究报道。
3 WOX家族系统进化
根据系统进化树分析,拟南芥WOX 蛋白家族WUS支包含WUS 和WOX 1~WOX 7 共8 个成员,中间支包括WOX8、WOX9、WOX11 和WOX12,WOX10、WOX13 和WOX14 被划分到远古支[2](图1)。目前,在植物界中已经找到了许多WOX 基因,对该家族基因的起源和进化历史进行了初步研究[8]。处于不同分类地位的植物类群所包含的WOX 蛋白在3支中的分布差异明显,所有植物均含有远古支WOX 蛋白,然而绿藻(Chlorell a)和非维管束植物苔藓Physcomitrell a patens 等仅含有远古支WOX 蛋白,仅在较高等的蕨类植物和种子植物中发现有中间支蛋白[19],而WUS 支WOX 蛋白则是高等的种子植物所特有的[20]。
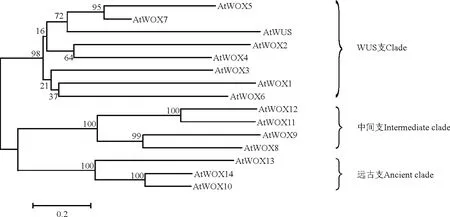
图1 拟南芥WOX蛋白家族的系统进化树Fig.1 Phylogenetic relationship of Ar abidopsis WOX family proteins
从绿藻到开花植物这些亲缘关系相差很大的真核生物都含有WOX 基因,说明这个家族的起源至少发生在真核生物分化前,系统进化的结果也表明在绿藻和陆生植物发生分化前,他们的最近共同祖先(Last Co mmon Ancestor)已至少含有一个WOX基因,WOX 家族基因在远古支最早起源,随后各物种的远古支成员们独立进化[8]。中间支WOX 蛋白成员不仅包括种子植物,同时包括一些低等的维管植物如石松(Lycopodium)、卷柏(Sel aginell a tamariscina)和地衣类(Lichen)等,说明维管植物家族进化起源的最近共同祖先已经含有中间支WOX 基因[20]。低等植物如绿藻仅含有远古支的WOX 基因,而高等种子植物不仅含有远古支的WOX 基因,还含有中间支和WUS 支的基因,说明远古支的WOX 基因代表最古老的成员,而WUS支和中间支的成员是在进化过程中由远古支的成员扩增后分化而来的[8]。
Nar d mann和Werr[21]认为裸子植物和被子植物发生分化前,WUS支的基因就已经发生了扩增。并且种子植物的最近共同祖先至少已经包含WOX2、WOX3 和WOX4 的直系同源基因,以及WUS/WOX5 的直系同源基因。WOX2、WOX3 和WOX4 功能分化后作用部位分别是胚体、边界分生组织和维管束系统。
有研究者在银杏(Ginkgo bil oba)、买麻藤(Gnetum gnemon)和樟子松(Pinus syl vestris)这3种裸子植物中都只发现有对应拟南芥WUS 的基因,没有对应WOX5 的基因;而即使是较古老的被子植物无油樟(Amborell a trichopoda)和睡莲(Ny mphaea j a mesoniana)中都既有WUS 又有WOX5 基因,推测WOX5 是在被子植物和裸子植物分离后,在被子植物中独自通过基因复制和功能分化后产生的[20]。然而Hed man等[22]在裸子植物白皮松(Pinus alba)中发现同时存在WOX5 和WUS 基因,上述前三种裸子植物都尚未完成全基因组测序,因此他们是否真的没有对应的WOX5 基因尚不能确定。
WOX1/STF 在所有测序的双子叶植物中均有一到两个成员,然而在水稻(Or yza sativa)、玉米(Zea mays)、高粱(Sor ghum bicolor)、小麦(Triticu m aestivu m)、大麦(Hor deu m vul gare)等其他单子叶植物中都没有发现与之明显对应的直系同源基因,这说明它可能是在单子叶和双子叶植物分离后,在双子叶植物中独立进化产生的[23]。
4 WOX转录因子的生物学功能
WOX 基因家族的成员几乎在植物的各个器官中都有表达,其主要表达部位位于各器官分裂旺盛的细胞群中。该家族基因在植物关键发育时期如胚的形成、干细胞稳定性和器官的形成的过程中发挥重要调控作用。这些功能的发挥与他们能够促进细胞分裂或阻止未成熟细胞的提前分化密不可分[2]。WOX 基因家族各成员的表达部位和所发挥的功能见表1。
4.1 远古支
WOX13 在拟南芥初生根和侧根的发生和发育过程中表达,在花序和花芽中也有较高表达,参与侧根的发育和花器官的形成。突变体侧根数量减少,角果发育异常。WOX14 也属于远古支,但仅存在于十字花科(Brassicaceae),相比较WOX13,WOX14 的表达仅限于侧根形成的早期阶段和花药的发育。WOX10 仅在拟南芥基因组中发现,其他物种中没有发现与他明显对应的同源基因。拟南芥幼苗中,即使高循环的PCR 反应仍不能检测到WOX10 的转录本的存在,已有的表达谱数据库中也没有检测到该基因转录本的表达,推测该基因可能是一个假基因(Pseudogene)[19]。
4.2 中间支
WOX8 和WOX9 一起参与调控拟南芥从受精卵发育成胚的过程。在拟南芥胚的形成过程中,WOX2 和WOX8 首先在卵细胞和受精卵中共同表达,受精卵第1 次不对称分裂后,WOX8 和WOX9只在基部子细胞中表达。在典型八细胞期,将形成下胚轴和部分根的中间区域只表达WOX9 和少量的WOX2;将形成根分生组织的胚根只表达WOX8和WOX9;胚柄细胞只表达WOX8[1,24]。除了在胚的早期发育过程中发挥作用外,WOX9/STI MPY还在SA M 和叶原基中有表达,对维持茎尖WUS 和CLAVATA3 的表达也是必须的。另外WOX9 在根尖分生组织中表达,能够促进根部细胞的增殖。突变体stip 表现出腋芽和叶原基的发生和生长缺陷,初始根的生长和侧根的发生受到明显抑制[25]。STPL/WOX8还能在胚发育过程中通过调节CUPSHAPED COTYLEDON(CUC)基因的表达控制子叶叶缘的形态建成[26]。
水稻DWT1 是拟南芥WOX8/9 的同源基因,影响水稻节间细胞的增殖和伸长,对控制水稻主枝和分蘖生长的一致性起重要作用[15]。EVERGREEN 是聚散矮牵牛花(Cy mose petunia)中对应拟南芥WOX9 的转录因子,它能够控制花序的构型,促进侧生花序分生组织细胞的增殖。EVG 在聚伞花序进化过程中处于重要地位[27]。裸子植物挪威云杉(Picea abies)中,Pa WOX2 和Pa WOX8/9也在受精卵和体胚的早期发育过程中高表达,控制体胚的早期发育,说明这一机制在裸子植物和被子植物中比较保守[28]。
拟南芥中,WOX11 和WOX12 功能重叠。他们一起参与外植体根(Adventitious r oot)的器官发生,然而侧根的发生却不受这些影响[29]。水稻中Os WOX11 参与激活冠状根的发生和生长,是一个不定根生长发育的关键调节基因。WOX11 首先在突出的冠状根表达,随后在根分生组织的细胞分裂区表达。wox11 的缺失突变体或者降低WOX11 的表达都会使冠状根数目减少和生长速率下降,而过量表达WOX11 则使冠状根提早产生,冠状根的生物量也显著增加,同时在高位茎节甚至小花基部也产生不定根[13]。
4.3 WUS支
WUSCHEL 基因是最早发现的属于WOX 家族中的基因,wus突变体的茎尖和花序分生组织异常,wus突变体不断产生有缺陷的茎尖分生组织,随后异常终止,形成混乱的成簇状叶片[3]。WUS 基因在茎尖分生组织的中心区细胞表达,是形成和维持茎顶端分生组织所必需的;WUS 基因还参与到子房和花药发育过程[30-31]。在根中异位表达WUS,能够在根上诱导产生茎尖分生组织,进而产生叶片,并产生花序[32]。WUS-box结构域是WUS 发挥其每一项功能都必需的,当这一功能域发生突变后,WUS 原有的所有功能都无法正常发挥[6]。

表1 WOX转录因子的表达部位和功能Table 1 Summary of WOX transcription f actor expression domains and f unction
与WUS 在SA M 表达,对维持SAM 稳定性起重要作用对应的是,WOX5 在根尖的静止中心表达,对维持根尖分生组织干细胞的稳定性起重要作用;拟南芥wox5-1 突变体中,位于静止中心区的细胞形态异常,体积变大,而且邻近的中柱干细胞体积变得更大,说明这些细胞已经发生了分化[33]。WOX5 在子叶原基和侧根原基发生和向外生长时也有表达,说明它在这些组织发育过程中也发挥着作用。WOX5 与WUS 在维持干细胞稳定性方面所起的调控作用是同等的或者说是可互换的,如在WUS 编码区前面加上WOX5 的启动子,就可以恢复wox5 突变体的表型;在WOX5 的编码区前面加上WUS 的启动子也可以恢复wus 突变体SA M 异常的表型,但还是不能恢复wus突变体在花器官方面的缺陷[33]。
WOX1 参与调控叶片的横向生长,影响叶片的宽度。这一功能在不同物种中较保守。该基因在不同物种中的直系同源基因,如矮牵牛(Petunia hybrida)中的MA W、蒺藜状苜蓿(Medicago tr uncatul a)中的STF、烟草(Nicotiana tabacu m)中的LAM 以及拟南芥中WOX1 和PRS 都参与到调控叶片的横向生长。在蒺藜状苜蓿中,st f 突变体的叶片横向生长导致叶脉发育严重异常,叶片中脉变细,侧脉减少。烟草l am1 突变体,由于缺乏叶肉细胞的分化,叶片变成细条状[34]。矮牵牛MA W 基因整合了拟南芥中At WOX1 和At WOX3 两个基因的功能,参与到叶片的横向生长和花器官的融合发育[35]。拟南芥wox1 敲除突变体中,没有观察到明显的异常表型,说明还存在与其功能重叠的基因[35],拟南芥中WOX1 和WOX3 一起共同调控叶片的横向生长[36]。
拟南芥的PRESSED FLOWER (PRS)基因,也称WOX3,参与调控两侧花瓣的发育。突变体花瓣窄小,有时甚至缺失。PRS 在花序分生组织的L1、L2和L3层细胞中均表达,其中在L1层细胞中表达量最高,PRS 在茎尖分生组织外周细胞中表达,使邻近细胞分化成营养器官和生殖器官的两侧区域。prs1突变体叶片两侧的托叶、侧向的萼片以及雄蕊的变窄或缺失[37]。PRS 过表达则使植株表皮层细胞过度生长,在植株茎杆表面形成许多瘤状突起[9]。
玉米中WOX3 的直系同源基因双突变体ns1和ns2 的叶片变窄,这一表型主要是由于无法招募周围基础细胞以形成叶缘组织而造成的[38]。水稻nal2/3 双突变体,叶片明显变窄,而过表达NAL2/3则会使植株叶片变宽,NAL2 和NAL3 基因是对应WOX3 的两个独立拷贝,单突变体叶片无明显表型变化[17,39]。
WOX2 与WOX8 和WOX9 一起参与到拟南芥胚的形成发育过程,WOX2 最开始在卵细胞和受精卵中都表达,受精卵第一次不对称分裂后,WOX2的表达被限制在顶部子细胞,而WOX8 的表达限制在基部子细胞中;在典型八细胞期,WOX2 在将发育成大部分地上组织的顶部细胞群中表达。WOX2的表达和原胚的正常发育依赖WOX8 在基部子细胞群中的正常表达[40]。WOX2 对胚芽的发育起重要的调控作用,WOX1 和WOX3 在这方面也有冗余的功能,只有当WOX2 功能缺失时,WOX1、WOX3 和WOX5 在这方面的作用才发挥出来[40]。
At WOX4 在植株几乎所有的维管束系统中均有表达,具体表达部位在形成层和原形成层组织,影响植物的次生生长。At WOX4 在茎尖和根尖分生组织中无表达[10]。WOX4 在水稻中不仅参与维管束发育,在花序和花分生组织中也有较高表达。当将WOX4 沉默后,茎尖分生组织发育异常,植株矮小且形状异常,叶片发黄。Os WOX4 是一个调节SA M 稳定性的正向调控因子[41]。对At WOX4 进行RNAi后,叶片、成熟茎和成熟根中的维管束分化的导管和筛管量显著减少,而未分化的组织则过度积累。RNAi植株明显小于野生型。西红柿(Lycopersicon esculentum)中过表达WOX4,其筛管和导管的数量也明显增多[42]。
PFS2/At WOX6 几乎在所有正处于分化状态的器官原基中都有表达,而在成熟组织中无表达,WOX6 过表达影响叶原基和花原基的分化和成熟,说明WOX6 能够抑制器官原基的成熟分化。WOX6 还参与调控子房的发育,作用机制是通过调控子房壁细胞的增殖和胚囊母细胞的分化。p f s2突变体的子房和叶片都发育异常[12]。WOX6 还影响植物的低温耐受性,突变体植株hos9 生长缓慢,并且变得更加不耐低温,然而其表达水平不受低温刺激而变化[43]。
5 WOX转录因子的表达调控机制
根据已有的研究结果,大多数WOX 基因功能的发挥或者是因为他们能够促进细胞的分裂或者是能够阻止未成熟细胞的分化。一些WOX 基因的功能的发挥具有非细胞特异性,即表达部位与发挥作用的部位不一致。例如WUS 和WOX5 能非细胞特异性地控制干细胞的稳定性;水稻DWT1 能非细胞特异性地调节节间细胞的增殖和伸长;拟南芥胚发育过程中WOX8 和WOX9 能非细胞特异性地调节顶部细胞群的分化[1]。
WUS 在茎尖分生组织中通过参与一个由WUS 基因和CLAVATA(CLV)基因组成的负反馈环以维持茎尖分生组织中干细胞的稳定性。在茎顶端分生组织的起始发育过程中,WUS 的表达逐渐局限于中心区原体的一部分细胞中。WUS、CLV1和CLV3 形成一个反馈环,以维持茎顶端分生组织中心区的大小。WUS 在分生区原体的表达,诱导CLV3 在上层原套中表达,产生CLV3 蛋白,由CLV3蛋白的作用,激活原体中的CLV1 信号途径[44],反过 来,CLV1 的 激 活,又限制了WUS 的 表达区域[45]。有研究者发现WUS 通过直接参与到细胞分裂素的信号网络中而调控分生组织功能,WUS能够直接与ARR7/15 发生作用,并抑制其表达[46-47]。
相比较在SA M 中的情况,在花序分生组织(F M)中,干细胞的稳定性非常短暂,一旦花器官发生后,FM 的活力就停止,这一过程依赖WUS 和AGAMOUS(AG)的相互作用。在花的发育过程中,WUS能够促进AG 的表达,然而AG 通过直接与WUS 结合并抑制WUS 的表达来终止花序分生组织的命运,两者形成的一个负反馈环可以共同调控FM 的活性[48-49]。
WUS-box这一具有转录抑制功能的结构域,不仅是WUS发挥其每一项功能所必须的,而且在其他WOX 蛋白中也发挥重要的作用。研究发现,在矮牵牛中WUS-box是STF 发挥其调控叶片横向生长的功能所必需的。在STF 启动子下,拟南芥WUS支里,所有具有WUS-box的成员(At WOX7除外,At WOX7无WUS-box)均可恢复l am1 突变体的窄叶表型。而中间支和远古支的成员因为都没有完整的WUS-box结构域都不具上述功能。在At-WOX7、中间支和远古支蛋白后面额外增加一个WUS-box或者其他的外源转录抑制结构域(repressor domain)也可以恢复l am1 叶片的横向生长[50]。
激素在植物生长发育过程中发挥重要作用,如生长素、细胞分裂素和脱落酸等。已有较多试验结果表明,很多WOX 基因都与某些激素存在互作,共同调控植物的生长发育。例如,在WOX1 的同源基因stf 和l am1 突变体中,植株体内生长素合成减少。而过表达STF 则导致植株体内生长素和细胞分裂素含量明显提高。STF 可能通过调控生长素和细胞分裂素的平衡以控制叶片的横向生长[34]。水稻Os WOX11 的表达受外源生长素和细胞分裂素的诱导,参与激活冠状根的发生和生长[13]。在拟南芥胚的发育过程中,WOX2 能促进生长素转运蛋白基因PI NFORMWD1(PI N1)的表达,使生长素集中到向根的一端和正在发育的胚的子叶顶端,调控胚芽的发育[40]。分别外源施加IAA、NAA 和6-BA后,水稻植株体内的Os WOX11 基因在1 h 的表达量就有显著提高,其中在IAA 和NAA 诱导下的变化最显著[51]。
大部分水稻WOX 基因的表达水平都受到一种或多种非生物胁迫的影响。例如,在干旱处理下,几乎所有WOX 基因的表达水平在12 h均有明显的提升;NaCl处理能诱导Os WOX3 和Os WOX5 的表达;低温处理能提升Os WOX9B 和Os WOX12B 的表达[51]。
WOX 转录因子还能与其他转录因子发生相互作用。如水稻中WOX3能够抑制YAB3 的表达,过表达WOX3 植株与YAB3 的RNAi植株表型相同,他们共同调控水稻叶片的发育[52];在胚的早期发育阶段,WOX8 和其功能重叠基因WOX9 一起,在受精卵、基部子细胞和下胚轴细胞中被WRKY2转录因子激活[53]。
6 总结及展望
WOX 基因大多是在分生组织发挥作用,不管是根中、茎中、叶中还是花中的分生组织。他们的功能都是控制分生组织的分化,作用机制是促进细胞的分裂或者是抑制细胞的提前分化。WOX 基因之间功能的分化,很多都是由于启动子的分化,导致表达部位不一样,进而使不同基因在不同部位发挥作用,例如有些WOX 基因之间,只要改变启动子,就可以部分甚至完全互补原有基因的功能。如将WUS 的编码序列连上WOX3 的启动子,就可以完全互补WOX3 的功能。在STF 启动子下,所有具有WUS-box结构域的WOX 基因均可恢复stf 的窄叶表型。有些WOX 基因间的功能存在冗余,将其中单个WOX 基因敲除后,并不会出现明显的表型变化,如WOX1[35]。
目前大多数有关WOX 基因的研究只有功能报道,他们所参与的调控网络及所处的信号通路依然知之甚少,相关的研究对加深WOX 基因功能的理解有十分重要的意义。从已有的关于WOX 基因家族的文献报导来看,大部分研究都集中在模式植物拟南芥和水稻中,在其他物种中的研究相对较少。鉴于WOX 家族基因在植物关键发育时期发挥重要作用,对各器官的形态建成有如此重要的作用,更重要的是同一个WOX 基因在不同物种中所发挥的作用也不近相同。因此,在其他物种中开展WOX 陋就简家族基因功能的研究是有必要的。
目前有关WOX 基因的研究主要还是集中在生长发育方面。已有的研究表明,该家族基因在植物地上部分和地下部分的形态建成过程中发挥重要调控作用。WOX 基因在控制植物整体形态建成方面的作用,如叶片大小[34],对提高作物地上部分的生物量,培育高产牧草新品种具有十分重要的指导意义。有关该家族基因响应非生物胁迫方面的研究相对较少,植物的生长发育必然要受到外部环境的影响,植物在受到逆境胁迫时,必然要调整或者改变自身的形态建成,以更好地适应逆境环境。因此推测该家族必然有能够参与响应胁迫的基因,寻找到这样一些基因,并探索其作用具体的分子机制,将是一项非常有意义的研究,这也将为培育抗逆性强的作物新品种提供重要参考。
致谢:该论文是第二届全国草业生物技术大会评选出的优秀论文,并得到中国草业生物技术专业委员会提供的版面费支持。
[1] Haecker A,Gross-Hardt R,Geiges B,Sarkar A,Breuninger H,Herr mann M,Laux T.Expression dynamics of WOX genes mark cell fate decisions during early embryonic patterning in Arabidopsis thaliana[J].Develop ment,2004,131(3):657-668.
[2] van der Graaff E,Laux T,Rensing S A.The WUS homeobox-containing(WOX)protein family[J].Genome Biology,2009,10(12):248.
[3] Laux T,Mayer K F,Berger J,Jurgens G.The WUSCHEL gene is required f or shoot and floral meristem integrity in Arabidopsis[J].Develop ment,1996,122(1):87-96.
[4] Mukherjee K,Brocchieri L,Bür glin T R.A co mprehensive classification and evolutionar y analysis of plant ho meobox genes[J].Molecular Biology and Evolution,2009,26(12):2775-2794.
[5] Ariel F D,Manavella P A,Dezar C A,Chan R L.The true story of the HD-Zip family[J].Trends in Plant Science,2007,12(9):419-426.
[6] Ikeda M,Mitsuda N,Oh me-Takagi M.Arabidopsis WUSCHEL is a bif unctional transcription factor that acts as a repressor in stem cell regulation and as an activator in floral patter ning[J].The Plant Cell,2009,21(11):3493-3505.
[7] Paponov I A,Teale W,Lang D,Paponov M,Reski R,Rensing S A,Pal me K.The evolution of nuclear auxin signalling[J].BMC Evolutionary Biology,2009,9(1):126.
[8] Lian G,Ding Z,Wang Q,Zhang D,Xu J.Origins and evolution of WUSCHEL-Related homeobox protein family in plant kingdom[J].The Scientific World Journal,2014(2):983-990.
[9] Matsu moto N,Okada K.A ho meobox gene,PRESSED FLOWER,regulates lateral axis-dependent develop ment of Ar abidopsis flowers[J].Genes &Develop ment,2001,15(24):3355-3364.
[10] Hirakawa Y,Kondo Y,Fukuda H.TDIF peptide signaling regulates vascular stem cell proliferation via the WOX4 homeobox gene in Arabidopsis[J].The Plant Cell,2010,22(8):2618-2629.
[11] Mayer K F,Schoof H,Haecker A,Lenhard M,Jürgens G,Laux T.Role of WUSCHEL in regulating stem cell fate in the Ar abidopsis shoot meristem[J].Cell,1998,95(6):805-815.
[12] Park S O,Zheng Z,Oppenhei mer D G,Hauser B A.The PRETTY FEW SEEDS2 gene encodes an Arabidopsis homeodomain protein that regulates ovule develop ment[J].Develop ment,2005,132(4):841-849.
[13] Zhao Y,Hu Y,Dai M,Huang L,Zhou D X.The WUSCHEL-related ho meobox gene WOX11 is required to activate shoot-bor ne crown root develop ment in rice[J].The Plant Cell,2009,21(3):736-748.
[14] Zhang Y,Wu R,Qin G,Chen Z,Gu H,Qu L J.Over-expression of WOX1 leads to defects in meristem develop ment and polyamine homeostasis in Arabidopsis[J].Journal of Integrative Plant Biology,2011,53(6):493-506.
[15] Wang W,Li G,Zhao J,Chu H,Lin W,Zhang D,Wang Z,Liang W.DWARF TILLER1,a WUSCHEL-Related ho meobox transcription factor,is required for tiller gr owth in rice[J].PLoS Genetics,2013,10(3):1340.
[16] Liu B,Wang L,Zhang J,Li J,Zheng H,Chen J,Lu M.WUSCHEL-related ho meobox genes in Popul us tomentosa:Diversified expression patter ns and a f unctional si milarity in adventitious root for mation[J].BMC Geno mics,2014,15(1):296.
[17] Di Giacomo E,Iannelli M A,Frugis G.TALE and shape:How to make a leaf different[J].Plants,2013,2(2):317-342.
[18] Cho S H,Yoo S C,Zhang H,Pandeya D,Koh H J,Hwang J Y,Ki m G T,Paek N C.The rice narr ow leaf 2 and narrow leaf 3 loci encode WUSCHEL-related ho meobox 3 A(Os WOX3 A)and f unction in leaf,spikelet,tiller and lateral root develop ment[J].New Phytologist,2013,198(4):1071-1084.
[19] Deveaux Y,Toffano-Nioche C,Claisse G,Thareau V,Morin H,Laufs P,Moreau H,Kreis M,Lechar ny A.Genes of the most conserved WOX clade in plants affect root and flower develop ment in Arabidopsis[J].BMC Evolutionary Biology,2008,8(1):291.
[20] Nar d mann J,Reisewitz P,Werr W.Discrete shoot and root stem cell-pro moting WUS/WOX5 f unctions are an evolutionar y innovation of angiosper ms[J].Molecular Biology and Evolution,2009,26(8):1745-1755.
[21] Nard mann J,Werr W.Sy mplesiomorphies in the WUSCHEL clade suggest that the last common ancestor of seed plants contained at least four independent stem cell niches[J].The New Phytologist,2013,199(4):1081-1092.
[22] Hed man H,Zhu T,von Ar nold S,Sohlber g J J.Analysis of the WUSCHEL-related ho meobox gene family in the conifer picea abies reveals extensive conser vation as well as dynamic patter ns[J].BMC Plant Biology,2013,13(1):89.
[23] Tadege M,Lin H,Niu L,Mysore K S.Control of dicot leaf blade expansion by a WOX gene,STF[J].Plant Signal &Behavior,2011,6(11):1861-1864.
[24] Zhang Z,Laux T.The asy mmetric division of the Arabidopsis zygote:From cell polarity to an embryo axis[J].Sexual Plant Reproduction,2011,24(2):161-169.
[25] Wu X,Dabi T,Weigel D.Requirement of ho meobox gene STI MPY/WOX9 for Ar abidopsis meristem gr owth and maintenance[J].Current Biology,2005,15(5):436-440.
[26] Lie C,Kelsom C,Wu X.WOX2 and STI MPY-LI KE/WOX8 pro mote cotyledon boundar y for mation in Ar abidopsis[J].Plant Jour nal,2012,72(4):674-682.
[27] Rebocho A B,Bliek M,Kusters E,Castel R,Procissi A,Roobeek I,Souer E,Koes R.Role of EVERGREEN in t he develop ment of the Cy mose Petunia inflorescence[J].Develop mental Cell,2008,15(3):437-447.
[28] Palovaara J,Hallber g H,Stasolla C,Hak man I.Co mparative expression patter n analysis of WUSCHEL-rel ated homeobox 2(WOX2)and WOX8/9 in developing seeds and somatic embr yos of t he gy mnosper m Picea abies[J].New Phytologist,2010,188(1):122-135.
[29] Liu J,Sheng L,Xu Y,Li J,Yang Z,Huang H,Xu L.WOX11 and 12 are involved in the first-step cell fate transition during de novo r oot or ganogenesis in Ar abidopsis[J].The Plant Cell,2014,26(3):1081-1093.
[30] Gross-Har dt R,Lenhar d M,Laux T.WUSCHEL signaling f unctions in interregional co mmunication during Ar abidopsis ovule develop ment[J].Genes &Develop ment,2002,16(9):1129-1138.
[31] Deyhle F,Sar kar A K,Tucker E J,Laux T.WUSCHEL regulates cell differentiation during anther develop ment[J].Develop mental Biology,2007,302(1):154-159.
[32] Gallois J L,Nora F R,Mizukami Y,Sablowski R.WUSCHEL induces shoot stem cell activity and develop mental plasticity in the root meristem[J].Genes &Develop ment,2004,18(4):375-380.
[33] Sar kar A K,Luijten M,Miyashi ma S,Lenhard M,Hashi moto T,Nakaji ma K,Nakaji ma K,Scheres B,Heidstra R,Laux T.Conserved factors regulate signalling in Ar abidopsis thaliana shoot and root stem cell organizers[J].Nature,2007,446:811-814.
[34] Tadege M,Lin H,Bedair M,Ber bel A,Wen J,Rojas C M,Niu L,Tang Y,Su mmer L,Rater P,Mc Hale A N,Madueño F,Mysore K S.STENOFOLIA regulates blade outgr owth and leaf vascular patter ning in Medicago tr uncatul a and Nicotiana syl vestris[J].The Plant Cell,2011,23(6):2125-2142.
[35] Vandenbussche M,Horst man A,Zethof J,Koes R,Rijpkema A S,Gerats T.Differential recruit ment of WOX transcription factors for lateral develop ment and or gan f usion in Petunia and Ar abidopsis[J].Plant Cell,2009,21(8):2269-2283.
[36] Nakata M,Matsumoto N,Tsugeki R.,Rikirsch E,Laux T,Okada K.Roles of the middle domain-specific WUSCHEL-rel ated homeobox genes in early develop ment of leaves in Ar abidopsis[J].Plant Cell,2012,24(2):519-535.
[37] Shi mizu R,Ji J,Kelsey E,Ohtsu K,Schnable P S,Scanlon M J.Tissue specificity and evolution of meristematic WOX3 f unction[J].Plant Physiology,2009,149(2):841-850.
[38] Nard mann J,Ji J,Werr W,Scanlon M J.The maize duplicate genes narrow sheath1 and narrow sheath2 encode a conserved homeobox gene f unction in a lateral domain of shoot apical meristems[J].Develop ment,2004,131(12):2827-2839.
[39] Ishi wata A,Ozawa M,Nagasaki H,Kato M,Noda Y,Yamaguchi T,Nosaka M,Shi mizu-Sato S,Nagasaki A,Maekawa M,Hirano HY,Sato Y.Two WUSCHEL-rel ated homeobox genes,narrow leaf 2 and narrow leaf 3,control leaf width in rice[J].Plant and Cell Physiology,2013,54(5):779-792.
[40] Breuninger H,Rikirsch E,Her mann M,Ueda M,Laux T.Differential expression of WOX genes mediates apical-basal axis f or mation in the Ar abidopsis embryo[J].Develop mental Cell,2008,14(6):867-876.
[41] Oh mori Y,Tanaka W,Koji ma M,Sakakibara H,Hirano H Y.WUSCHEL-RELATED HOMEOBOX4 is involved in meristem maintenance and is negatively regulated by the CLE gene FCP1 in rice[J].Plant Cell,2013,25(1):229-241.
[42] Ji J,Strable J,Shi mizu R,Koenig D,Sinha N,Scanlon M J.WOX4 pro motes procambial develop ment[J].Plant Physiology,2009,152(3):1346-1356.
[43] Zhu J,Shi H,Lee B H,Damsz B,Cheng S,Stir m V,Zhu J K,Hasegawa P M,Bressan R A.An Ar abidopsis ho meodomain transcription factor gene,HOS9,mediates cold tolerance through a CBF-independent pathway[J].Proceedings of the National Academy of Sciences,2004,101(26):9873-9878.
[44] Rojo E,Shar ma V K,Kovaleva V,Raikhel N V,Fletcher J C.CLV3 is localized to the extracellular space,where it activates the Ar abidopsis CLAVATA stem cell signaling path way[J].The Plant Cell,2002,14(5):969-977.
[45] Brand U,Fletcher J C,Hobe M,Meyerowitz E M,Si mon R.Dependence of stem cell fate in Ar abidopsis on a feedback loop regulated by CLV3 activity[J].Science,2000,289:617-619.
[46] Leibfried A,To J P,Busch W,Stehling S,Kehle A,Demar M,Kieber J J,Loh mann J U.WUSCHEL controls meristem f unction by direct regulation of cytokinin-inducible response regulators[J].Nature,2005,438:1172-1175.
[47] 徐云远,种康.植物干细胞决定基因WUS 的研究进展[J].植物生理与分子生物学学报,2006,31(5):461-468.
[48] Lenhar d M,Bohnert A,Jürgens G,Laux T.Ter mination of stem cell maintenance in Ar abidopsis floral meristems by interactions bet ween WUSCHEL and AGA MOUS[J].Cell,2001,105(6):805-814.
[49] Liu X,Ki m Y J,Müller R,Yu mul R E,Liu C,Pan Y,Cao X,Goodrich J,Chen X.AGAMOUS ter minates floral stem cell maintenance in Ar abidopsis by directly repressing WUSCHEL through recruit ment of Polycomb Group proteins[J].The Plant Cell,2011,23(10):3654-3670.
[50] Lin H,Niu L,Mc Hale N A,Ohme-Takagi M,Mysore K S,Tadege M.Evolutionarily conserved repressive activity of WOX proteins mediates leaf blade outgrowth and floral organ develop ment in plants[J].Proceedings of the National Academy of Sciences,2013,110(1):366-371.
[51] Cheng S,Huang Y,Zhu N,Zhao Y.The rice WUSCHEL-rel ated homeobox genes are involved in reproductive or gan develop ment,hor mone signaling and abiotic stress response[J].Gene,2014,549(2):266-274.
[52] Dai M,Hu Y,Zhao Y,Liu H,Zhou D X.A WUSCHEL-LI KE HOMEOBOX gene represses a YABBY gene expression required for rice leaf develop ment[J].Plant Physiology,2007,144(1):380-390.
[53] Ueda M,Zhang Z,Laux T.Transcriptional activation of Arabidopsis axis patterning genes WOX8/9 links zygote polarity to embr yo develop ment[J].Develop mental Cell,2011,20(2):264-270.

