兔短阵室性心动过速心肌病模型的建立
曾向辉,周小华,孙 翔,凌 静,卿艳云,张 翼
(1.长沙市中医医院(长沙市第八医院)心内科,湖南 长沙 410100;2.湖南师范大学第一附属医院心内科,湖南 长沙 410005)
兔短阵室性心动过速心肌病模型的建立
曾向辉1,周小华1,孙 翔1,凌 静1,卿艳云1,张 翼2
(1.长沙市中医医院(长沙市第八医院)心内科,湖南 长沙 410100;2.湖南师范大学第一附属医院心内科,湖南 长沙 410005)
目的 探讨建立兔短阵室性心动过速心肌病模型方法。方法15只雄性新西兰兔。在无X线、微创、静脉下用标测电极行短阵室速刺激右心室建立心动过速性心肌病动物模型。用10极冠状窦电极,经改良5F桡动脉鞘,经右侧前腔静脉送至右心室,连接程序刺激仪,起搏右心室。结果起搏1周后心脏彩超检查证实左心室舒张末内径扩大,左心室射血分数降低,血清B型脑利钠肽(BNP)、基质金属蛋白酶9(MMP-9)升高、金属蛋白酶抑制剂1(TIMP-1)下降。HE染色显示心肌结构排列紊乱,细胞间质炎性浸润。电镜下显示线粒体肿胀,甚至溶解、破坏,Z线模糊,闰盘结构显示不清。3周后再复查心脏彩超、血清BNP、MMP-9、TIMP-1,心脏射血分数(EF)、短轴缩短率(FS)均大致恢复起搏前水平。结论无X线、微创静脉下用标测电极行短阵室速刺激右心室建立心动过速性心肌病动物模型简单可行。
心动过速性心肌病;短阵室性心动过速;B型脑钠肽;兔;模型
为了更好地进行心动过速性心肌病(Tachycardia-induced cardiomyopathy,TIC)的基础和临床研究,需要有简单易行且时间较短的动物模型的制作方法。早期的心动过速性心肌病模型制作局限于大动物,需在X线下操作、开胸手术、需要呼吸机辅助通气等,均为持续性室速的大动物模型,需植入起搏电极及脉冲发生器,不仅费用昂贵,操作复杂,而且使实验者过多的暴露在X线下,对实验者身体不利,造成不必要的损害,浪费大量的人力、物力、财力等资源,对实验的进展造成极大的不利影响[1-2]。目前对短阵室速能否成功制作TIC小动物模型,尚未见相关报道。本研究首次通过无X线、非开胸静脉下用标测电极行程序刺激右心室建立短阵室速性心肌病动物模型。
1 材料与方法
1.1 研究对象 从长沙市天勤生物技术有限公司购15只新西兰兔,普通级,均为雄性,体重(2.5±0.2)kg,SCXK号码(湘2009-0012),SYXK号码(湘2010-0013),于湖南省人民医院动物实验室开展实验。将其按随机数字表划分为三组,第一组:5只,损伤未起搏组;第二组:5只,起搏1周后处死;第三组:5只,起搏1周观察2周组。各组在月龄、体重上均无统计学差异,具有可比性。
1.2 研究方法
1.2.1 术前准备 所有动物术前禁食12 h,禁饮4 h,称重,10%的水合氯醛(湖南省儿童医院制剂室生产)以4ml/kg腹腔内注射,5~10min后刺激角膜,角膜反射消失后在右颈部常规备皮、消毒铺巾。相关器械、器材络合碘浸泡消毒1 h以上。
1.2.2 手术过程 严格按外科无菌操作原则在右颈部做一长约3cm切口,从右侧前腔静脉植入5F自制桡动脉鞘,结扎右侧前腔静脉近端和远端,分层缝合,络合碘消毒,无菌敷料覆盖。为防止动物麻醉醒后四肢抓脱敷料及桡动脉鞘:无菌敷料外加宽透明胶带再次包扎,松紧度适宜,以防导致动物窒息死亡;用宽胶带对后肢捆绑,放回笼中饲养。起搏各组按上述步骤植入鞘管后,用500ml配肝素注射液1.25万U的肝素水冲鞘管预防血栓栓塞,常规青霉素80万U肌肉注射抗感染,2次/d。
1.2.3 刺激方法 用10极冠状窦电极(圣犹达公司)经植入桡动脉鞘送至右心室(判断在右心室标准:心电监护上可见室性早搏;拇指和食指触及电极随心脏搏动;有跟频现象),连接程序刺激仪(苏州工业园区东方电子仪器厂,型号:XD-5A),将感知调至最低,电压(3.0±0.5)V;起搏频率为400次/min(正常时260~280次/min,因之前预实验已完成300次/min及500次/min的频率实验,其中前者造模成功时间较长,不利于整个实验时间控制;后者起搏频率太快,死亡率高),起搏右心室,30阵/min,每阵持续10~12个室性早搏,24 h持续约90min。每次刺激完毕将电极退出右心室,但未撤出体外,再次刺激时在清醒状态下重新插入,避免冠状窦电极留置心腔对血流动力学产生影响。整个刺激过程给予持续心电监护(连接心电图机,型号为日本光电工业株式会社ECC-9130型记录仪,用自制的针头插入动物四肢获得心电图形,起搏信号后紧跟宽大畸形的QRS波群,Ⅱ、Ⅲ、aVF导联主波向下即认为有效起搏)。每次刺激后用络合碘消毒切口预防感染。刺激完毕后无菌敷料覆盖,外加宽透明胶带包扎,松紧度适宜,以防导致动物窒息死亡;用宽胶带对后肢捆绑,放回笼中饲养。
1.3 观察指标 分别于术前、术后1周、术后3周观察各组动物心动过速性心肌病发病过程中不同时期的表现,有无术后感染,比较各时期的B型脑利钠肽(BNP)水平的高低,血清中基质金属蛋白酶9 (MMP-9)、金属蛋白酶组织抑制剂1(TIMP-1)的浓度变化,心脏彩色多普勒超声中血液动力学变化及左心室的大小及射血分数的大小的变化,并进行自身对照,利用HE染色方法、电镜分别观察心肌纤维的排列、结构形态变化及心肌细胞超微结构的形态变化。
1.4 统计学方法 采用SPSS17.0分析软件,所有数据均采用均数±标准差(±s)表示,计量资料术前、术后自身比较用成对t检验,各组间比较用成组t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 兔心动过速性心肌病模型建立 三组动物均存活,术后均无明显感染。在起搏4 d后均出现疲倦、乏力、食欲不振(剩下2/3食物)、反应下降(较术前同样刺激反应迟钝)、目光呆滞。起搏1周后所有动物出现有气促,超声显示胸、腹水。但经过2周的观察,上述症状消失,复查心脏彩超示胸腹水消失。
2.2 各组血清学指标比较 所提供的ELISA Kit是典型的夹心法酶联免疫吸附测定试剂盒(ELISA)。所使用同一批次试剂不需定标,使用不同批次试剂盒测定时均重新定标,见表1。
表1 不同时期的血清学指标自身比较(±s)

表1 不同时期的血清学指标自身比较(±s)
注:与术后1、2周比较,aP<0.05;与术后2周比较,bP<0.05;与术前比较,cP>0.05。
项目 术前 术后1周 术后2周 术后3周BNP(pg/ml) MMP-9(ng/ml) TIMP-1(ng/ml)246.0±20.1a1.20±0.02a1.98±0.07a344.5±5.81.67±0.01b1.70±0.01b322.2±5.8 .46±0.021.25±0.03244.0±10.1c1.18±0.01c1.95±0.04c
2.3 心脏彩色多普勒超声 分别于术前、术后1周、术后2周行心脏彩色多普勒超声检查。检查前在心前区备皮,脱毛,清醒状态,左侧卧位,固定四肢。采用的心脏超声仪为日本东芝ALOKa-10型彩色多普勒测绘二维实时超声显像仪,探头发射频率2.5 MHz。取标准胸骨旁左心室长轴切面、心尖五腔观及标准心尖四腔观观察,测量左心室收缩期内径(LviDs)、左心室舒张末内径(LviDd)、左心室收缩末容积(ESV)、左心室舒张末容积(EDV)、短轴缩短率(FS)、E峰、A峰值等参数,连续测3个心动周期取平均值。观察有无心包积液、瓣膜返流、胸水、腹水。操作均由湖南省人民医院彩超室专人在同一台仪器上完成,见表2。
表2 心脏彩色多普勒超声不同时期自身比较(±s)
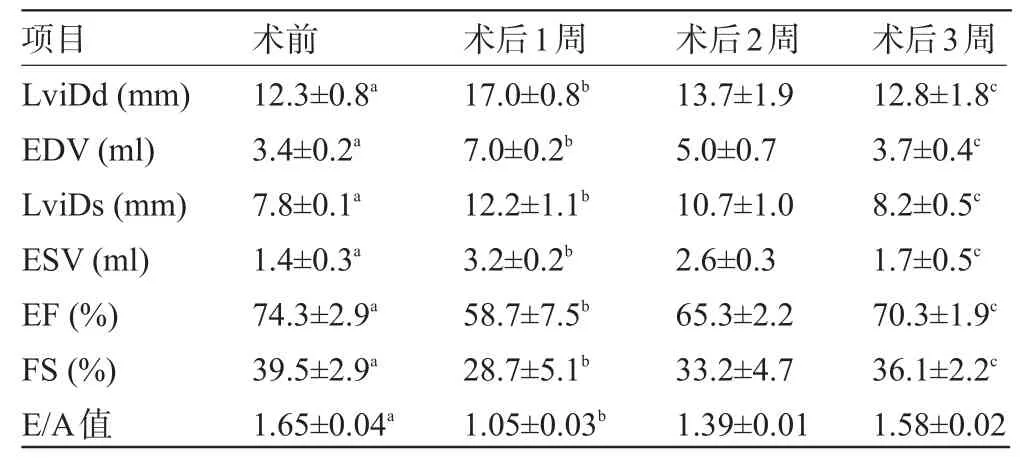
表2 心脏彩色多普勒超声不同时期自身比较(±s)
注:与术前比较,aP<0.05;与术后2周比较,bP<0.05;与术前比较,cP>0.05。
项目术后3周术前 术后1周 术后2周12.8±1.8c3.7±0.4c8.2±0.5c1.7±0.5c70.3±1.9c36.1±2.2c1.58±0.02 LviDd(mm) EDV(ml) LviDs(mm) ESV(ml) EF(%) FS(%) E/A值12.3±0.8a3.4±0.2a7.8±0.1a1.4±0.3a74.3±2.9a39.5±2.9a1.65±0.04a17.0±0.8b7.0±0.2b12.2±1.1b3.2±0.2b58.7±7.5b28.7±5.1b1.05±0.03b13.7±1.95.0±0.710.7±1.02.6±0.365.3±2.233.2±4.71.39±0.01
2.4 组织学改变(HE染色) 损伤未起搏组心肌排列规整,无炎性细胞浸润及心肌纤维断裂、溶解;起搏1周后停止起搏未加处理因素,心肌排列较前紊乱,有灶性炎性细胞浸润,间质纤维少量增生;起搏1周后观察1周心肌排列稍紊乱,可见少量心肌纤维有断裂,有少量炎性细胞浸润,见图1。
2.5 电镜观察 损伤未起搏组右心室心尖部心肌电镜下线粒体饱满,界嵴明显;Z线、M线结构清晰可见,细胞核形态正常,肌丝排列整齐有序;细胞间质正常。起搏1周后右心室心尖部心肌显示线粒体肿胀、空泡样变性,肌丝排列紊乱,Z、M线模糊。起搏1周观察1周。可见Z线、M线较清晰,线粒体体积小,可见空泡样变性,胞浆有水肿,见图2。
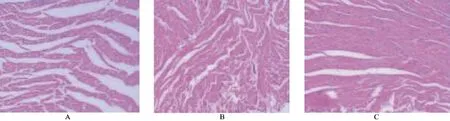
图1 HE染色后在光学镜下1∶100倍观察
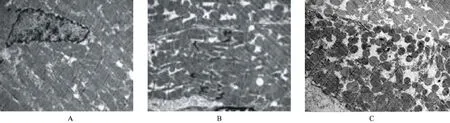
图2 电镜观察(1∶10000)
3 讨 论
3.1 起搏右心室制备心力衰竭模型的优点 心力衰竭动物模型传统的制作方法有:(1)药物注射法:此种方法具有代表性有阿霉素,但动物死亡率高,模型成功周期长,一般需要8~10周;(2)冠脉结扎法:该方法操作较复杂,结扎部位过高容易导致死亡,过低易导致模型失败,且剖胸后动物死亡率高,耗时较长,费用相对偏高。目前心动过速性心肌病的动物模型制作局限在大动物,需在X线下操作、开胸手术、需要呼吸机辅助通气。而TIC在进展为不可逆性心力衰竭之前,终止导致心动过速的病因后在一定时间内则可有心肌结构和功能部分恢复甚至全部逆转[3]。因此及时发现和终止心动过速病因至关重要。而本实验通过无X线、非开胸静脉下用标测电极行程序刺激右心室建立短阵室速性心肌病动物模型周期短,避免实验人员X线照射,且无需开胸手术及呼吸机辅助通气,故简便易行。
3.2 成功制作TIC动物模型 目前临床上TIC尚无统一诊断标准,一般符合以下几点可考虑为TIC:(1)在心动过速发生前左心室功能正常;(2)频繁或者持续心动过速发作后左心室功能进行性损害,并排除其他致病因素;(3)心律失常或心室率控制后心室功能得到改善[4]。
本研究结果显示术前无左心室扩大,心功能下降,经短阵室速起搏1周后出现左心室扩大、射血分数下降、胸腹水等心功能不全表现。在停止起搏1周后,血清学及心脏彩色多普勒超声各指标均有所恢复,胸腹水消失,但较起搏前水平仍较差。可能与致病因素去除时间较短,心肌细胞结构和功能的恢复有限相关;在停止起搏2周后,基本上恢复至起搏前的水平。因此,无论是从器官结构、组织形态、细胞的超微结构上,与心动过速性心肌病的特点相符,符合心动过速性心肌病的诊断标准,说明创建兔心动过速性心肌病的模型成功。既往制作TIC模型大多需要时间较长(4~6周),但本研究短阵室速刺激1周后即可制作成功,可能与一下两点有关:(1)动物心脏小,对外界的室速刺激耐受性低[5];(2)在制作TIC模型时,右心室心尖部起搏,导致双心室的矛盾运动有关[6]。相关机制还需进一步研究。
本研究通过对既往快速起搏右心室方法的改进,运用无X线、微创静脉下用标测电极行程序刺激右心室成功建立短阵室速心肌病动物模型。不仅操作简单,重复性好,而且可避免植入人工起搏器、实验者暴露在X线下,大大地节省了实验费用,对实验的进程有很大的推动作用。为今后的心动过速性心肌病的基础与临床研究提供了有益的探索。
[1]Paslawska U,Gajek J,Kiczak L,et al.Development of porcine model of chronic tachycardia-induced cardiomyopathy[J].Int J Cardiol,2011,153(1):36-41.
[2]白 融,吕加高,卜 军,等.快速心室起搏制备扩张型心肌病心力衰竭犬模型的方法学探讨[J].中国实验动物学报,2004,12(3):159-163.
[3]Kaufman BD,Shaddy RE,Shirali GS,et al.Assessment and management of the failing heart in children[J].Cardiol Young,2008,18 (Suppl3):63-71.
[4]Umana E,Solares CA,Alpert MA.Tachycardia-induced cardiomyopathy[J].Am J Med,2003,114(1):51-55.
[5]Aliot EM,Stevenson WG,Almenaral-Garrote JM,et al.EHRA/ HRS Expert Consensus on Catheter Ablation of Ventricular Arrhythmias:developed in a partnership with the European Heart Rhythm Association(EHRA),a Registered Branch of the European Society of Cardiology(ESC),and the Heart Rhythm Society(HRS);in collaboration with the American College of Cardiology(ACC)and the American Heart Association(AHA)[J].Heart Rhythm,2009,6(6):886-993.
[6]Brenyo A,Goldenberg I,Barsheshet A.The downside of right ventricular apical pacing[J].Indian Pacing Electrophysiol J,2012,12 (3):102-113.
Exploration of a method to establish rabbit models of nonsustained ventricular tachycardia cardiomyopathy.
ZENG Xiang-hui1,ZHOU Xiao-hua1,SUN Xiang1,LING Jing1,QING Yan-yun1,ZHANG Yi2.1.The Hospital of Traditional Chinese Medicine of Changsha(the Eighth Hospital of Changsha),Changsha410100,Hunan,CHINA;2. Department of Cardiology,the First Affiliated Hospital of Hunan Normal University,Changsha410005,Hunan,CHINA
ObjectiveTo explore a effective method to establish rabbit models of nonsustained ventricular tachycardia cardiomyopathy.MethodsFifteen New Zealand rabbits were used in this study.The right ventricle was stimulated with mapping electrode line to create nonsustained ventricular tachycardia byminimally invasive venous technique without X-ray radiation.A10 polar cap of sinus electrode was inserted through modified5F radial artery sheath and the right anterior vena cava to the right ventricle.Then the programming stimulator was connected to pace the right ventricle to create the tachycardia cardiomyopathy animal model.ResultsAfter one week of right ventricular pacing,cardiac ultrasound examination showed enlarged left ventricular end diastolic diameter,reduced left ventricular ejection fraction,increased serum B-type natriuretic peptide(BNP)and matrix metalloproteinase9(MMP-9),and decreased tissue inhibitor of metallopmteinase-1(TIMP-1).HE staining showed myocardial structural derangement andinterstitial inflammatory cell infiltration.Electron microscopy revealed mitochondrial swelling,dissolution,or even lysis and destruction,fuzzy Z line and unclear intercalated discs.Three weeks later,the heart color,serum BNP,MMP-9, TIMP-1,ejection fraction(EF),fraction shortening(FS)in the rabbits recovered to former levels.ConclusionIt is a simple and practical method to establish animal models of tachycardiomyopathy by stimulating animal’s right ventricle with mapping electrode line to create nonsustained ventricular tachycardia underminimally invasive,venous technique without X-ray radiation.
Tachycardiomyopathy;Nonsustained ventricular tachycardia;B-type natriuretic peptide(BNP); Rabbit;Model
R-332
A
1003—6350(2015)16—2347—04
2015-02-08)
10.3969/j.issn.1003-6350.2015.16.0848
张 翼。E-mail:345665560@qq.com