分散液液微萃取—气相色谱—串联质谱快速分析食用油中的酚类抗氧化剂
邢寒竹等
摘 要 基于分散液液微萃取技术和气相色谱串联质谱,建立了一种快速分析食用油中酚类抗氧化剂的新方法。对影响萃取效果的重要因素,如萃取剂种类及体积、分散剂种类及体积和萃取时间等进行了详细优化。优化条件为:500 μL甲醇乙腈(1∶1, V/V)快速注射进3.0 mL 正己烷与1.0 g食用油的混合物中,并振荡萃取10 s 。在优化条件下,方法的线性范围为10~2000 ng/g,检出限为1.5~2.4 ng/g,相对标准偏差为4.0%~8.3%。将本方法应用于4种不同食用油样品的分析,其中3种有酚类抗氧化剂检出,样品加标回收率为81.9%~118%,结果满意。
关键词 分散液液微萃取; 气相色谱串联质谱; 食用油; 抗氧化剂
1 引 言
酚类抗氧化剂,如丁基羟基茴香醚(Butylated hydroxyanisole, BHA)、二叔丁基对甲酚(Butylated hydroxytoluene, BHT) 和叔丁基对苯二酚(TertButylhydroquinone, TBHQ),常被用来延缓食用油中油脂的氧化反应。但研究表明,这些物质被人体摄入会对人体健康具有潜在威胁[1~3]。因此,该类化合物在食品中的使用限值有严格的规定[4],例如,在美国,BHA,BHT和TBHQ允许单独或者混合使用,但添加量应不超过200 mg/kg[5,6];而在欧盟国家,BHA的最大使用量为200 mg/kg,BHT和TBHQ则被禁止使用。因此,建立一种快速灵敏的分析食用油中抗氧化剂的方法是十分必要的。
在分析食用油样品之前,通常需要对食用油进行样品预处理。已有的液液萃取[7,8]和固相萃取[9]等样品预处理方法具有费时、费力、需要大量有毒有机溶剂等缺点[10]。为了克服这些缺点,简化预处理步骤,分散液液微萃取技术(Dispersive liquidliquid micro extraction, DLLME)正逐渐被学者关注[11]。DLLME基于三相溶剂平衡体系,是在分散剂存在的条件下,将萃取剂以微小液滴的形式分散在水溶液样品中,并形成稳定的乳浊液[12]。在这种情况下,萃取剂与样品间存在着极大的接触面积,使目标分析物可以快速的转移至萃取体系中,经过离心后,萃取剂液滴聚集,萃取和浓缩步骤得以同时完成。通常,DLLME主要应用于分析环境水样当中的污染物,而针对食品样品进行的应用研究相对较少。目前,只有少数研究将DLLME应用于食品中污染物的分析[13~15],而将DLLME与GCMS/MS结合,分析食用油中酚类抗氧化剂的研究尚未见报道。
基于DLLME和GCMS/MS,本研究建立了一种快速灵敏的分析食用油中酚类抗氧化剂的新方法。对影响萃取效率的重要因素,如萃取剂种类及体积、分散剂种类及体积和萃取时间等进行了优化。并将本方法应用于多种食用油样品的分析。
2 实验部分
2.1 仪器与试剂
气相色谱三重四级杆质谱联用仪(7890A GC7000B MS,美国安捷伦公司)AB5MS色谱柱(30 m× 0.25 mm × 0.5 μm,美国热电公司)。BHA(>99%)、BHT(>98.5%)和TBHQ(>96%)的标准品购自北京百灵威化学科技有限公司;乙腈、丙酮和正己烷(瑞典欧森巴克环境化学有限公司);甲醇(美国天地公司)。所有实验过程中所使用到的有机试剂均为色谱纯级别。使用标准品配制3种目标物的标准混合储备液,浓度均为1.0 g/L,保存在4 ℃避光环境中。
2.2 气相色谱质谱条件
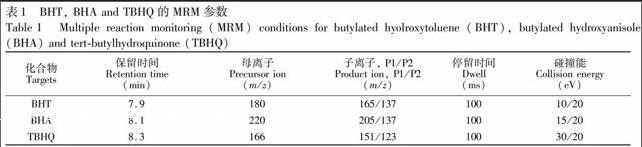
色谱柱初温60 ℃,以20 ℃/min升至220 ℃,保持1 min,再以40 ℃/min升至280℃,总运行时间为10.5 min。离子源温度,230℃;进样口温度,280℃;载气(高纯氦)流速为1.2 mL/min,碰撞气(高纯氮)流速为1.5 mL/min;溶剂延迟时间,7 min。用全扫描(Fullscan)模式对BHA,BHT和TBHQ进行定性分析,定量分析则采用多反应监测(MRM)模式,优化参数如表1所示。
2.3实验步骤
称取1.0 g食用油样品,置于15 mL配有螺旋盖的PE离心试管中。由于食用油粘度较大,在注射萃取剂之前,先加入3 mL正己烷分散剂稀释,增加样品流动性,使目标物更快的由样品转移到萃取剂中。充分混匀后,将500 μL甲醇/乙腈(1∶1, V/V)混合溶液作为萃取剂快速注射进样品中,振荡萃取10 s,然后6000 r/min 离心5 min。离心后,萃取相沉积在试管底部,沉积相体积约为(150±10)μL,用250 μL微量注射器将萃取相转移入400 μL玻璃内插管中待测。
3 结果与讨论
3.1 萃取剂种类和体积
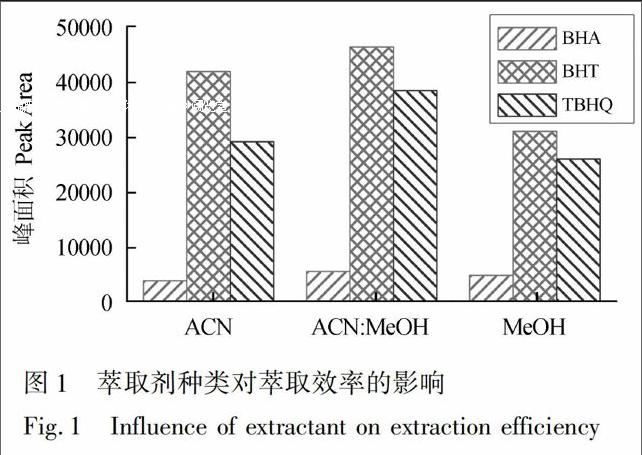
在分散液液微萃取中,合适的萃取剂对于提高目标化合物的萃取效率是至关重要的[16]。萃取剂的性质决定了三相平衡体系的形成: (1)萃取溶剂必须不与样品互溶; (2)目标物在萃取剂中具有一定的溶解度; (3)萃取剂的密度应大于油与分散剂的混合溶液。基于以上条件,本研究选择了甲醇、乙腈及乙醇3种有机溶剂作为萃取剂考察其萃取效果。实验结果表明,当乙醇作为萃取剂时,离心后没有沉积相产生,因此只选择甲醇和乙腈作为萃取剂进行优化。由图1可见,使用甲醇乙腈(1∶1, V/V)混合溶液作为萃取剂的萃取效率比单独使用任何一种溶剂更好,这可能是由于混合后溶剂极性的改变和溶剂诱导的选择性的变化共同导致的。因此,最终以甲醇乙腈(1∶1, V/V)混合溶液作为萃取剂。
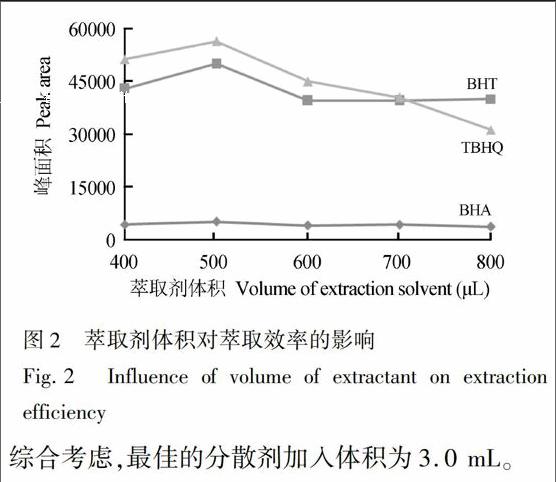
为评价萃取剂体积对萃取效率的影响,在其它实验条件不变的情况下,改变甲醇乙腈(1∶1, V/V)混合溶液的体积进行实验。结果表明,当萃取剂体积小于400 μL时,得到的沉积相液滴过小,这将导致移取萃取相的操作困难。当萃取剂体积在400~800 μL时,3种目标化合物的峰面积随萃取剂体积增加而逐渐增大; 在萃取剂体积为500 μL时, 峰面积达到最大; 萃取剂体积为500~800 μL时, 3种目标化合物的峰面积随萃取体积增大而降低(图2)。最终,甲醇乙腈(1∶1, V/V)萃取剂体积选择为500 μL。endprint
3.2 分散剂种类和体积
分散剂同样是DLLME中影响三相平衡体系形成的一个重要因素。为了得到相对稳定的乳浊液,使得目标物可以被快速提取到萃取剂中,分散剂必须同时与食用油和萃取剂混溶。所以,溶混性是选择分散剂的主要标准。本研究选择了正己烷,丙酮和异丙醇3种同时与食用油和萃取剂互溶的有机溶剂进行实验。结果表明,只有当正己烷作为分散剂时,离心后才能得到便于移取的萃取沉积相。因此,选择正己烷作为分散剂。
不同的萃取剂和分散剂比例可以影响萃取效率,为得到最优的混合比例,考察了正己烷体积由2.0 mL增加至4.0 mL时(保持萃取剂体积为500 μL),BHA,BHT和TBHQ萃取效果的变化。结果证明,3种目标物的峰面积并没有随分散剂体积的增大而产生明显变化。当正己烷体积小于2.0 mL时,分散效果会因样品粘度过大而受到影响。综合考虑,最佳的分散剂加入体积为3.0 mL。
3.3 萃取时间
在萃取时间10~300 s的范围内,考察了萃取效率随萃取时间的变化情况。实验结果表明,BHA,BHT和TBHQ的峰面积在萃取时间增加的过程中保持不变,萃取时间对萃取效率无明显影响。这是因为当食用油、萃取剂和分散剂三相混合形成稳定的乳浊液时,萃取剂与食用油样品之间会形成极大的接触面积,从而在极短的时间内完成萃取。所以,选择10 s作为萃取时间。
3.4 方法评价
利用所建立的方法,对添加浓度为100 ng/g 的食用油平行测定5次,相对标准偏差(RSDs)为4.0%~8.3%。方法线性范围为10~2000 ng/kg,相关性系数(R2 ) 为0.9942~0.9990。将标准溶液逐级稀释, 以信噪比S/N=3计, 检出限(LODs)为1.5~2.4 ng/g 。
将DLLMEGCMS/MS与现有的4种方法进行对比,结果见表2。首先,与液液萃取[7,8]相比,本方法在节省有机溶剂和萃取时间方面具有明显的优势;其次,本方法不需要进行净化、蒸发浓缩和加热等繁琐的预处理步骤,大大简化了实验操作;此外,其检出限低于液液萃取[7,8]和直接进样[18]方法,与超声辅助液相微萃取方法[17]相近,完全可以满足食用油中BHA,BHT和TBHQ的检测要求。
3.5 实际样品检测
本实验选择了4种食用油样品(调和油、葵花籽油、芝麻油和橄榄油)对本方法的适用性进行评价。所有样品购自济南市超市,样品分析前均避光室温保存。应用DLLMEGCMS/MS方法分析4种不同种类的食用油样品(结果见表3),3种合成酚类抗氧化剂在3个样品中分别有检出。向4种食用油中添加3个浓度水平的BHA,BHT和TBHQ(20,100和500 ng/g),回收率分别为83.7%~115%,85.0%~118%和81.9%~102 %,具体结果见表3。结果表明,不同样品的基质效应对该方法没有显著的影响。图3为检测芝麻油中BHA,BHT和TBHQ的总离子流图。
4 结 论
基于DLLME和GCMS/MS技术,建立了一种简单、快速、灵敏的用于分析食用油中痕量酚类抗氧化剂BHA,BHT和TBHQ的方法。本方法所用的样品和有机溶剂消耗少,萃取时间短,环境污染小且成本低廉。与现有的BHA,BHT和TBHQ检测方法相比,本方法线性范围宽(10~2000 ng/g),检出限低(1.5~2.4 ng/g)且重复性好(RSDs<8.5%),能够很好地满足不同食用油中酚类抗氧化剂的分析要求。
References
1 Kubow S. Trends Food Sci. Tech., 1990, 1: 677-770
2 Okubo T, Yokoyama Y, Kano K, Kano I. Food Chem. Toxicol., 2003, 41: 679-688
3 Namiki M. Sci. Nutr., 1990, 29: 273-300
4 B D Page. AOAC Int., 1993, 76: 765
5 Burdock G A. Encyclopedia Food Color Addit. Boca. Raton.: CRC Press, 1997
6 Noguera O, Villanueva C, R M, Ramis R. Anal. Chim. Acta, 1999, 387: 127-134
7 Christian P, Liliane M. Food Chem., 2002, 77: 93-100
8 Bahruddin S, Yong Y S, Mohd A N. Food Chem., 2007, 105: 389-394
9 Carrasco P, Cerretani L, Bendini, Segura C, Gallina T, Fernández G. J. Sep. Sci., 2005, 28(910): 837-858
10 Wang W X, Yang T J, Li Z G, Jong T T, Lee M R. Anal. Chim. Acta, 2011, 690: 221-227
11 Rezaee M, Assadi Y, Hosseini M R M, Aghaee E, Ahmadi F. J. Chromatogr. A, 2006, 1116(12): 1-9
12 Luca C, Anna L P, Rita C, Luca R. Anal. Chim. Acta, 2012, 75: 461-466
13 Zhou Q X, Pang L, Xiao J P. J. Chromatogr. A, 2009, 1216: 6680-6684endprint
14 ZANG XiaoHuan, WANG Chun, GAO ShuTao, ZHOU Xin, WANG Zhi. Chinese J. Anal. Chem., 2008, 36(6): 765-769
臧晓欢, 王 春, 高书涛, 周 欣, 王 志. 分析化学, 2008, 36(6): 765-769
15 Liu S H, Xie Q L, Chen J, Sun J Z, He H, Zhang X K. J. Chromatogr. A, 2013, 1295: 16-23
16 Chang J S, Huang S D. Talanta, 2007, 71: 882-886
17 Ding M Z, Zou J K. Food Chem., 2012, 131: 1051-1055
18 Yang M H, Lin H J, Choong Y M. Food Res. Int., 2002, 35: 627-633
Abstract A novel, simple and highly sensitive method was developed for the rapid analysis of phenolic antioxidants at trace level in edible oils. It was based on dispersive liquidliquid microextraction (DLLME) and gas chromatographymass/mass spectrometry (GCMS/MS). Related important factors that may influence enrichment efficiency, such as type and volume of extraction solvent, type and volume of dispersive solvent, and extraction time were investigated and optimized in detail. The optimum conditions were as follows: a quick injection of 500 μL mixed solution (methanol:acetonitrile=1∶1, V/V) into 1.0 g oil sample with 3 mL nhexane for 10 s of extraction time. Under the optimal conditions, the linearity (10-2000 ng/g), limits of detection (1.5-2.4 ng/g) and relative standard deviations (4.0%-8.3%) was obtained. The proposed method was applied for the analysis of 4 edible oil samples. Some of phenolic antioxidants were detected in three of them, and the recoveries of spiked samples were in the range of 81.9%-118%.
Keywords Dispersive liquidliquid microextraction; Gas chromatographytandem mass spectrometry; Edible oils; Antioxidants
(Received 19 September 2014; accepted 30 October 2014)
This work was supported by the National Natural Science Foundation of China (Nos. 21477068, 21007035)endprint

