分散液液微萃取结合测汞仪分析水产食品中甲基汞
段建坤等
摘 要 建立了以分散液液微萃取技术作为分离富集手段,以测汞仪分析水产品中的甲基汞的方法。以测汞仪直接测定样品中总汞,并用差减法计算出无机汞的含量。实验优化了分散液相微萃取的条件。实验表明,以二氯甲烷为萃取剂,乙醇为分散剂,二者体积比为1∶5,HCl浓度为1 mol/L,NaCl浓度为120 g/L时, 可以得到较为理想的结果。本方法的动态线性范围为0.2~20 μg/L,检出限为 0.10 μg/L,相对标准偏差6.0%, 富集倍数为8。仪器测定总汞的检出限为0.1 μg/kg,线性范围0.2~50 μg/kg,相对标准偏差2.4%。本方法简单、快速,溶剂消耗量少。以标准参考物质验证本方法的准确性,其测定结果与标准值吻合较好。将本方法应用于实际水产制品的分析,得到较满意的结果。
关键词 分散液液微萃取; 测汞仪; 甲基汞
1 引 言
汞是一种毒性较大、熔点低、易挥发的重金属,以多种形态存在于环境和生物体中。汞进入人体后,会对人体造成极大的危害。20世纪50年代,日本化工厂排放含汞的废水,造成数千人中毒的“水俣事件”,引发了全世界对汞中毒的广泛关注。人体中汞的主要来源是被污染的食品,尤其是各种水产品。汞能够以多种形态存在于环境和生物体中,主要有无机形态(一价及二价的汞化合物)和有机态的甲基汞、二甲基汞、乙基汞、苯基汞等。水产品中的汞大部分是甲基汞,其在人体内的吸收效率高达90%以上。因此,对水样中和食品中汞的分析,不仅要提供食品中汞的总量信息,更重要的是要提供汞的形态信息。因此,对水产中的汞进行形态分析是十分有必要的[1,2]。
汞的形态分析一般以色谱技术与原子光谱/质谱技术联用来实现,如气相色谱、液相色谱和原子荧光光谱法(AFS)[3]、原子吸收光谱法(AAS)[4,5]以及电感耦合等离子质谱法(ICPMS)[6]等的联用。这些方法准确度高,但在分析复杂样品(如海水、沉积物、生物样品等)和测定痕量组分时,由于样品基体的复杂性以及汞的低含量,实现汞的形态分析还存在一定难度,因此,样品的分离富集是必不可少的。传统的分离富集手段包括液液萃取和固相萃取、冷阱捕集等,但是样品和试剂的消耗较大,容易引发环境污染和安全事故。开发新型“绿色”萃取技术,成为了分析工作者的研究热点,固相微萃取(SPME)[7,8]、液相微萃取(LPME)[9,10]、浊点萃取(CPE)[11,12]这些新型绿色萃取技术具有使用有机溶剂少,富集倍数大,操作简单,便于与其他分析仪器实现联用等优点。
分散液液微萃取(DLLME)是液相微萃取技术的一种,由Rezaee等[13]于2006年提出。DLLME萃取速度很快,操作简便,消耗低,环境友好,便于与其他分析仪器联用[14]。分散液液微萃取用于甲基汞的萃取并对汞进行形态分析也有报道[15],但萃取液一般均需要进一步的处理以便能应用于后续检测器。测汞仪无需样品前处理,适合于固体和液体的样品的直接分析,其检测灵敏度较高[16],而且样品需求量较少,用于直接检测DLLME萃取液有着较大的优势。
基于此,本研究建立了以DLLME萃取样品中甲基汞,萃取液直接以测汞仪测定的分析方法,操作简单,分析速度快,灵敏度高,而且能实现汞形态的分离分析。方法用于标准物质和实际样品的分析,结果令人满意。
2 实验部分
2.1 仪器与试剂
DMA80全自动固相测汞仪(意大利Milestone公司),测定波长为253.65 nm,318K高速冷冻离心机(德国Saitorius公司),超纯水机(美国Millipore公司),超声波清洗器(上海科导超声仪器有限公司)。实验所用器皿均用10% HNO3浸泡24 h以上,用去离子水淋洗干净,晾干备用。
汞标准溶液甲基汞(GBW08675)、无机汞(GBW(E)080124)购于中国计量科学研究院。上述标准溶液以超纯水稀释为标准使用液(1.00 mg/L)。汞标准参考物质GBW10029 鱼肉、GBW 10051猪肝、GBW 07601人发均购自中国计量科学研究院。NaOH、HCl和NaCl为优级纯,其余试剂为分析纯。超纯水电阻率18.2 MΩ·cm。实际样品(鳕鱼酥、金枪鱼泥、墨鱼、鱿鱼、龙头鱼和紫菜)购自武汉当地超市。
2.2 实验方法
总汞测定时,直接称取约0.05 g样品于样品舟中,以测汞仪分析。甲基汞的测定程序如下:称取0.2~0.5 g 样品于15 mL离心管中,加入6 mol/L HCl 5 mL,混匀后超声萃取2 h,4 ℃下,8000 r/min离心10 min。取2.5 mL上清液,加入5 mol/L NaOH溶液2 mL,定容至5 mL。以注射器向其中注入1 mL分散剂和萃取剂,放置5 min,5000 r/min离心5 min,去掉上层水溶液,取100 μL下层萃取液注入测汞仪样品舟进行分析测定。
3 结果与讨论
3.1 萃取条件的优化
3.1.1 萃取剂的选择
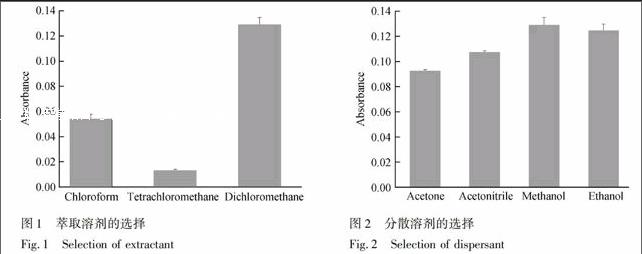
分散相液相微萃取中萃取剂要求密度大于水。实验了四氯化碳、三氯甲烷、二氯甲烷作为萃取剂的萃取性能,结果见图1,可以看出,二氯甲烷的萃取性能要远好于另外两种。
3.1.2 分散剂的选择 分散液一般采用能与水互溶的溶剂,实验中比较了甲醇、乙醇、乙腈和丙酮4种溶剂作为分散液时的萃取性能(图2)。结果表明,甲醇和乙醇效果相当,萃取效率都高于丙酮和乙腈。考虑到乙醇的毒性较小,选择乙醇作为分散剂。
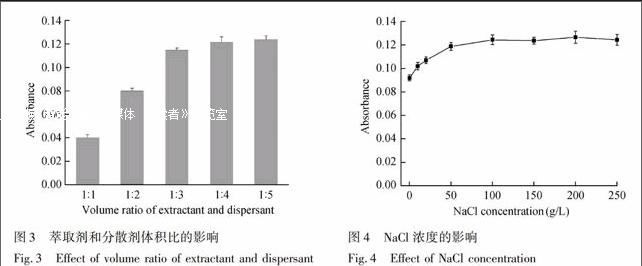
萃取液与分散液的体积比也是影响萃取效率的重要因素之一。考察了二者的体积比1∶1~1∶5时的萃取效率,结果见图3,可见,当二者体积比为1∶4或1∶5时,萃取能力最强,最终选择体积比为1∶5。
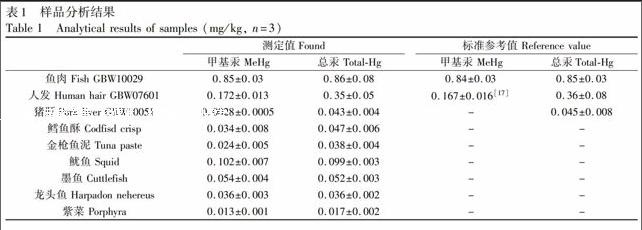
3.1.3 HCl和NaCl浓度的影响 在样品提取过程中使用HCl作为提取液,需要研究HCl基体对于萃取效率的影响。结果表明,萃取效率随HCl浓度的增大而增加,其浓度为0.5~2.0 mol/L时,萃取效率最高,继续增大HCl浓度,萃取效率有所降低。另外,以NaOH中和HCl后的产物为NaCl。样品溶液中NaCl浓度的增大,会降低甲基汞在水中的溶解度,从而提高萃取效率。实验结果也证明了加入NaCl会提高萃取效率(图4)。样品经处理后加入NaOH定容,其中HCl和NaCl的浓度分别为1 mol/L和117 g/L, 故优化的条件为1 mol/LHCl和120 g/L NaCl。endprint
3.2 干扰实验
本方法采用分散相液液微萃取手段分离甲基汞和无机汞,并实现对甲基汞的富集。因此,实验中还研究了无机汞对于甲基汞测定的影响。结果表明,50倍的无机汞离子对于甲基汞的测定结果的影响小于10%。因此,本方法可以用于实际水产食品中甲基汞的分析测定。
3.3 方法的分析性能
在选定的工作条件下,测定空白并计算其标准偏差,按IUPAC的定义(3σ)得到甲基汞的检出限为0.10 μg/L,方法的相对标准偏差为6.0%(2.0 μg/L, n=11),甲基汞浓度在0.2~20 μg/L的范围内线性良好,相关系数为0.9992,线性方程为y=0.0389x+0.0056。甲基汞的富集倍数为8。总汞的检出限为0.1 μg/kg,线性范围0.2~50 μg/kg,线性方程为y=0.0553x+0.00053, 相对标准偏差为2.4%。
3.4 方法验证和样品分析
以汞标准参考物质GBW 10029鱼肉、GBW 07601人发、GBW 10051猪肝作为样品评价了方法的准确性和可靠性,并对实际样品进行了分析测定。样品分析结果见表1
从表1可见,标准样品的分析结果与参考值或文献值保持一致,因此,本方法准确度较高。此外,实际样品鳕鱼酥和金枪鱼泥为婴幼儿辅助食品,其甲基汞含量均超过了0.02 mg/kg,因此应减少婴幼儿对此类辅助食品的摄入量。同样从结果可见,海产品中甲基汞为主要的汞形态,无机汞的含量远低于甲基汞的含量。可见在一般的海产品测定时,无机汞不会对甲基汞的测定产生干扰。总之,本研究所建立的方法操作简单,分析速度快,灵敏度高,很适合于实验室的日常分析测定。
References
1 Zahir F, Rizwi S J, Haq S K, Khan R H. Environ. Toxicol. Pharmacol., 2005, 20: 351-360
2 Scheuhammer A M, Meyer MW, Sandheinrich M B, Murray M W. Ambio, 2007, 36(1): 12-18
3 CAO XiaoDan, QIN DeYuan, HAO Wei, JIAO XiaoLin. Chinese J. Anal. Chem., 2014, 42(7): 1033-1038
曹小丹, 秦德元, 郝 伟, 焦晓琳. 分析化学, 2014, 42(7): 1033-1038
4 Ferrúa N, Cerutti S, Salonia J A, Olsina R A, Martinez L D. J. Hazard. Mater., 2007, 141: 693-699
5 Escudero L B, Olsina R A, Wuilloud R G. Talanta, 2013, 116: 133-140
6 SUN Jin, CHEN ChunYing, LI Bai, GAO YuXi, CHAI ZhiFang. Spectroscopy and Spectral Analysis, 2007, 27(1): 173-176
孙 瑾, 陈春英, 李少锋, 李 柏, 高愈希, 柴之芳. 光谱学与光谱分析, 2007, 27(1): 173-176
7 CUI ZongYan, GE Na, CAO YanZhong, LIU YongMing, LI Jin, WU YanPing. Chinese J. Anal. Chem., 2013, 41(12): 1887-1892
崔宗岩, 葛 娜, 曹彦忠, 刘永明, 李 金, 吴艳萍. 分析化学, 2013, 41(12): pp 1887-1892
8 Muoz J, Gallego M, Valcrcel M. J. Chromatogr. A, 2004, 1055: 185-190
9 Li P J, Zhang X, Hu B. J. Chromatogr. A, 2011, 1218(52): 9414-9421
10 Li P J, Duan J K, Hu B. Electrophoresis, 2008, 29(14): 3081-3089
11 Li Y J, Hu B. Spectrochim. Acta B, 2007, 62(10): 1153-1160
12 Ulusoy H I, Gürkan R, Ulusoy S. Talanta, 2012, 88(15): 516-523
13 Rezaee M, Assadi Y, Hosseini MRM, Aghaee E, Ahmadi F, Berijani S. J. Chromatogr. A, 2006, 1116: 1-9
14 ZANG XiaoHuan, WU QiuHua, ZHANG MeiYue, XI GuoHong, WANG Zhi. Chinese J. Anal. Chem., 2009, 37(2): 161-168
臧晓欢, 吴秋华, 张美月, 郗国宏, 王 志. 分析化学, 2009, 37(2): 161-168
15 Jia X Y, Han Y, Liu X L, Duan T C, Chen H T. Spectrochim. Acta B, 2011, 66(1): 88-92
16 Maggi C, Berducci M T, Bianchi J, Giani M, Campanella L. Anal. Chim. Acta, 2009, 641: 32-36endprint
17 WANG Meng, FENG WeiYue, ZHANG Fang, WANG Bing, SHI JunWen, LI Bai, CHAI ZhiFang, ZHAO YuLiang. Chinese J. Anal. Chem., 2005, 33(12): 1671-1675
王 萌, 丰伟悦, 张 芳, 汪 冰, 史俊稳, 李 柏, 柴之芳, 赵宇亮. 分析化学, 2005, 33(12): 1671-1675
Abstract A method for the determination of methylmercury in seafood has been developed using dispersive liquidliquid microextraction followed by direct mercury analyzer. Total mercury was detected by direct mercury analyzer, and inorganic mercury was calculated by the difference. The parameters affecting the extraction efficiency, including the selection of extractant and dispersant, their volume ratio, concentration of HCl and NaCl have been optimized in this study. The results showed that CH2Cl2 as extractant, ethanol as dispersant, volumn ration of 1∶5, 1 mol/L HCl and 120 g/L NaCl were chosen. The detection limit and the dynamic liner range were 0.10 μg/L and 0.2-20 μg/L, respectively. The relative standard deviation was 6.0% for eleven replicates at the spiked level of 2.0 μg/L. The enrichment factor was 8. For total Hg determination, the detection limit and the dynamic liner range for methylmercury were 0.10 μg/kg and 0.2-50 μg/kg, respectively. The relative standard deviation was 2.4%. The method was simple, fast and a little solvent needed. Some certified reference materials were analyzed to validate the accuracy of the proposed method, and the results were in good agreement with the reference value. Besides, the method was applied to the real samples with satisfactory results.
Keywords Dispersive liquidliquid microextraction; Direct mercury analyzer; Methylmercury
(Received 5 August 2014; accepted 30 September 2014)endprint

