依达拉奉对过氧化氢致血管内皮细胞氧化损伤的保护作用
陈 丽,李万奎
近年来,心脑血管疾病的发病率逐年上升,已成为致残及病死的重要原因。动脉粥样硬化是多种心脑血管疾病的重要病理基础,而内皮细胞损伤被认为是促使动脉粥样硬化的早期关键环节[1]。在内皮细胞众多损伤因素中,氧化应激损伤是一个重要因素,参与了内皮细胞损伤病理变化过程的各个环节。丙二醛(MDA)、超氧化物歧化酶(SOD)及总抗氧化能力(T-AOC)等是反映氧自由基水平及生物体清除氧自由基能力的主要观察指标[2]。依达拉奉是临床上唯一广泛使用且效果优越的新型自由基清除剂,其清除自由基的确切效果多有报道[3]。本研究旨在细胞水平上观察依达拉奉对过氧化氢(H2O2)致人脐静脉内皮细胞(HUVEC)氧化损伤的影响,探讨其对血管内皮细胞氧化应激损伤保护作用,为其临床用药提供进一步的实验资料。
1 材料与方法
1.1 药物 依达拉奉标准品:中国药品生物制品检定所;过氧化氢溶液(H2O2,30%):无锡市苏强化工有限公司。
1.2 试剂 M199培养基:GIBCO公司;胰蛋白酶:GIBCO公司;胎牛血清:杭州四季青生物工程材料有限公司;总抗氧化能力(T-AOC)检测试剂盒:南京建成生物工程研究所;丙二醛(MDA)试剂盒:南京建成生物工程研究所;超氧化物歧化酶(SOD)试剂盒:南京建成生物工程研究所。
1.3 实验对象 脐带数根,来自解放军第154医院妇产科。
1.4 实验方法
1.4.1 HUVEC的培养、传代及鉴定 依据文献方法[4],从健康足月产妇脐静脉内提取HUVEC,经Ⅷ因子相关抗原免疫组织化学鉴定证实培养的细胞为内皮细胞。将HUVEC进行传代,采用生长良好的3~4代细胞进行试验。
1.4.2 实验分组及处理 待细胞长至60%~70%融合,移去培养液,用磷酸盐缓冲液清洗,换用含1%的胎牛血清M199培养基,使细胞生长同步化。将细胞分为4组,分别为空白对照组、H2O2组、依达拉奉高剂量组(40 μmol/L)、依达拉奉低剂量组(20 μmol/L),每组重复8个复孔。依达拉奉组先给予含20、40 μmol/L依达拉奉的M199培养液,其余2组给予M199培养液,培养24 h。弃去培养基,除对照组外(仍给予M199培养液),各组再给予含250 μmol/L H2O2培养液,培养2 h。实验重复3次。
1.4.3 观察指标 ①MDA含量测定。处理各组HUVEC,吸取各组培养液1ml,按MDA测定试剂盒说明书方法测定MDA含量。②SOD的活性及TAOC水平测定。处理各组HUVEC,吸取各组培养液1ml,按SOD及T-AOC试剂盒说明书方法测定SOD的活性及T-AOC水平。
2 结 果
2.1 对MDA水平的影响 各组细胞产生MDA水平测定结果见表1。与空白对照组比较,H2O2组MDA明显升高(P<0.01);与H2O2组比较,依达拉奉的高低剂量组MDA水平均降低,低剂量组有统计学意义(P<0.05),高剂量组具有明显的统计学意义(P<0.01)。
表1 依达拉奉对H2O2诱导损伤的HUVEC MDA水平的影响(±s,n=8)

表1 依达拉奉对H2O2诱导损伤的HUVEC MDA水平的影响(±s,n=8)
注:与H2O2组相比较,*P<0.05,△P<0.01;与空白对照组相比,#P<0.01
组别 MDA(nmol/mg)空白对照组 0.715±0.142 H2O2组 1.619±0.245#依达拉奉低剂量组 1.225±0.310*依达拉奉高剂量组 1.043±0.270△
2.2 对SOD活性及T-AOC的影响 各组细胞SOD活性及T-AOC测定结果见表2。与空白对照组比较,H2O2组SOD活性及T-AOC明显降低 (P<0.01)。与H2O2组比较,依达拉奉的高低剂量组SOD活性及T-AOC均增高;其中依达拉奉高低剂量组SOD活性具有显著统计学意义(P<0.01);依达拉奉低剂量组T-AOC有统计学意义(P<0.05),依达拉奉高剂量组T-AOC有显著统计学意义(P<0.01)。
表2 依达拉奉对H2O2诱导损伤的HUVEC SOD活性及T-AOC的影响(±s,n=8)
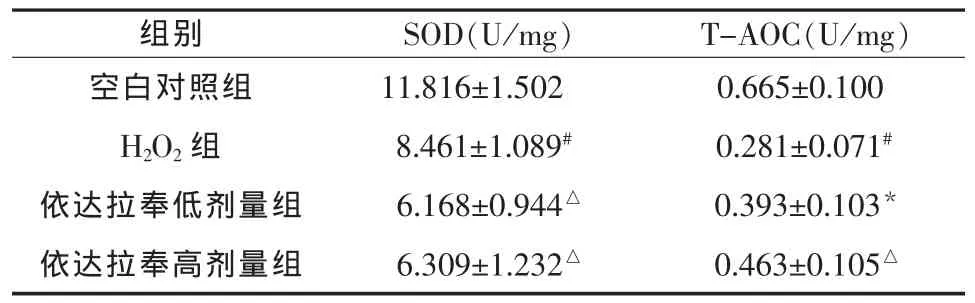
表2 依达拉奉对H2O2诱导损伤的HUVEC SOD活性及T-AOC的影响(±s,n=8)
注:与H2O2组相比较,*P<0.05,△P<0.01;与空白对照组相比,#P<0.01
组别 SOD(U/mg) T-AOC(U/mg)空白对照组 11.816±1.502 0.665±0.100 H2O2组 8.461±1.089# 0.281±0.071#依达拉奉低剂量组 6.168±0.944△ 0.393±0.103*依达拉奉高剂量组 6.309±1.232△ 0.463±0.105△
3 讨 论
动脉粥样硬化的形成是由于多种危险因子损伤内皮细胞而发生的一系列炎性反应,其中内皮细胞损害是动脉粥样硬化的早期病理变化[5]。在内皮细胞损害过程中,氧化应激是一个重要的中间环节,主要表现为氧自由基的过氧化反应,引起细胞膜脂质过氧化、蛋白质和核酸变性,导致不可逆损伤,并且脂质过氧化会改变细胞的转运功能和酶的功能,尤其是细胞游离钙浓度的改变[6]。MDA是氧自由基与生物膜不饱和脂肪酸发生脂质过氧化反应的稳定代谢产物,其含量变化间接反映了氧自由基含量的变化。因此,通过测定MDA含量可以评估细胞内氧自由基水平和脂质过氧化反应的强弱[7]。T-AOC是指机体内总抗氧化体系的总称,包括两个体系:一类是酶促防御系统,包括SOD、过氧化物酶、过氧化氢酶等。另一类是非酶促防御系统,包括维生素C、维生素E、氨基酸和金属蛋白等[8]。SOD是生物体内专一清除超氧阴离子的特异性抗氧化酶,能够清除氧自由基,保护机体免受自由基的攻击[9]。因此,T-AOC及SOD活力的高低可反应机体抗氧化能力。除此之外,体内还有许多非酶促类抗氧化剂,它们也可以通过各种方式清除氧自由基。
依达拉奉是新近开发的一种新型自由基清除药,其分子量小,并且具有亲脂基团,血脑屏障的通透性高达60%,主要是通过抑制黄嘌呤氧化酶和次黄嘌呤氧化酶的活性刺激前列环素的生成,减少炎性递质白三烯的产生,降低羟自由基的浓度,从而实现清除氧自由基、抑制脂质过氧化、修复血管内皮细胞作用,从而避免血细胞、血管内皮细胞、神经细胞的氧化损伤[10]。林森等[11]对以依达拉奉治疗的35例急性脑梗死患者血清SOD、MDA水平进行检测,结果发现患者体内MDA水平较治疗前明显降低,SOD水平较治疗前有明显提高,提示依达拉奉对患者体内自由基有确切的清除作用。薛慎伍等[12]将结扎离断法制作大鼠颈动脉的局灶性慢性脑缺血模型,造模3周后给予依达拉奉3 mg/kg腹腔注射,取各实验组大鼠脑组织匀浆测定MDA和SOD的含量,结果发现依达拉奉具有抑制缺血后血管内皮细胞损害,清除自由基,抑制脑水肿,影响单胺类神经递质的代谢,而发挥神经保护作用。
本研究发现,H2O2可明显升高HUVEC中MDA水平(P<0.01),明显降低SOD活性(P<0.01)及TAOC(P<0.01), 说明H2O2可明显造成HUVEC损伤。相对于H2O2组,依达拉奉各剂量组细胞损伤不同程度减轻,依达拉奉的低剂量组MDA水平降低(P<0.05), 高剂量组MDA水平明显降低(P<0.01);高低剂量组SOD活性均明显增高(P<0.01);低剂量组T-AOC增高(P<0.05),而高剂量组T-AOC增高更加明显(P<0.01)。说明依达拉奉可增强氧化应激损伤血管内皮细胞的抗氧化酶活性,对抗脂质过氧化反应,从而实现其清除氧自由基,保护内皮细胞的损伤的作用。高剂量组依达拉奉T-AOC改善更加显著,考虑可能与启动非酶促防御系统有关。综上所述,依达拉奉可降低内皮细胞的氧化损伤程度,提高内皮细胞抗氧化能力,值得推广应用。
[1]Ross R.Atherosclerosis is an inflammatory disease[J].Am Heart J,1999,138(4):419-420.
[2]王迪浔,金惠铭.氧化应激与疾病[M].北京:人民卫生出版社,2008:29.
[3]李红燕,地力木拉提,何晓燕,等.依达拉奉对急性脑梗死患者血管内皮功能的影响[J].中国医药,2011,6(7):795-797.
[4]沈祥春,李万奎,陶 玲.艳山姜挥发油对氧化低密度脂蛋白诱导人脐静脉血管内皮细胞损伤及一氧化氮合酶-一氧化氮的影响[J].中国医院药学杂志,2012,32(24):1937-1940.
[5]Boos CJ,Blann AD,Lip GY.Assessment of endothelial damages function:A focus on circulating endothelial cells[J].Methods Mol Med,2007,139(2):211-224.
[6]王丽萍,李树青.血管内皮功能与损伤机制的研究进展[J].社区医学杂志,2008,6(1):49-52.
[7]Ozkul A,Akyol A,Yenisey C.Oxidative stress in acute ischemic stroke[J].Journal of Clinical Neuroscience,2007,7(10):1062-1066.
[8]张斯萌,王 文,黄 丹,等.急性脑卒中患者血清氧化应激指标测定及临床意义[J].微循环学杂志,2012,22(4):42-42.
[9]韩 强,隋 强,辛 平.脑梗死患者血清超氧化物歧化酶(SOD)脂质过氧化物(MDA)的检测及临床意义[J].中国疗养医学,1995,4(3):55.
[10]Yoshida H,Yanai H,Namiki Y,et al.Neunprotective effects of edaravone:a novel free radical scavenger in cerebrovascular injury[J].CNS Drug Rev,2006,12(1):9-20.
[11]林 森,赵连东,周 永,等.血清SOD、MDA测定应用于依达拉奉对急性脑梗死患者的疗效观察[J].中国实验诊断学,2009,13(12):1789-1791.
[12]薛慎伍,刘春寒,张兆岩,等.依达拉奉对慢性脑缺血模型大鼠脑组织丙二醛、超氧化物歧化酶阳性表达的影响[J].中国老年学杂志,2011,11(31):4405-4403.

