基因工程抗癌药物CNB 通过线粒体途径促进细胞凋亡的研究
魏佳苡,魏 群,陈 静,杨 扬
(1.香港中文大学,香港 999057;2.北京师范大学生命科学学院 北京 100000;3.川北医学院附属医院,南充 637000;4.北京师范大学生命科学学院 北京 100000)
钙调蛋白磷酸酶B 亚基(Calcineurin subunit B,CNB)是钙调蛋白磷酸酶(Calcineurin,CN)的调节亚基。正常生理状态下,CNB 不仅存在于细胞内,也存在于胞外,如血清中[1]。研究发现,CNB 除了作为钙调蛋白磷酸酶A 亚基(Calcineurin subunit A,CnA)的调节亚基外,还有其单独的功能[2]。对CNB 药效的一系列研究发现,CNB 具有抑制肿瘤细胞生长的功能[3]。而线粒体是在细胞凋亡、信号转导中起关键调节作用的细胞器,故研究CNB 对线粒体凋亡途径的影响极为重要[4]。本研究本研究采用MTT 比色法检测细胞存活和生长、流式检测细胞凋亡测定CNB 对肿瘤细胞的杀伤效果;采用高内涵分析与成像仪检测细胞线粒体膜电势,旨在探讨基因工程药物CNB 通过线粒体途径引起肿瘤细胞凋亡的可能机制。
1 材料与方法
1.1 材料与试剂pc3.1-CNB 质粒 、大肠杆菌菌株 、HepG2 细胞、Sk-hep1 细胞均为本室保存。蛋白预染Marker,立陶宛MBI Fermentas 公司;Anti-Calcineurin B,本实验室制备;Anti-ß-actin,美国Santa Cruz 公司;HRP-羊抗兔二抗、HRP-羊抗鼠二抗,北京中杉金桥公司;Purified RNA extracted kit,百泰克公司;DTT,百泰克公司;DTT,德国Merck 公司;NP-40,美国Sigma公司;质粒提取试剂盒,百泰克公司;胰蛋白酶,迈晨生物科技公司;rhCNB,本实验制备;dNTP、MLV-反转录酶、OligdT 、RNA 酶抑制剂,TAKARA 公司;Lipofectamine TM 2000,美国Invitrogen 公司。
1.2 仪器设备恒温CO2 培养箱,德国HERA 公司;Coic 倒置显微镜,重庆光电仪器有限公司;酶标仪,美国Bio-Rad 公司;实时定量PCR 仪7500,ABI;恒温CO2 培养箱,德国HERA 公司;酸度计520A,美国ORION 公司。
1.3 实验方法细胞培养;细胞传代;M T T 检测;C C K 8 细胞活性检测;流式细胞检测;免疫印迹;实时荧光定量P C R 实时定量P C R:引物合成序列,Primer sequences(5′-3′):Bid,5' ACCCTAGAGACATGGAGAAG 3’(forward),5' AGCTATCTTCCAGCCTGTCT 3'(reverse);Bak,5’ AGAGCTGTCTGAACTCACGT 3’(forward),5’TTACACTGTGCCAGAGCCAT 3’(forward);Bim,5’ GAGAAGGTAGACAATTGCAG 3’(forward),5’ GACAATGTAACGTAACAGTCG 3’(forward);Bcl-2,5’ CTTTAGTACAGCGGGTCA 3’(forward),5’ CTTTAGTACAGCGGGTCA 3’(forward);Bcl-xl,5’ TCCCAGAAAGGATACAGCTGG 3’(forward),5’ACTGAAGAGTGAGCCCAGCAG 3’(forward);质粒提取;细胞转染(瞬转);JC-1 染色检测细胞线粒体膜电势。
2 结果
2.1 CNB 有效抑制肿瘤细胞增殖由图1,我们可以看出,在体外CNB 能够有效的抑制HepG2 细胞的增殖。CNB 对HepG2 细胞的抑制具有浓度依赖效应,浓度越高,抑制率相对越高。MTT 实验证明,在体外CNB能够有效抑制肿瘤细胞的增殖,这与动物实验结果是一致的。并且,CNB 对正常细胞的增殖基本无影响。
2.2 不同批次CNB 均能够抑制肿瘤细胞增殖由图2可知,不同批次的CNB 均具有同样的作用,能够抑制肿瘤细胞的增殖。但不同批次的CNB 效果不同。因此,我们在进行下面的研究时,选择了药效较高批次的CNB。
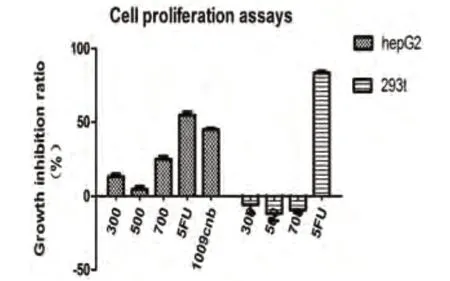
图1 MTT检测结果
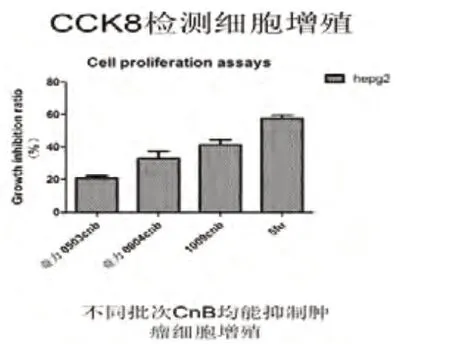
图2 CCK8检测结果
2.3 CNB 能上调细胞后期凋亡比例实验结果表明
CNB 有浓度梯度效应,随着CNB 浓度增加,能明显上调肿瘤细胞晚期凋亡的比例,当浓度达到700ug/ml 时和抗肿瘤药品五氟尿嘧啶效果基本相同,说明CNB 能促进肿瘤细胞凋亡(图3)。
2.4 在不同细胞系中CNB 均能上调Caspase3 的表达
实验用western blotting 检测Caspase 全长蛋白,结果表明3 种细胞加入CNB 后均Caspase3 表现为下调,说明Caspase3 剪切体上调,Caspase3 蛋白被激活,显示CNB 能促进细胞凋亡(图4)。
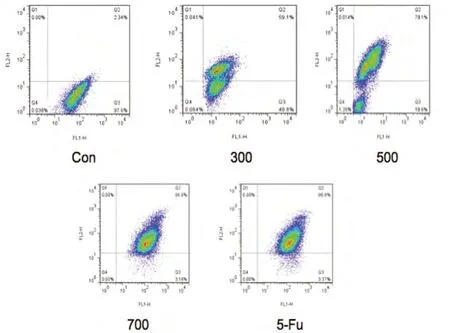
图3 Annexin V/PI法检测细胞凋亡
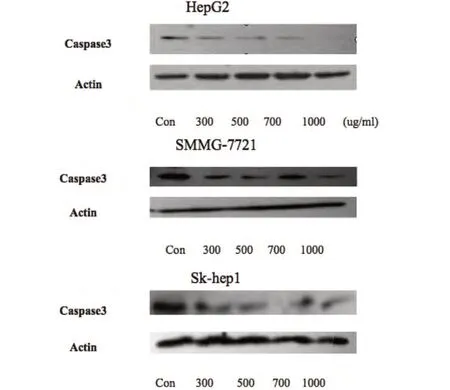
图4 加入CNB后3种不同细胞系Caspase3免疫印迹结果
2.5 CNB 引起细胞线粒体膜电势降低通过对CNB对线粒体膜电势的影响的检测,我们发现CNB 可以显著减低线粒体膜电势,因此说明线粒体膜电势的降低是CNB 促进诱导的细胞凋亡的一个步骤。而且线粒体电势的降低有浓度依赖性,随着CNB 的浓度增加,线粒体电势下降更加明显。该结果与本实验室前期结果一致,CNB 能够定位到线粒体,导致线粒体膜通透性增加,从而引发线粒体介导的凋亡。见图5。
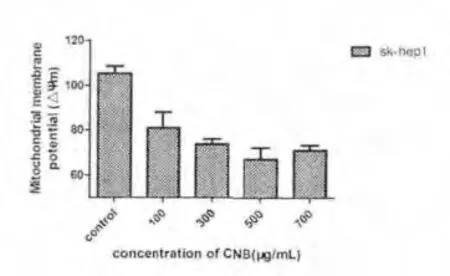
图5 .1 加入不同浓度CNB后Sk-hep1细胞线粒体膜电势情况
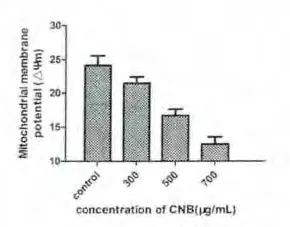
图5 .2 加入不同浓度CNB后HepG2细胞线粒体膜电势情况
3 讨论
细胞凋亡是程序性死亡的一种主要形式[5]。线粒体介导的细胞凋亡途径是细胞凋亡通路中的重要一条[6]。线粒体细胞凋亡通路中关键的是细胞色素c 的释放。当线粒体膜通透性升高时,细胞色素c 能够被释放,进入到胞浆中[7-8]。细胞色素c 的释放有两种途径。一种是PTP(膜通透转运孔)复合体,由线粒体的外膜蛋白聚合而成[9]。线粒体接收到外界的刺激以后,使得PTP 开放、线粒体膜电位消失,线粒体的外膜裂开,细胞色素c和AIF(凋亡诱导因子)释放。另一种是Bcl-2 家族蛋白形成的通道。Bcl-2 家族可分为抗凋亡和促凋亡两类。其中Bcl-2 的功能是抗凋亡,而Bax 则是促进细胞凋亡。两者在线粒体上控制细胞色素c 的释放。正常状况下,Bcl-2 是以同源二聚体的形式存在,具有抗凋亡的作用。当Bax 与Bcl-XL 或Bcl-2 形成异源二聚体时,这些分子的抗凋亡作用就丧失。Bax 能够构成跨线粒体外膜的孔道,使线粒体膜电位降低,促进细胞色素c 和AIF 的释放,细胞色素c 与凋亡酶激活因子1(Apaf-1)、ATP 及pro-Caspase9 形成凋亡复合体,通过pro-Caspase9 的自身酶切活化,激活Caspase9,进一步活化Caspase3,引起细胞凋亡[9-10]。本研究重点探讨基因工程药物CNB 通过线粒体途径引起肿瘤细胞凋亡的机制。
本实验室之前的研究结果显示CNB 对荷瘤小鼠有抗癌的功效。为揭示这一功效的分子水平的作用机理,我们采用MTT 比色法和CCK-8 试剂盒来检测细胞存活和生长。通过实验验证,CNB 对HepG2 细胞和Skhep1 细胞(肿瘤细胞)的增殖均有较为显著的抑制效果,而对正常细胞293t 无明显影响,且不同批次CNB 实验效果有稍许差异。为了探究进一步探究CNB 对HepG2细胞和Sk-hep1 细胞的杀伤作用,我们采用流式细胞术对药物处理细胞进行测定,发现CNB 处理后细胞处于凋亡晚期的比例明显上升。而对凋亡经典标志性蛋白Caspase3 的免疫印迹实验显示了加药处理的细胞中Caspase3 被活化,验证了CNB 能促进肿瘤细胞凋亡的事实。同时,经CNB 处理后的细胞线粒体膜电势呈下降趋势,并且有浓度梯度效应,证明了CNB 能够通过线粒体途径促进细胞凋亡。
需要指出的是,对CNB 的作用机理的研究仍处于初级阶段,CNB 对细胞的刺激绝对不局限在这一条通路上,不同细胞可能有不同表现。机体对刺激的应答是细胞内各种信号通路相互协同作用的结果,通过各信号的精细调节,达到机体内环境的动态平衡。
由于Bcl-2 和Bcl-xl 存在于线粒体膜上,而CNB也能定位到线粒体上,所以本实验之后的探索研究可以从通过CoIP 实验验证CNB 与Bcl-2 和Bcl-xl 直接结合起作用来促进线粒体途径的细胞凋亡这个方向入手。
CNB 能够抑制肿瘤细胞增殖;CNB 能够促进肿瘤细胞凋亡;CNB 可促进线粒体途径的细胞凋亡。
[1] 尹虹, 刘玥, 郑文岭等.miRNA-196b过表达对K562细胞增殖、凋亡及survivin、Cox-2表达的影响[J].中国癌症杂志, 2013, (5): 341-346.
[2] 宋辉, 王明席, 许瑞安等.纤溶酶系统在成肌纤维细胞凋亡、组织纤维化过程中的作用[J].中国药理学通报, 2012, 28(6): 744-747.
[3] Wu JS, Lin TN, Wu kk.Rosiglitazone and PPAR-gamma overexpression protect mitochondrial membrane potential and prevent apoptosis by upregulating anti-apoptotic Bcl-2 family proteins[J].J Cell Physiol,2009.220(1): 58-71.
[4] Sun J, Li ZM, Hu ZY, et al., ApoG2 inhibits antiapoptotic Bcl-2 family proteins and induces mitochondria-dependent apoptosis in human lymphoma U937 cells[J].Anticancer Drugs, 2008.19(10): 967-974.
[5] Brooks C, Dong Z.Regulation of mitochondrial morphological dynamics during apoptosis by Bcl-2 family proteins: a key in Bak[J]? Cell Cycle,2007, 6(24): 3043-3047.
[6] Qian S, Wang W, Yang L, et al., Structure of transmembrane pore induced by Bax-derived peptide: evidence for lipidic pores[J].Proc Natl Acad Sci U S A, 2008.105(45): 17379-17383.
[7] Eugel T, Henshall DC.Apoptosis, Bcl-2 family proteins and Caspases:the ABCs of seizure-damage and epileptogenesis[J]? Int J Physiol Pathophysiol Pharmacol, 2009.1(2): 97-115.
[8] Rong YC, W.Distelhorst.Bcl-2 protein family members: versatile regulators of calcium signaling in cell survival and apoptosis[J].Annu Rev Physiol, 2008, 70: 73-91.
[9] 田朗, 朱咏贵, 成亮等.CVB3感染对Hela细胞凋亡的影响[J].湖南师范大学学报(医学版), 2013, (3): 4-7.
[10] 杨剑岭, 曹晓正, 何丽华等.5, 7-二甲氧基黄酮对K562细胞凋亡和livin基因表达的影响[J].湖南师范大学学报(医学版), 2013, (4):16-18.

