5-甲基-4-(1-氮杂环丙基)吡咯并三嗪-6-甲酸乙酯的合成及表征
王丽丽,马沙沙,王维佳,孙宝丽,李宝林
(药用资源与天然药物化学教育部重点实验室,陕西师范大学 化学化工学院,陕西 西安710119)
5-甲基-4-(1-氮杂环丙基)吡咯并[2,1-f][1,2,4]三嗪-6-甲酸乙酯(1)是本实验室设计的一个结构新颖的含吡咯并三嗪母核化合物。吡咯并三嗪类化合物因具有良好的生物活性,近年来倍受药物研究工作 者 的 重 视[1-4]。 布 立 尼 布 (Brivanib,BMS-540215)[5-6]是这类化合物的典型代表,它是由 Bristol-Myers Squibb公司研发的一种具有口服生物活性的多激酶抑制剂,可同时抑制血管内皮生长因子受体(VEGFR)和纤维母细胞生长因子受体酪氨酸激酶(FGFR)的活性。临床前研究显示布立尼布(如图1所示)可减少VEGFR-2受体酪氨酸激酶磷酸化,降低肿瘤微血管密度,抑制肿瘤细胞增殖,增加肿瘤细胞凋亡,下调细胞周期调节因子,对多种人肝癌异种移植模型的生长均有明显抑制作用。其L-丙氨酸酯前药丙氨酸布立尼布(Brivanib Alaninate,BMS-582664)目前正处于Ⅲ期临床研究,用于治疗晚期肝癌[7-8]。
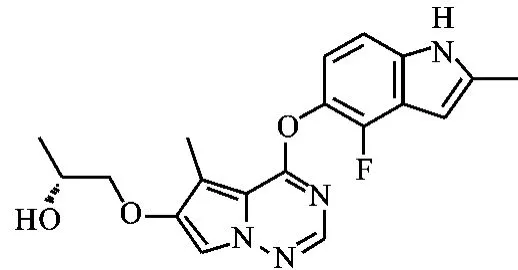
图1 布立尼布的结构式Fig.1 The structure of Brivanib
由于含有吡咯并三嗪母核结构的布立尼布及其衍生物表现出了良好的抗肿瘤活性,因此,我们试图在吡咯并三嗪母核的4-位引入具有特殊反应性能的氮杂环丙基结构单元,通过该结构单元与生物体内某些含亲核性基团的靶标发生反应,起到对疾病治疗的作用。为此,本文设计了一种含有吡咯并三嗪母核结构的新化合物5-甲基-4-(1-氮杂环丙基)吡咯并[2,1-f][1,2,4]三嗪-6-甲酸乙酯,该化合物的合成是以3-甲基-2-氰基吡咯-4-甲酸乙酯为原料,经N-氨基化反应,甲酰胺合环,亲核取代反应得到目标化合物。合成中所及中间体及目标化合物的结构经1H NMR,13C NMR,HRMS,FTIR进行了鉴定。
1 实验部分
1.1 试剂与仪器
1-溴-2-氯乙烷,甲酰胺(分析纯,上海达瑞精细化学品有限公司),氢化钠(60%,分析纯,上海有朋化工有限公司),碳酸钾(分析纯,天津富宇试剂厂),3-甲基-2-氰基吡咯-4-甲酸乙酯[9-10]由本实验室自行合成,其结构经1H NMR、13C NMR进行了确认。
Bruker Avance-300MHz超导核磁共振仪(美国Bruker公 司);EQUINX55FT-IR 红 外 光 谱 仪(KBr压片,德国Brucher公司);X-5型显微熔点测定仪(北京泰克仪器有限公司);Bruker-maXis高分辨率质谱仪(美国Bruker公司);目标化合物的能量最小化利用SYBYL-X2.1.1软件(美国 Tripos公司)进行。
1.2 N-氨基-3-甲基-2-氰基吡咯-4-甲酸乙酯(3)的合成
取6.0mL无水DMF于250mL的单口瓶中,向瓶中加入1.3g(7.0mmol)3-甲基-2-氰基吡咯-4-甲酸乙酯,反应液冷却至-20℃,向其中加入NaH 0.8g(35.0mmol),搅拌45min。通过恒压滴液漏斗向反应液中滴加140.0mL(0.15mol/L 21.0mmol)NH2Cl[11]的乙醚溶液,继续在-20℃下搅拌2h,然后室温反应1h。用饱和Na2S2O3水溶液淬灭反应,分出有机相,水相用乙醚(30.0mL×3)萃取,合并有机相,用饱和食盐水洗涤,无水Na2SO4干燥,浓缩后用硅胶柱层析分离(流动相:乙酸乙酯/石油醚=1/4,V/V)得1.2g浅黄色固体化合物3,产率91.5%。m.p.:130.4~131.0 ℃;HRMS m/z(ESI):194.0930[M+H]+;计算值:194.093 0;1H NMR (300MHz,DMSO-d6)δ:7.49(s,1H),6.48(s,2H),4.19(q,J=7.1Hz,2H),2.30 (s,3H),1.26(t,J=7.1Hz,3H);13C NMR (75MHz,DMSO-d6)δ:164.4,133.2,131.8,114.0,113.1,108.0,61.1,15.9,12.9;IRνmax(KBr,cm-1):3 327,3 207,3 130,2 977,2 219,1 693,1 560。
1.3 5-甲基-4-氨基吡咯并[2,1-f][1,2,4]三嗪-6-甲酸乙酯 (4)的合成
将2.0g(10.0mmol)化合物3溶于10.0mL的甲酰胺中,升温回流(165℃)5h,反应生成大量的固体,TLC跟踪,反应物基本消耗完全。向反应瓶加水20.0mL,抽滤,滤饼干燥得到1.9g淡黄色固体化合物4,产率86%。m.p.:225.0~225.3℃;1H NMR (400MHz,DMSO-d6)δ:7.95(s,1H),7.81(s,1H),4.26(q,J=7.0Hz,2H),2.70(s,3H),1.31 (t,J=7.0Hz,3H);13C NMR(101MHz,DMSO-d6)δ:163.9,157.1,149.5,120.6,115.5,113.9,113.4,59.5,14.2,11.3。HRMS m/z(ESI):221.1 022[M+H]+;计算值:221.103 9;IRνmax(KBr,cm-1):3 404,3 332,3 130,2 987,1 724,1 654,1 508,1 233,1 067,760。
1.4 5-甲基-4-(1-氮杂环丙基)吡咯并[2,1-f][1,2,4]三嗪-6-甲酸乙酯 (1)的合成
取8.0mL DMF置于25mL的两口圆底烧瓶中,向瓶 中依次加 入 1-溴-2-氯 乙 烷 2.2g (5.0 mmol),碳酸钾0.6g(4.5mmol),反应液升温至60℃,然后加入0.6g(3.0mmol)化合物4,TLC跟踪至反应完全。停止反应,趁热过滤除去K2CO3,滤液浓缩,并加入冰水搅拌30min,得白色悬浊液,抽滤,滤饼真空干燥后用硅胶柱层析分离(流动相:乙酸乙酯/石油醚=1/1,V/V)得到0.4g淡黄色固体1,收率54%。m.p.:163.2~163.8 ℃;1H NMR(400MHz,DMSO-d6)δ:7.94 (s,1H),7.73(s,1H),4.25(q,J=6.9Hz,2H),3.99(d,J=7.6Hz,2H),3.95(d,J=7.6Hz,2H),3.40(s,3H),1.32(t,J=6.9Hz,3H);13C NMR(101MHz,DMSO-d6)δ:163.6,146.0,139.2,123.4,119.8,115.3,113.4,59.4,53.9,44.7,14.2,11.1。HRMS m/z(ESI):247.119 6[M+H]+;计算值:247.119 5;IRνmax(KBr,cm-1):3 066,2 941,1 706,1 662,1 508,1 228,1 145,1 026,757。
2 结果与讨论
2.1 合成方法
为合成化合物1,经反复实验探索优化,设计了一条合理可行的合成路线(如图2所示)。以3-甲基-2-氰基吡咯-4-甲酸乙酯2为原料,在-20℃下无水DMF中,化合物2吡咯环内的-NH先与NaH作用生成氮负离子,然后再与NH2Cl反应生成化合物3,该步反应收率可达到91.5%。

图2 化合物1的合成路线Fig.2 Synthetic route of compound 1
中间体化合物4是一个未见文献报道的新化合物,它由化合物3与甲酰胺反应而生成。甲酰胺既是反应物也是溶剂;反应需要在165℃下回流5h。生成化合物4为水不溶性固体化合物,向反应混合物中加水后抽滤、洗涤便可以得到纯度较高的化合物4。该步反应操作便捷、后处理简单。
化合物4以DMF为溶剂、K2CO3作为缚酸剂,与1-溴-2-氯乙烷在60℃下发生两次亲核取代反应生成目标化合物1。化合物4中4-位氨基氮原子作为亲核性原子,可能先取代掉1-溴-2-氯乙烷中溴原子,使伯氨基转化为仲氨基生成可能中间产物4a。4a的仲氨基氮原子继续发生分子内亲核取代反应,生成化合物1。该步反应收率不高,可能是4a的分子内亲核取代与4a和1-溴-2-氯乙烷之间的再次分子间亲核取代相互竞争所致。
2.2 化合物的结构确定
合成过程中所得中间体及目标化合物的结构均经波谱方法确定。
与化合物2[9]对比,化合物3的1H NMR 中12.63处N—H共振信号消失,同时在6.48处出现了—NH2氢的共振信号。化合物3的IR谱中3 327 cm-1、3 207cm-1和1 560cm-1分别出现了—NH2的氮氢键伸缩振动吸收峰和面内弯曲振动吸收峰,结合HRMS数据,证实所合成的化合物结构即为3所示。
与化合物3对比,化合物4的IR谱中2 219 cm-1的氰基吸收峰消失。1 654cm-1出现了碳氮双键的伸缩振动吸收峰,1H NMR中在7.95出现了碳氮双键上的氢共振信号,结合HRMS数据,证实所合成的化合物结构即为4所示。
与化合物4对比,目标化合物1的IR谱中—NH2的氮氢键伸缩振动吸收峰消失,同时1H NMR中在3.95和3.99出现了两个亚甲基上氢的共振峰;13C NMR谱中也相应的在53.9和59.4出现了两个亚甲基碳的共振信号。结合HRMS数据,证实所合成的化合物结构即为1所示。
比较有意思的是在化合物1的1H NMR中,4-位氮杂环丙基中的两个亚甲基上的两组氢具有不同的化学位移,分别为3.99和3.95;同时在其13C NMR谱中,这两个亚甲基碳的化学位移分别在59.4、53.9。在通常情况下,这两个亚甲基应当是等同的,其化学位移也应当相同。在这个化合物中,这种异常的表现可能是因为氮杂环丙基中的氮原子与芳环相连,导致该氮原子具有sp2杂化的成分,与芳环间存在p-π共轭效应,结果使芳环碳原子与这个氮原子间的C—N键有部分双键的成分,致使C—N键不能自由旋转。造成两个亚甲基的化学环境不同,进而使其化学位移改变。为了进一步证实这种推断,我们利用SYBYL-X2.1.1软件对这个化合物进行了能量最小化,以寻找其优势构象。所得到的这个化合物优势构象如图3所示。可以明显地看出在该化合物的优势构象中4-位氮原子呈角锥形,但其角锥高度明显的低于正常sp3的氮原子。表明其中氮原子为不等性杂化,其杂化形式介于sp3和sp2之间。这种不能自由旋转的C—N键必然导致氮杂环丙基中两个亚甲基化学环境相异(如图3所示),从而在NMR谱上表现为两个亚基的上氢和碳有不同的化学位移。
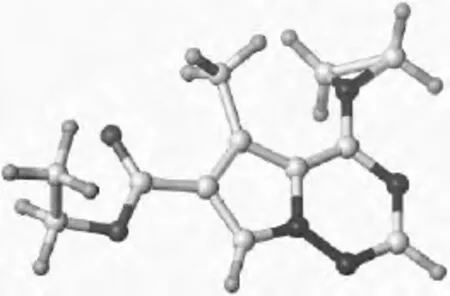
图3 化合物1的最优构象Fig.3 The preferred conformation of product 1
3 结论
本文采用合理可行的合成5-甲基-4-(1-氮杂环丙基)吡咯并[2,1-f][1,2,4]三嗪-6-甲酸乙酯的反应路线,合成路线所需原料廉价易得,反应时间短,各步后处理简单,通过三步反应以43%的总收率获得目标产物。目标产物的结构通过1H NMR、13C NMR、HRMS、FTIR、熔点进行了表征。目标化合物的生物活性研究正在进行之中。
[1]Parenti M D,Pacchioni S,Ferrari A M,et al.Threedimensional quantitative structure-activity relationship analysis of a set of plasmodium falciparum dihydrofolate reductase inhibitors using apharmacophore generation approach[J].Journal of Medicinal Chemistry,2004,47(17):4258-4267.
[2]John T H,Toomas M,Robert B,Discovery of the pyrrolo[1,2-f][1,2,4]triazine nucleus as a new kinase inhibitor template[J].Journal of Medicinal Chemistry,2004,47(16):4054-4059.
[3]John T H,Robert B M.Pyrrolotriazine inhibitors of kinase[P].WO2000071129,2000.
[4]徐中轩,蒋达洪,陈元伟,等.新型吡咯并[2,1-f][1,2,4]三嗪酪氨酸激酶抑制剂的设计与合成 [J].合成化学,2009,17(3):304-308.
[5]Bhide R S,Cai Z W,Zhang Y Z,et al.Discovery and preclinical studies of (R)-1-(4-(4-fluoro-2-methyl-1H-indol-5-yloxy)-5-methylpyrrolo[2,1-f][1,2,4]triazin-6-yloxy)propan-2-ol(BMS-540215),an in vivo active potent VEGFR-2inhibitor[J].Journal of Medicinal Chemistry,2006,49(7):2143-2146.
[6]Cai Z W,Zhang Y,Borzilleri R M,et al.Discovery of Brivanib Alaninate((S)-((R)-1-(4-(4-Fluoro-2-methyl-1-H-indol-5-ylox-y)-5-methyl pyrrolo[2,1-f][1,2,4]triazin-6-yloxy)propan-2-yl)2-aminopropanoate),A novel prodrug of dual vascular endoth-elial growth factor receptor-2and fibroblast growth factor receptor-1kinase inhibitor(BMS-540215)[J].Journal of Medicinal Chemistry,2008,51(6):1976-1980.
[7]孙敏,宗在伟,孙焕亮.抗肿瘤新药布立尼布的合成[J].中国新药杂志,2012,21(17):2065-2068.
[8]Diaz P I,Siu L L.Brivanib alaninate for cancer[J].Expert Opinion on Investigational Drugs,2011,20(4):577-586.
[9]Cohnen E,Dewald R.A simple synthesis of pyrroles[J].Synthesis,1987(6):566-568.
[10]Ogan M D,Tran S B,Rinehart J K.Synthesis of[13C4,15N2]pyrrolo[2,1-f][1,2,4]triazine[J].Journal of Labelled Compounds and Radiopharmaceuticals,2006,49(2):139-140.
[11]Hynes J Jr,Doubleday W W,Dyckman A J,et al.N-amination of pyrrole and indole heterocycles with monochloramine(NH2Cl)[J].European Journal of Organic Chemistry,2004,69(4):1368-1371.

