Ctip2在福尔马林引起的大鼠急性颌面部炎性疼痛中的表达变化
岳 黎, 姜 珊, 熊 伟, 梅 雪, 金幼虹
(南昌大学附属口腔医院: *牙周科; **口腔预防科, 江西 南昌 330006)
Ctip2在福尔马林引起的大鼠急性颌面部炎性疼痛中的表达变化
岳 黎*, 姜 珊*, 熊 伟**, 梅 雪*, 金幼虹*
(南昌大学附属口腔医院:*牙周科;**口腔预防科, 江西 南昌 330006)
目的: 探讨Ctip2在口颌面部炎性疼痛中的作用。方法:取成年健康雌性SD大鼠132只,随机分为3组; 空白对照组大鼠(n=12)不作任何处理,生理盐水(n=60)和福尔马林组(n=60)各大鼠分别在其左侧上唇注射 50 μL生理盐水(n=60)或等量25 mL/L 的福尔马林。注射结束后立即观察各组大鼠在45 min内的疼痛行为,并分别于注射后30 min及1、2、3、4 h各时间点取各组大鼠的脑干延髓段组织(n=12);然后分别采用免疫组化染色(n=4)、免疫荧光染色(n=4)以及RT-PCR(n=4)检测各大鼠Vc核中Ctip2的表达情况。结果:①注射25 mL/L福尔马林后的各大鼠均表现出典型的双时相性疼痛反应,生理盐水对照组仅在注射初期出现自发性痛行为反应,空白对照组无类似表现; ②注射福尔马林后30 min、1 h和2 h各时间点大鼠Vc核中的 Ctip2阳性颗粒数量均明显增多,且分布集中、染色较深(P<0.05);注射福尔马林后30 min、1 h各时间点的荧光阳性颗粒均明显增多(P<0.05);注射福尔马林后30 min时,其Vc核中Ctip2 mRNA表达水平即明显升高,2 h时达到峰值(P<0.05)。结论: Ctip2参与中枢神经系统对炎性疼痛刺激的调节。
福尔马林; 炎性疼痛; 转录因子Ctip2; 三叉神经脊束核尾侧亚核
[Chinese Journal of Conservative Dentistry,2015,25(11):659]
疼痛是一种与组织损伤相关的不愉快的主观感受,是机体应对伤害性刺激而产生的生理及心理因素相结合的复杂情感体验。传递口颌面部伤害性信息的传入神经主要终止于三叉神经脊束核尾侧亚核(Vc核),Vc核不仅是参与口颌面部伤害信息传导和敏化的重要部位,同时也是口颌面部感觉信息的初级传入中枢。伤害性刺激作用于面部末梢神经的伤害性感受器后,即会使其产生冲动,并将激活的信息经过一系列神经中转核团传递到大脑皮层。
转录因子Ctip2 (Chicken ovalbumin upstream promoter-transcription factor (COUP-TF)-interacting protein 2)是由Avram等[1]于2000年发现的被认为是基因表达的主要调节器之一,除参与调控牙釉质[2-4]、颅面骨缝[5]、皮肤[6-7]、T细胞[8]和大脑[9-10]等不同组织的形成及发育外,同时还是牙齿、皮肤、免疫系统和中枢神经系统等发育过程中的关键基因。
本实验通过在大鼠左上唇皮下注射25 mL/L福尔马林液50 μL建立急性炎性疼痛模型,并分别采用免疫组化、免疫荧光染色和逆转录-聚合酶链反应(RT- PCR)等方法,动态观察Ctip2基因在三叉神经脊束核尾侧亚核中表达变化,以探索Ctip2基因在急性炎性疼痛中所扮演的角色。
1 材料和方法
1.1 实验动物和主要试剂
成年健康雌性SD大鼠(南昌大学医学院实验动物科学部提供);兔抗Ctip2 (Abcam,英国);SP-9001免疫组化染色试剂盒、DAB显色试剂盒、山羊抗兔IgG、山羊抗兔FITC、山羊封闭血清、免疫组化一抗稀释液(北京中杉金桥);多聚甲醛(PFA)、水合氯醛(上海国药集团);福尔马林(山东科源制药);β- actin、Ctip2引物(上海Invitrogen);TRNzol、Trans DNA Marker Ⅰ、2×EasyTaq PCR SuperMix(北京全式金生物技术);逆转录试剂盒(ThermoScientific,美国);无核酶水(北京天根生化科技); Triton X -100(Sigma,美国);中性树胶、蔗糖(重庆北碚化学试剂厂);琼脂糖(北京华美生物技术)。
1.2 大鼠颌面部疼痛模型的建立及其疼痛行为观察
取成年健康雌性SD大鼠132只(初始体质量180~200 g),从中随机抽取12只不作任何处理,用于正常对照(A组)。所余120只分别置于30 cm × 30 cm × 30 cm的透明玻璃观察箱内,静置1 h待其熟悉环境后,再将其随机分为实验组(B组)和对照组(C组)(n=60);然后用微量注射器以快速进针的方式分别在B组各大鼠的左侧上唇皮下组织内注射25 mL/L福尔马林50 μL,C组各大鼠分别注射等量生理盐水。注射结束后,立即观察各组大鼠在45 min内的疼痛行为,并以3 min为单位,分别记录其在各时间点内用前爪或后爪抓擦注射部位的持续时间(s)。
1.3 取材
分别于建模后30 min及1、2、3、4 h各时间点,从B、C组中各随机抽取12只大鼠连同A组的12只大鼠一起采用40 g/L多聚甲醛溶液心内灌注法处死,并立即取其脑干延髓段组织。然后再将各组时间点的12只大鼠的脑组织段均分为3等份(每份4只大鼠),其中2份分别用于免疫组化染色、免疫荧光染色。另1份用于实时荧光定量PCR(RT- PCR)检测。
1.4 Ctip2在各组大鼠Vc核中表达变化的观察
1.4.1 免疫组化染色、免疫荧光染色观察
1.4.1.1 脑干组织切片的制备
分别取各组各时间点大鼠的脑干及延髓段组织,以延髓闩平面为基准制作头向4 mm、尾向6 mm 的组织块后,置 40 g/L多聚甲醛溶液4 ℃下进行固定。固定2 h后,再将各组织块转入4 ℃冻存的300 g/L蔗糖溶液中4 ℃下过夜;待其脱水、沉底后,分别进行横向连续冰冻切片(片厚10 μm)。
1.4.1.2 免疫组化染色观察
分别取各组组织切片,放置30 min平衡至室温后用0.01 mol/L PBS摇床漂洗5 min×3次;滴加30 mL/L过氧化氢液室温孵育7 min至无气泡产生;滴加50 g/L BSA封闭液常温下封闭1 h;滴加兔抗Ctip2(1 ∶800)一抗4 ℃过夜;滴加山羊抗兔IgG(二抗)室温孵育20 min;滴加 SABC着色剂常温孵育20 min,DAB显色。以上每个步骤完成后均用0.01 mol/L PBS漂洗3次,每次5 min。取上述处理的所有切片,分别经脱水、透明、中性树脂封片后,用Leica光学显微镜进行观察。分别在每张组织切片上确定Vc核后,再从每张切片中各随机选取5个视野,用ImagePro Plus测定其免疫蛋白的光密度值。
1.4.1.3 免疫荧光染色观察
分别取各组组织切片,放置30 min平衡至室温后用0.01 mol/L PBS摇床漂洗5 min×3次;转入3 g/L triton溶液中浸泡15 min,再次用 PBS摇床漂洗5 min×3次;滴加山羊封闭血清(1 ∶10)常温下孵育1 h;滴加兔抗Ctip2(1 ∶800)一抗,4 ℃过夜; PBS 5 min×3次,滴加山羊抗兔FITC(二抗),室温孵育30 min;PBS漂洗5 min×3次,Hoechst衬染、100 g/L甘油封片,荧光倒置显微镜下观察并拍照。分别在每张组织切片上确定Vc核后,再从每张切片各随机选取5个视野,用ImagePro Plus测定其免疫蛋白的光密度值。
1.4.2 RT- PCR检测各组Vc核中Ctip2 mRNA的表达
1.4.2.1 引物设计
首先通过pubmed的基因数据库查询到大鼠的Ctip2 mRNA基因编码序列为NC-005105.3,位于染色体的 6q32。然后委托Invitrogen公司利用primer 5.0软件设计并合成相关引物,具体引物序列(表1)。
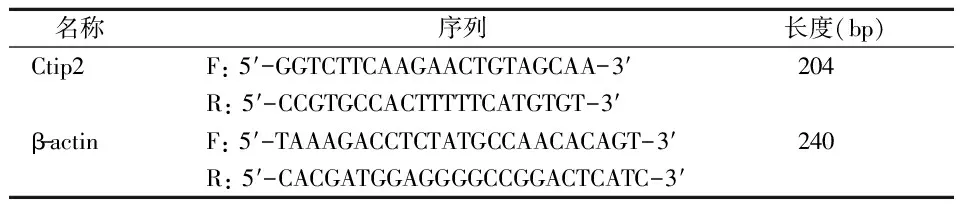
表1 PCR引物序列
1.4.2.2 RT- PCR
分别取各组各时间点大鼠的Vc核组织,用Trizol法提取其总RNA,并逆转录合成cDNA。然后以cDNA为模板,β- actin作为内参照,用荧光定量PCR仪进行实时定量PCR反应。反应条件为:94 ℃× 3 min→94 ℃×45 s, 56 ℃×45 s, 72 ℃×45 s,共32个循环→72 ℃×5 min。PCR反应结束后取10 μL扩增产物,用 15 g/L琼脂糖凝胶进行电泳,并用ChemiDocXRS超高灵敏度化学发光凝胶成像系统进行观察和拍照。
1.5 统计学分析
2 结果
2.1 各组大鼠疼痛行为反应的比较
疼痛行为观察结果显示:在大鼠左上唇皮下注射50 μL福尔马林(B组)后,所有大鼠均出现了典型性双时相的疼痛行为反应,即在注射福尔马林后立即用前(或后)爪快速抓擦注射区的颌面部,持续时间约为3 min(称为急性期),此后(3~9 min时间段)相对平静;9 min后又出现明显而集中的抓擦面部的行为且持续到30 min(该时间段为第二期伤害性反应);30~45 min时间段内仅可见少量且短暂的抓擦行为反应;而A、C组大鼠均无上述类似的表现,C组虽在注射后3 min时也可观察到擦面行为,但属于自然生理行为(图1)。

*与生理盐水组相比P<0.05
2.2 Ctip2在各组大鼠Vc核中表达的变化
2.2.1 免疫组化染色结果
免疫组化染色结果显示,A、C组仅可见少量散在分布的Ctip2阳性颗粒,且颜色较浅(图2a、b);而B组在注射福尔马林后各时间点的Ctip2阳性颗粒数量均较A、C组有所增多,且分布集中、染色较深(图2c~g)。图像分析显示,C组的光密度值虽稍高于A组,但两者无统计学差异(P>0.05);而B组注射福尔马林后30 min、1 h、2 h 各时间点的光密度值均明显高于A、C组(P<0.05), 其中以30 min时的增高程度最大,此后逐渐降低;注射后3、4 h各时间点的光密度值分别与A、C组相比,差异均无统计学意义(P>0.05)(图3)。
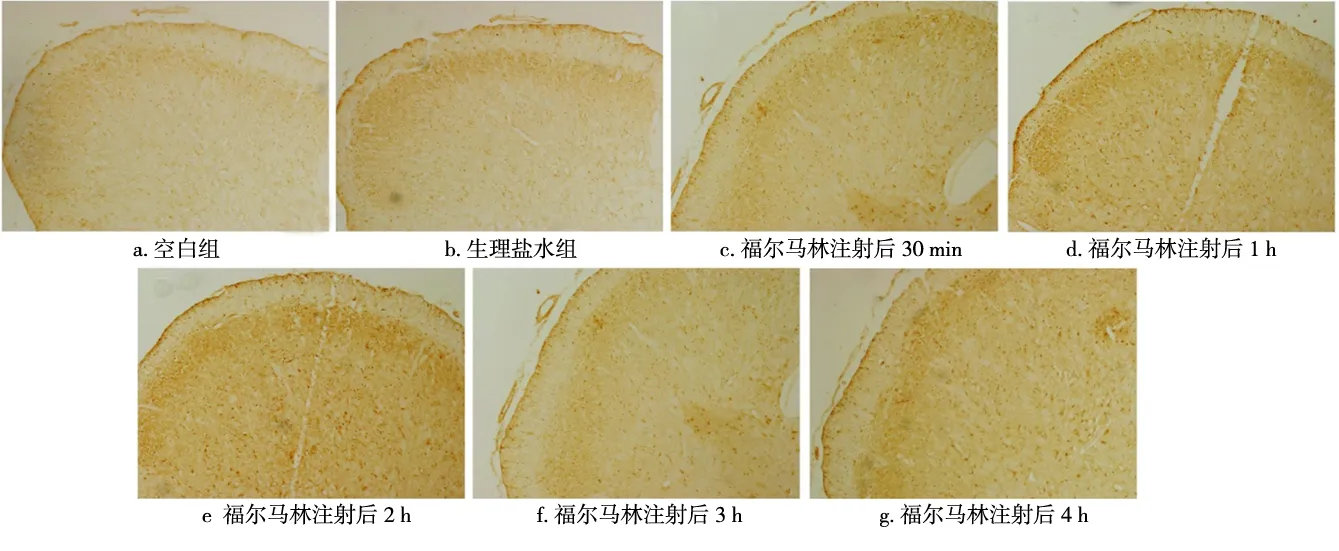
图2 注射福尔马林、生理盐水后其Vc核的Ctip2免疫组化染色结果(×100)

图3 各组Ctip2免疫阳性产物光密度值的比较
2.2.2 免疫荧光染色结果
免疫荧光染色结果与免疫组化染色结果基本一致,B组注射福尔马林后各时间点的Ctip2荧光阳性颗粒数量均较A、C组有所增多(图4)图像。分析显示,B组注射福尔马林后30 min、1 h各时间点的光密度值均明显高于A、C组(P<0.05),其中以30 min时的增高程度最大,此后开始降低;注射后2、3、4 h各时间点的光密度值分别与A、C组相比,差异均无统计学意义(P>0.05)(图5)。
2.2.3 RT- PCR检测结果
RT- PCR检测结果显示,B组大鼠注射福尔马林后30 min,其Vc核中的Ctip2 mRNA表达水平即开始增加,2 h时达到峰值,此后逐渐降低;注射福尔马林后30 min、1 h、2 h各时间点分别与A、C组相比,差异均有统计学意义(P<0.05)(图6~7)。
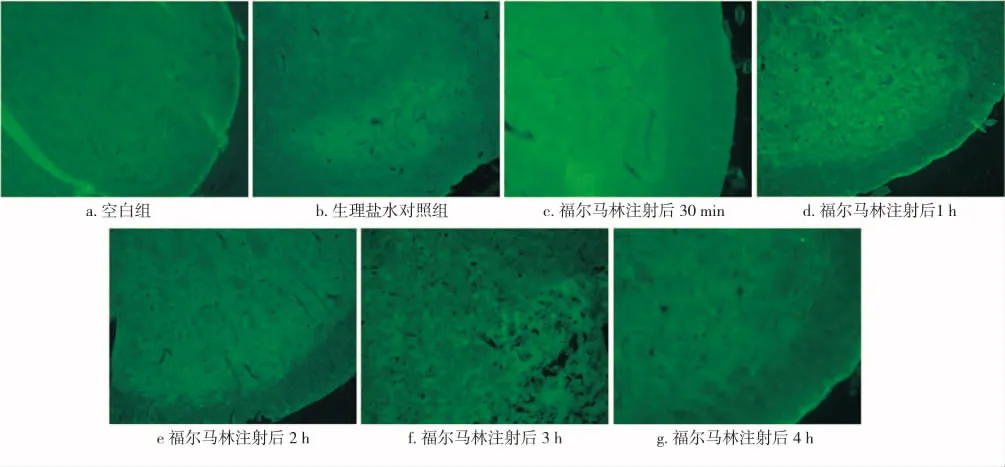
图4 注射福尔马林、生理盐水后其Vc核Ctip2免疫荧光染色结果(×100)
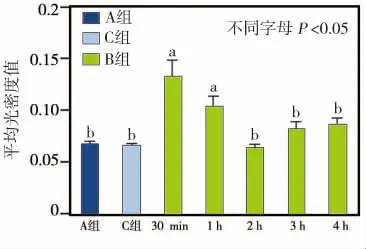
图5 各组Ctip2免疫阳性产物光密度值比较

M: Marker, 1~7分别为:空白对照组, 生理盐水组, 福尔马林注射后30 min、1 h、2 h、3 h、4 h
图6 Vc核Ctip2 mRNA的PCR电泳图

图7 各组mRNA表达水平的比较
3 讨论
疼痛是各种疾病最常见的症状,严重困扰着人们的日常生活。为了探讨疼痛的治疗方法,人们发明了福尔马林致炎性疼痛的动物模型。
许多研究均发现,在大鼠的面部皮下注射福尔马林后,可致其三叉神经脊束核尾侧亚核中的c- fos和GFAP表达水平增加[11]。在野生型大鼠的皮下注射福尔马林液后,其脊髓背角中的c- Fos表达水平上升,而丝氨酸消旋酶(Serine Racemase)的表达下降;与野生型小鼠相比,丝氨酸消旋酶敲除后的小鼠对福尔马林激起的炎性痛更敏感[12];因此,中枢神经元的C- fos的表达水平常被作为颌面部炎性疼痛刺激程度的观察指标[13]。
本实验为探讨Ctip2基因在炎性疼痛中所扮演的角色,首先采用福尔马林皮下注射法建立了大鼠颌面部炎性疼痛模型;疼痛行为观察结果显示,注射福尔马林后所有大鼠均出现了典型的双时相疼痛行为学反应,说明口腔颌面部炎症性疼痛模型成功建立。
转录因子Ctip2 基因编码C2H2 锌指蛋白,属于krüppel样转录因子。在人类位于14号染色体的长臂14q32 .31 位点上;在小鼠则位于12号染色体的52.0 cM位点[14]上。目前许多研究都着手于通过从生殖细胞内敲除或从特定细胞内删除Ctip2基因,来探讨其对牙齿[2]、颅面骨[6]、皮肤[15]、T细胞[16]和皮质脊髓运动神经元[17]等发育的影响,并已明确Ctip2是这些组织发育过程中相关基因表达的主要调节器之一。但Ctip2基因在急性炎性痛中的作用尚鲜有报道。
本实验中免疫组化染色结果显示,实验组注射福尔马林后30 min、1 h、2 h各时间点,其Ctip2阳性染色颗粒的数量均较正常对照组、生理盐水对照组明显增多,且分布集中、染色较深;免疫荧光染色结果显示,实验组注射福尔马林后30 min、1 h组各时间点分别与生理盐水对照组和正常对照组相比,其Ctip2荧光阳性颗粒明显增多,而2 h后其阳性表达颗粒则减少至生理盐水对照组的水平;RT- PCR检测结果显示,实验组注射福尔马林后30 min,其Vc核中的Ctip2 mRNA表达水平开始增加, 2 h时达到峰值,此后逐渐降低,实验组各时间的Ctip2 mRNA表达水平分别与正常对照组和生理盐水对照组相比,除3、4 h无统计学差异(P>0.05)外,其他各时间点均有统计学差异(P<0.05)。
综上所述,在大鼠上唇皮下注射福尔马林后,其Vc核中的Ctip2基因表达水平呈现时间性动态变化,说明Ctip2可能参与了二级神经元的兴奋调节;同时也提示,Ctip2基因的表达变化可以作为颌面部炎性疼痛程度的观察指标。但本实验仅观察了Ctip2的表达变化规律,其在炎性疼痛中的具体作用机制还有待进一步研究探索。
[1]Avram D, Fields A, Pretty On Top K,etal. Isolation of a novel family of C(2)H(2) zinc finger proteins implicated in transcriptional repression mediated by chicken ovalbumin upstream promoter transcription factor (COUP- TF) orphan nuclear receptors[J].JBiolChem, 2000,275(14): 10315-10322.
[2]Katsuragi Y, Anraku J, Nakatomi M,etal. Bcl11b transcription factor plays a role in the maintenance of the ameloblast- progenitors in mouse adult maxillary incisors[J].MechDev,2013, 130(9-10):482-492.
[3]Kyrylkova K, Kyryachenko S, Biehs B,etal. BCL11B regulates epithelial proliferation and asymmetric development of the mouse mandibular incisor[J].PLoSOne,2012, 7(5):e37670.
[4]Adiningrat A, Tanimura A, Miyoshi K,etal. Ctip2- mediated Sp6 transcriptional regulation in dental epithelium- derived cells[J].JMedInvest, 2014, 61(1-2):126-136.
[5]Holmes G, van Bakel H, Zhou X,etal. BCL11B expression in intramembranous osteogenesis during murine craniofacial suture development[J].GeneExprPatterns, 2015, 17(1):16-25.
[6]Wang Z, Kirkwood JS, Taylor AW,etal. Transcription factor Ctip2 controls epidermal lipid metabolism and regulates expression of genes involved in sphingolipid biosynthesis during skin development[J].JInvestDermatol, 2013, 133(3):668-676.
[7]Zhang LJ, Bhattacharya S, Leid M,etal. Ctip2 is a dynamic regulator of epidermal proliferation and differentiation by integrating EGFR and Notch signaling[J].JCellSci, 2012, 125(23): 5733-5744.
[8]Hirose S, Touma M, Go R,etal. Bcl11b prevents the intrathymic development of innate CD8 T cells in a cell intrinsic manner[J].IntImmunol, 2015, 27(4):205-215.
[9]Cobos I, Seeley WW. Human von Economo neurons express transcription factors associated with Layer V subcerebral projection neurons[J].CerebCortex, 2015, 25(1):213-220.
[10]Guibinga GH, Barron N, Pandori W. Striatal neurodevelopment is dysregulated in purine metabolism deficiency and impacts DARPP- 32, BDNF/TrkB expression and sgnaling: new insights on the molecular and cellular basis of lesch- nyhan syndrome[J].PloSOne, 2014, 9(5): e96575.
[11]朱东望, 刘洪臣, 张勇, 等. 面部皮下福尔马林注射致大鼠三叉神经脊束核尾侧亚核c- fos和GFAP表达的动态变化[J]. 中华老年口腔医学杂志, 2010,13(1):1-4.
[12]Tabata- Imai A, Inoue R, Mori H. Increased sensitivity to inflammatory pain induced by subcutaneous formalin injection in serine racemase knock- out mice[J].PLoSOne, 2014, 9(8): e105282.
[13]Barr GA. Formalin- induced c- fos expression in the brain of infant rats[J].JPain, 2011,12(2): 263-271.
[14]Satterwhite E, Sonoki T, Willis TG,etal. The BCL11 gene family: involvement of BCL11A in lymphoid malignancies[J].Blood, 2001, 98(12):3413-3420.
[15]Wang ZX, Zhang LJ, Guha GJ,etal. Selective Ablation of Ctip2/Bcl11b in epidermal keratinocytes triggers atopic dermatitis- like skin inflammatory responses in adult mice[J].PLoSOne, 2012, 7(12): e51262.
[16]Takachi T, Takahashi M, Takahashi- Yoshita M,etal. Human T- cell leukemia virus type 1 Tax oncoprotein represses the expression of the BCL11B tumor suppressor in T- cells[J].CancerSci, 2015, 106(4):461-465.
[17]Arlotta P, Molyneaux BJ, Jabaudon D,etal. Ctip2 controls the differentiation of medium spiny neurons and the establishment of the cellular architecture of the striatum[J].JNeurosci, 2008, 28(3): 622-632.
Expression of Ctip2 in formalin- induced acute maxillofacial inflammatory pain in rats
YUE Li*, JIANG Shan, XIONG Wei, MEI Xue, JIN You- hong
(*Departmentofperiodontics,TheAffiliatedStomatologicalHospitalofNanchangUniversity,Nanchang330006,China)
AIM: To investigate the changes of Ctip2 expression in caudal subnucleus of the spinal trigeminal nucleus (Vc) in rats with formalin-induced orofacial pain . METHODS: 132 adult female SD rats were randomly divided into 3 groups. The rats in control group(n=12) received no injection, in formalin or saline group (n=60) were injected with 50 μL of 25 mL/L formalin or the same volume of 0.9% saline into the left upper lips, respectively. The behavior of the rats was observed for 45 minutes. Their Vc were taken at 30, 60, 120, 180 and 240 minutes after injection respectively, Citp 2 expression in Vc was examined by immunochemistry, immunofluorescence and RT- PCR. RESULTS: The rats scratched the injected sites after administration of formalin, but did not in saline or control groups. Ctip2 protein expression was significantly upregulated in the rats 30 min,1 h and 2 h after formalin injection. Ctip2 mRNA was remarkably increased and reached the peak 2 h after administration of formalin. CONCLUSION: Ctip2 participates in regulating inflammatory pain in central nerve system.
formalin; inflammatory pain; transcription factor Ctip2; caudal subnucleus of the spinal trigeminal nucleus
2015-06-22;
2015-09-29
江西省教育厅科技计划课题(12003268)
岳 黎(1987-),女,汉族,山东人。硕士 姜珊为共同第一作者
金幼虹, E-mail: yhjin3713@sina.com
R780.2
A
1005-2593(2015)11-0659-06
10.15956/j.cnki.chin.j.conserv.dent.2015.11.004

