不同分子量鹿茸多肽抗氧化活性的研究
刘春娟
(1.吉林省经济管理干部学院,吉林长春130012;2.吉林大学生物与农业工程学院,吉林长春 130025)
不同分子量鹿茸多肽抗氧化活性的研究
刘春娟
(1.吉林省经济管理干部学院,吉林长春130012;2.吉林大学生物与农业工程学院,吉林长春 130025)
本文利用膜分离技术获得不同分子量段的鹿茸多肽,采用五种抗氧化检测方法对其进行全面的抗氧化活性分析,获得抗氧化活性较好的多肽Ⅲ片段,分子量在6214u以下。实验结果表明,当浓度在0.1~10.0mg/mL范围之间,多肽Ⅲ对超氧阴离子自由基清除能力和对还原能力低于VC;当浓度为10.0mg/mL时,多肽Ⅲ对DPPH自由基的清除能力与VC基本相当;当浓度在8.0~10.0mg/mL时,对羟自由基的清除率和对脂质体氧化抑制能力高于VC。
鹿茸多肽,抗氧化活性,不同分子量,膜分离技术
鹿茸是一种国内外常用名贵滋补品和中药材。鹿茸中含有多种生物活性物质,在临床上被用于多种疾病的治疗。鹿茸多肽是鹿茸中重要的生物活性物质,具有免疫调节、抗氧化、抗疲劳、促进组织愈合和修复等作用[1]。目前获得鹿茸多肽的方法以酶解鹿茸蛋白,分离纯化降解产物为主[2-3]。因此运用现代化的科学技术从酶解液中分离多肽,寻找出具有代表性的生物活性物质,将对工业化生产具有深远的意义。
本文首次利用膜分离技术将鹿茸蛋白酶解产物按分子量不同进行分段,获得不同分子量段的鹿茸多肽,并采用多种抗氧化检测方法测定其抗氧化活性,以期得到抗氧化活性较好的鹿茸多肽,为拓宽鹿茸的应用途径——天然抗氧化剂,提供基础理论依据。
1 材料与方法
1.1 材料与仪器
梅花鹿鹿茸(二杠,带血茸) 购自长春市双阳区梅花鹿养殖户;Papain木瓜蛋白酶 丹麦诺维信公司;抗坏血酸(VC)为化学对照品 中国药品生物制品检定所;Gly-Gly-Tyr-Arg Sigma公司;DPPH(2,2-diphenyl-2-picrylhydrazy hydrate) Sigma公司;多肽分子量标准品(3496~14200u) 美国Amersham公司。
紫外可见分光光度计UV-2550 岛津国际贸易有限公司;433D全自动氨基酸分析仪 德国SYKAM;DYY-8C电泳仪 DYCZ-24D电泳槽,北京市六一仪器厂;MSC300超滤杯 上海膜速科学器材有限公司;聚醚砜膜,膜面积0.002m2,截留分子量为10、5、3ku 北京安得膜分离技术工程有限公司。
1.2 实验方法
1.2.1 样品的制备 采用超高压技术提取[4]鹿茸蛋白,经冻干得到鹿茸蛋白冻干粉。称取鹿茸蛋白冻干粉进行酶解[5],将酶解液按分子量不同分成三段多肽,选用截留分子量为3、5、10ku的膜片,用分子量为0.2ku的膜片对3ku膜下液进行浓缩。得到三段分子量范围为5~10ku的多肽Ⅰ,3~5ku的多肽Ⅱ,0.2~3ku的多肽Ⅲ。
1.2.2 多肽含量的测定 参照文献[6]测定蛋白水解液中多肽的含量。
1.2.3 DPPH清除能力的测定 参照文献[7]。用无水乙醇配制DPPH溶液2×10-4mol/L,避光,保存备用。精确吸取2mL样品于试管中,加入2mL DPPH溶液,充分混合、摇匀,水浴(27℃)30min后倒入比色皿中,于517nm处测定其吸光度值Ai,同样测定2mL样品液和2mL无水乙醇的吸光度值Aj以及2mL DPPH溶液加入2mL蒸馏水的吸光度值A0。用蒸馏水作空白。DPPH自由基清除率(P)计算公式:
P(%)=[1-(Ai-Aj)/A0]×100
平行测定三次,取平均值。
1.2.4 羟自由基清除能力的测定 参照文献[8]。在干燥的试管中分别加入2.0mmol/L硫酸亚铁溶液1.5mL、30mmol/L过氧化氢溶液1.5mL、6.0mmol/L水杨酸溶液1.5mL,振荡,摇匀,于37℃水浴,15min后取出,在510nm处测其吸光度A0,然后加入样液2.0mL,振荡,摇匀,于37℃水浴15min后取出,测其吸光度A。清除率计算公式为:
清除率(%)=[(A0-A)/A0]×100
平行测定三次,取平均值。
1.2.5 超氧阴离子自由基清除能力的测定 参照文献[9]。在干燥的试管中加入4.5mL 0.05mol/L的Tris-HCL缓冲溶液(pH8.2),4.0mL去离子水,0.2mL待测样液,混匀后,置于25℃恒温水浴10min。取出后迅速加入0.3mL(25℃温浴10min)的邻苯三酚溶液(3mmol/L,10mmol/L HCL配制),混匀后立即在320nm下测定,每隔30s测定1次吸光度值,记录4min内吸光度值的变化,并求出其变化斜率,用10mmol/L HCL代替邻苯三酚做空白调零。用去离子水代替样品溶液同样方法测定4min内吸光度值的变化,并求出其变化斜率。平行测定三次,取平均值。清除率计算公式为:
清除率(%)=[(k0-k)/k]×100
式中:k0为空白管吸光度值变化斜率;k为样品管吸光度值变化斜率。
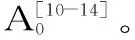
脂质体氧化抑制率P(%)=[(A0-Ai)/A0]×100
1.2.7 还原能力的测定 参照文献[15]。吸取样品液2mL于试管中,加入2mL磷酸盐缓冲液(0.2mol/L,pH6.6)和2mL铁氰化钾溶液(1%)。充分混匀,放置于50℃水浴20min,冷却到室温后,然后在反应混合物中加入2mL三氯乙酸溶液(10%),混合后离心(3000r/min)10min,取上清液2mL,加入2mL蒸馏水及0.4mL三氯化铁溶液(0.1%),反应10min后,测定其在700nm处的吸光度值,样品还原能力越强,吸光度值就会越大。平行测定三次,取平均值。
1.2.8 Tricine-SDS-聚丙烯酰胺凝胶电泳(Tricine-SDS-PAGE) 采用小分子多肽常用的电泳分析法Tricine-SDS-PAGE电泳[16-17]。将样品与缓冲液按一定比例混合,取上清液10μL进行分析。
1.2.9 氨基酸组分测定 采用氨基酸自动分析仪测定水解液中氨基酸的含量,具体测定方法参照GB/T 18246-2000。
2 结果与分析
2.1 不同分子量鹿茸多肽DPPH自由基清除能力
DPPH是一种稳定的以氮为中心的自由基,其乙醇溶液呈紫色,在517nm附近有强吸收,当有自由基清除剂加入DPPH溶液时,溶液颜色变浅,吸收减弱,吸收减弱的程度可以评价某种活性物质的抗氧化能力,DPPH自由基的清除率越大,说明物质的抗氧化能力越强[18-20]。测定不同浓度的多肽Ⅰ、多肽Ⅱ、多肽Ⅲ对DPPH自由基的清除率,与VC进行比较,由图1可以看出,VC对DPPH自由基的清除率非常高,多肽Ⅰ、多肽Ⅱ、多肽Ⅲ对DPPH自由基的清除能力,在低浓度时明显弱于VC,当多肽浓度为10.0mg/mL时,多肽Ⅲ与VC对DPPH自由基的清除能力基本相当。

图1 DPPH自由基清除能力比较Fig.1 Comparison of DPPH radical scavenging ability
2.2 不同分子量鹿茸多肽羟自由基清除能力
采用水杨酸比色法测定羟自由基清除能力,根据Fenton反应原理,反应体系中的水杨酸能捕捉·OH,生成在510nm处有最大吸收峰的有色物质,吸光值与·OH的量成正比,如果向反应体系中加入具有清除·OH能力的物质,会减少水杨酸和·OH的结合,吸光值降低,即可测出被测物·OH清除率。由图2可以看出,三种多肽段对羟自由基清除能力在0.1~10.0mg/mL浓度范围内,随着多肽浓度的增加而增大。其中在高浓度8.0~10.0mg/mL下,多肽Ⅲ对羟自由基的清除率高于VC,表现出了较强的对羟自由基的清除能力。

图2 羟自由基清除能力比较Fig.2 Comparison of hydroxyl radicals scavenging ability
2.3 不同分子量鹿茸多肽超氧阴离子自由基清除能力
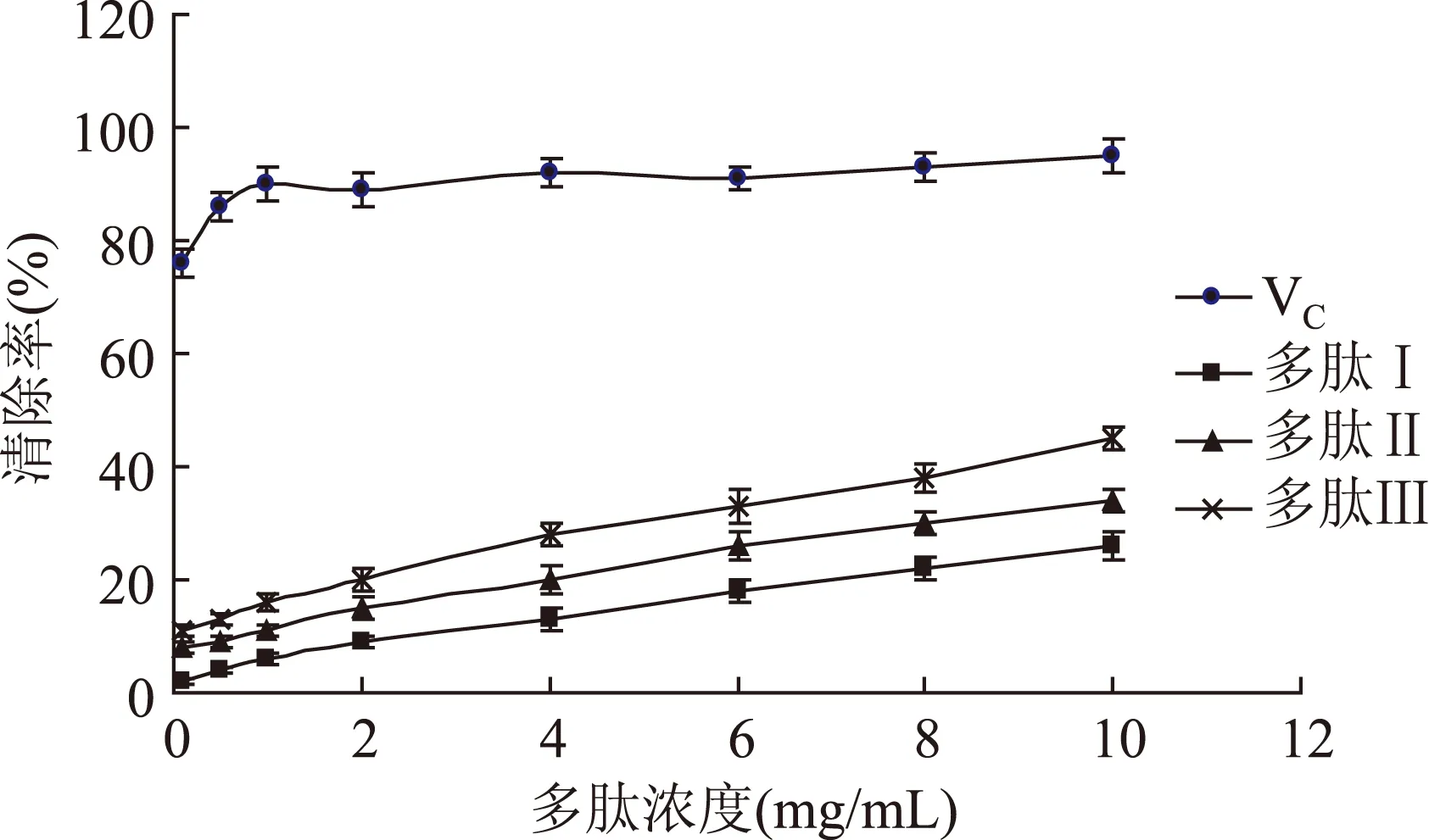
图3 超氧阴离子自由基清除能力比较Fig.3 Comparison of superoxide anion radical scavenging ability
2.4 不同分子量鹿茸多肽脂质体氧化抑制能力
脂质体氧化法是一种模拟细胞膜脂质氧化的体外实验方法。鹿茸多肽对脂质体氧化抑制能力结果如图4所示。当多肽浓度超过4.0mg/mL之后,多肽Ⅱ和多肽Ⅲ对脂质体氧化抑制能力高于VC。研究显示蛋白质(多肽)的乳化性与分子中疏水性基团的数量、种类及其在分子中分布有关。酶水解作用可能导致紧密的蛋白质分子构象被破坏,从而使被包埋于分子内部的疏水性氨基酸侧链基团暴露出来,易于与脂类结合,形成稳定的乳化体系[22]。相对水溶性的VC来说,有良好的乳化性能的多肽能够有效抑制卵磷脂分散体系中脂质体过氧化。
2.5 不同分子量鹿茸多肽还原能力
采用普鲁士蓝反应法测定鹿茸多肽的还原能力。在还原剂(样品)的作用下,K3Fe(CN)6被还原成K4Fe(CN)6,然后会与Fe3+反应形成普鲁士蓝K4(Fe(CN)6)3,普鲁士蓝在700nm处有最大吸收峰,其吸光度值越高,普鲁士蓝的生成量越大,表明还原剂还原能力越强[23]。 由图5可知,在0.1~10.0mg/mL浓度范围内,三种多肽段的吸光度值明显低于同浓度的VC,说明三种多肽段的还原能力相对于VC来说比较差。

图4 脂质体氧化抑制能力比较Fig.4 Comparison of liposome oxidation inhibitory ability

图5 还原能力比较 Fig.5 Comparison of reducing power
2.6 Tricine-SDS-PAGE电泳结果分析
SDS-PAGE利用蛋白质分子量不同对其进行分离,是一种经济、快速、易于操作且可重复的方法,现已成为在许多研究领域中一种重要的分析技术。鹿茸多肽(多肽Ⅰ、多肽Ⅱ、多肽Ⅲ)Tricine-SDS-PAGE电泳图谱见图6。从图中可以看到,在6000u到10000u附近,多肽Ⅰ条带较清晰;多肽Ⅱ分子量集中在3496u到8159u之间;抗氧化性相对较好的多肽Ⅲ因为分子量较小,分离效果不理想,但从图中可以看出主要部分的分子量在6214u以下。
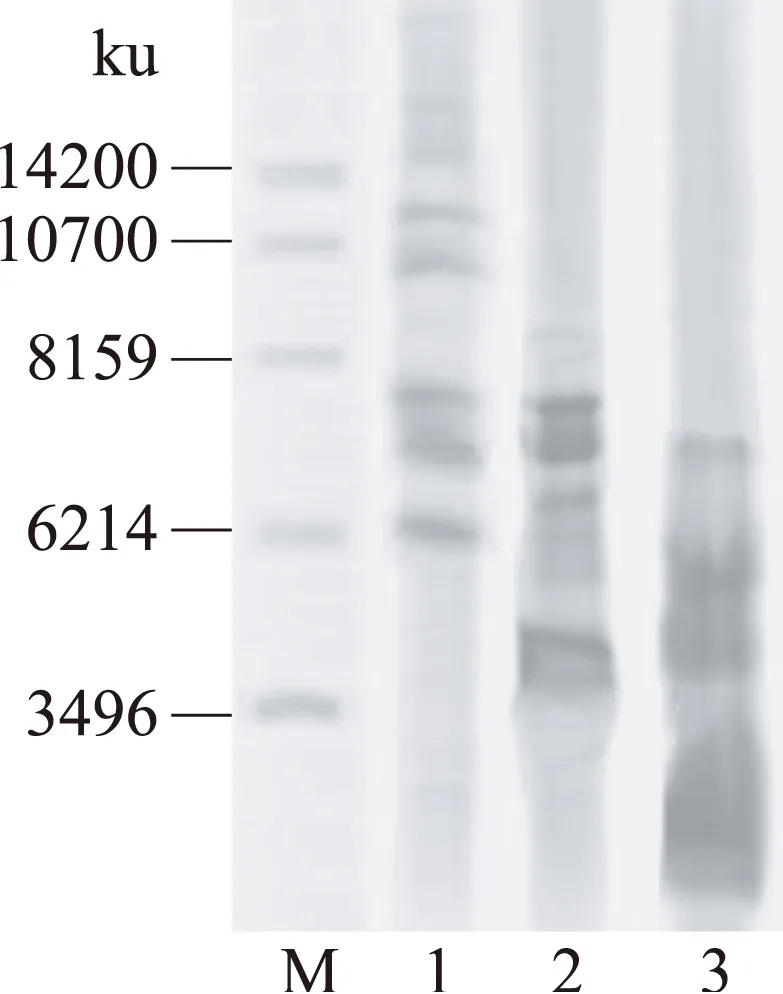
图6 鹿茸多肽Tricine-SDS-PAGE电泳图谱Fig.6 Tricine-SDS-PAGE analysis of velvet antler peptide注:M-标准蛋白;1-多肽Ⅰ;2-多肽Ⅱ;3-多肽Ⅲ。
2.7 鹿茸多肽氨基酸组成分析
从不同体外抗氧化实验的结果中可以看出,总体抗氧化能力最强的组分是多肽Ⅲ。对其氨基酸组成进行测定分析,结果如表1。检测结果为氨基酸占总固形物的百分含量。

表1 多肽Ⅲ氨基酸组成Table 1 Composition of amino acid of peptide Ⅲ
有文献研究显示许多氨基酸及其衍生物具有抗氧化能力,如Leu、Gly、Ala、Glu、Asp、His、Tyr等。其中由于抗氧化肽具有Ala、Val、Leu疏水性的非极性脂肪烃侧链,加强了其与疏水性多不饱和脂肪酸相互作用,含有这些疏水性氨基酸的多肽能够通过与氧的结合,抑制脂质中氢的释放,脂质过氧化链反应被延缓,从而对脂质体系起到保护作用,起到抗氧化的作用[24]。由表1可以看出,多肽Ⅲ中三种氨基酸:Leu含量为7.69%,Glu含量为6.15%,Gly含量为5.01%,相对而言含量非常高,因此多肽Ⅲ在脂质体氧化抑制能力的测定时显现出较强的抑制力。
3 结论
通过五种方法比较不同分子量大小鹿茸多肽的抗氧化活性,发现分子量最小的鹿茸多肽Ⅲ具有最高的抗氧化活性,分子量在6214u以下。体外抗氧化活性实验研究显示,当浓度在0.1~10.0mg/mL范围之间,多肽Ⅲ对超氧阴离子自由基清除能力和对还原能力低于VC;当浓度为10.0mg/mL时,多肽Ⅲ对DPPH自由基的清除能力与VC基本相当;当浓度在8.0~10.0mg/mL时,对羟自由基的清除率和对脂质体氧化抑制能力高于VC。因此鹿茸多肽Ⅲ具有成为一种天然抗氧化剂的潜力。
[1]佟鑫,刘玉侠,吴荻,等.鹿茸多肽组分的药理作用研究进展[J].中国医药技术经济与管理,2009(4):60-63.
[2]王华,黄宜兵,高科翔,等.酶解鹿茸肽的制备、纯化及抗氧化活性[J].高等学校化学学报,2010,31(12):2390-2395.
[3]郑帆,李仁宽,王辉林,等.鹿茸冻干粉的酶解及其酶解产物性质的研究[J].中国中药杂志,2010,35(19):2628-2633.
[4]郭文晶,从福仲,张守勤.鹿茸蛋白的高压提取及生物活性测试[C].Proceedings of 2010 First International Conference on Cellular;Molecular Biology;Biophysics and Bioengineering,December 25-26,2010. USA:IEEE,2010.
[5]刘春娟.鹿茸和鹿血活性多肽的研究[D].吉林:吉林大学,2012.
[6]鲁伟,任国谱,宋俊梅,等.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171.
[7]王萍,葛丽花.阿魏酸低聚糖的体外抗氧化性质的研究[J].食品研究与开发,2007,28(3):8-11.
[8]文赤夫,董爱文,罗庆华,等.紫花地丁中芹菜素提取和清除自由基活性研究[J].现代食品科技,2006,22(1):20-23.
[9]王群,郑海涛,葛尧,等.酶法制备鲽鱼鱼皮胶原蛋白肽及其清除超氧阴离子自由基的研究[J].中国农学通报,2011,27(14):87-93.
[10]陈欣欣,许时婴.黑莓渣提取物中多酚类化合物抗氧化活性的研究[J].食品工业,2007(3):3-6.
[11]靳学远,唐艳红,秦霞.苹果渣多酚抗氧化性质的研究[J].广西轻工业,2007(1):3-4.
[12]Sellappan S,Akoh CC,Krewer G. Phenolic Compounds and Antioxidant Capacity of Georgia-Grown Blueberries and Blackberries[J]. J Agric Food Chem,2002,50(8):2432-2438.
[13]Dorman HJ,Kosar M,Kahlos K,et al. Antioxidant properties and composition of aqueous extracts from Mentha Species,hybrids,varieties and cultivars[J]. J Agric Food Chem,2003,51(16):4563-4569.
[14]豆海港,陈文学,仇厚援,等.花椒提取物抗氧化作用研究[J].食品研究与开发,2006,27(7):14-16.
[15]Oyaizu M. Antioxidative activities of browning products of glucosamine fractionated by organic solvent and thin-layer chromatography[J]. J Jpn Soc Food Sci,1988,35(11):771-775.
[16]王旭,何冰芳,李霜,等.Tricine-SDS-PAGE电泳分析小分子多肽[J].南京工业大学学报,2003,25(2):79-81.
[17]Schägger H,Von Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kda[J]. Anal Biochem,1987,166(2):368-397.
[18]彭长连.用清除有机自由基DPPH法评价植物抗氧化能力[J].生物化学与生物物理进展,2000,27(6):658-661.
[19]许钢.红薯中黄酮提取及抗氧化研究[J].食品与生物技术学报,2007,26(4):22-27.
[20]张燕平,张虹,洪咏平,等.食品安全、营养与发展[M].北京:中国农业科技出版社,2002:76.
[21]Cotelle N,Bernier JL,Catteau JP,et al.. Antioxidant Properties of Hydroxy-Flavones[J]. Free Radical Biology & Medicine,1996,20(1):35-43.
[22]Qi M,Hettiarachchy NS,Kalapathy U. Solubility and emulsifying properties of soy protein isolates modified by pancreatin[J]. J Food Sci,1997,62(6):1110-1115.
[23]Shimada K,Fujikawa K,Yahara K,et al. Antioxidative properties of xanthan on the antioxidation of soybean oil in cyclodextrin emulsion[J]. J Agric Food Chem,1992,40:945-948.
[24]王嘉榕,滕达,田子罡,等.功能性抗氧化肽制备与机制研究进展[J].天然产物研究与开发,2008,20:371-375.
Study on antioxidant activity of antler peptideswith different molecular weight
LIU Chun-juan
(1.Jilin Province Economic Management Cadre College,Changchun 130012,China;2.College of Biology and Agriculture Engineering,Jilin University,Changchun 130025,China)
Antler peptides with different molecular weight cutoff were prepared by membrane technology and their antioxidant activities were evaluated by five kinds of methods. The results indicated that the antioxidant activity of peptide III was the best,and its molecular weight was less than 6214u. The ability of O-2·free radical scavenging and the reducing of the peptide III were weaker than that of VCwhen their concentration was in the range of 0.1~10.0mg/mL,and the ability of DPPH· free radical scavenging of the peptide III was the same as VCwhen their concentration was 10.0mg/mL. But the ability of hydroxyl radicals scavenging and the liposome oxidation inhibition of the peptide III were higher than that of VCwhen their concentration was in the range of 8.0~10.0mg/mL.
velvet antler peptides;antioxidant activity;different molecular weight;membrane technology
2014-09-02
刘春娟(1977- ) ,女,博士,副教授, 研究方向:从事食品及天然产物的研究与开发。
国家自然科学基金项目( 30472135);长春市科技支撑计划项目(08KZ35)。
TS202.1
A
1002-0306(2015)13-0053-04
10.13386/j.issn1002-0306.2015.13.002

