沙枣多糖结构的初步研究
刘晓庆,刘会平,赵 范,张晨萍,王 宇,徐娇娇
(天津科技大学食品工程与生物技术学院,天津 300457)
沙枣多糖结构的初步研究
刘晓庆,刘会平*,赵 范,张晨萍,王 宇,徐娇娇
(天津科技大学食品工程与生物技术学院,天津 300457)
采用热水浸提法从沙枣中提取沙枣多糖,经Sevage法除蛋白,乙醇沉淀,离心、流水透析、DEAE-cellulose52和Sephadex G-100纯化、浓缩、冻干后得沙枣多糖(EAP-1a),并利用苯酚-硫酸法、紫外、红外、气相色谱、刚果红实验、核磁共振技术及原子力显微镜进行多糖组分、含量、结构的分析研究。结果表明:沙枣多糖主要由阿拉伯糖、木糖、葡萄糖及半乳糖组成,还含有少量的鼠李糖和甘露糖,其摩尔比为0.029∶0.74∶0.51∶0.039∶1.0∶5.19。高效液相色谱计算多糖数均分子量约61421u;红外光谱及核磁共振图谱表明沙枣多糖具有α-吡喃葡萄糖环,具有糖类物质的结构特征;AFM观测结果表明EAP-1a呈长链状形态,可缠绕形成棒状纳米聚集体且具有三股螺旋结构。
沙枣,多糖,纯化,结构
沙枣(ElaeagnusangustifoliaL.),又名桂香柳、七里香等,是胡颓子科胡颓子属植物,生长于半干旱、干旱、半荒漠、荒漠地区。沙枣果实具有多种药物用途及营养价值。许多药理实验表明,沙枣果实浸出物的浓缩液具有抗炎镇痛、抗肿瘤、抗腹泻、抗氧化、降血脂等功能[1]。目前,对于沙枣多糖(ElaeagnusangustifoliaL. polysaccharides,简称EAP)的研究,国内主要集中在其提取工艺条件的优化,对其结构的研究较少,而国外未见有关沙枣多糖的报道。本文在对沙枣多糖纯化的基础上,分析了其基本理化性质,并对纯化的沙枣多糖的结构进行了初步分析,为系统研究沙枣多糖的结构以及构效关系奠定基础。
1 材料与方法
1.1 材料与仪器
沙枣 购自新疆喀什薇客多特产专卖店;DEAE-cellulose 52 Sloarbio;Sephadex G-100 Solarbio;其他试剂 均为国产分析纯。
红外光谱仪 德国BRUKER公司;气相色谱仪 日本岛津公司;DRX-400核磁共振仪 瑞士Bruker公司;原子力显微镜 日本JEOL;旋转蒸发仪上海 亚荣生化仪器厂;紫外可见分光光度计 津制。
1.2 沙枣多糖的提取
采用水提醇沉法提取多糖[2]。
沙枣的预处理:取晒干后的沙枣,用清水去除表面污物,低温烘干,去核、粉碎,过60目筛,制成沙枣粉。
定量称取干燥后的沙枣粉,放入烧杯中,按1∶35(w/v)的比例加入蒸馏水,于80℃水浴磁力搅拌2h,取出冷却至室温,4000r/min离心10min,收集上清液。取下层滤渣再按比例1∶35(w/v)加入蒸馏水,水浴磁力搅拌重复提取两次,合并三次提取的上清液,用旋转蒸发仪浓缩至约1/3体积。浓缩后的多糖提取液用80%的无水乙醇进行醇析,置4℃冰箱中过夜;4000r/min,离心10min,弃掉上清液,冷冻干燥,得到沙枣粗多糖。
1.3 沙枣多糖粗品纯化
1.3.1 多糖脱蛋白处理 采用Sevage法除蛋白[3],多糖提取液按体积比4∶1加入氯仿-正丁醇(体积比4∶1)混合液,剧烈震荡30min,4000r/min,离心20min,待其分层后弃掉下层的Sevage溶液和中间的蛋白质层,上层多糖溶液继续加入Sevage试剂重复上述步骤5~6次,直至不再出现蛋白层为止,浓缩后收集多糖溶液,冷冻干燥得EAP。
1.3.2 EAE-52离子交换柱分级纯化 将规格为1.2cm×50cm色谱层析柱中装入DEAE-52纤维素,用蒸馏水平衡过夜。粗多糖用蒸馏水溶解,上样(浓度为5mg/mL,上样量25mg),分别用蒸馏水及0~0.5mol/L NaCl经行线性梯度洗脱,4.0mL/管分部收集,洗脱速度为1mL/min,逐管使用苯酚-硫酸法及紫外280nm下检测多糖含量和蛋白质含量。收集合并含糖主峰,蒸馏水透析至无Cl-检出,冷冻干燥备用。
1.3.3 多糖的Sephadex G-100纯化 将Sephadex G-100装入2.6cm×50cm色谱层析柱中,用蒸馏水平衡后准备上样。经上步分离得到的EAP-1多糖用蒸馏水溶解,上样(浓度为5mg/mL,上样量25mg),用蒸馏水洗脱,4.0mL/管分部收集,洗脱速度为0.8mL/min,最终依次逐管检测。然后分别收集合并单一峰组分,蒸馏水透析,冷冻干燥。
1.4 糖含量的测定
采用苯酚-硫酸法[4]测定沙枣粗多糖的总糖含量。其原理为:多糖在硫酸的作用下先水解成单糖,并迅速脱水生成糖衍生物,然后与苯酚生成橙黄色化合物,再以比色法测定。
1.5 蛋白质含量的测定
采用考马斯亮蓝法测定[5]其吸光值,利用牛血清蛋白标准曲线法计算蛋白含量。
1.6 沙枣多糖纯度鉴定及相对分子质量的测定
采用高效液相色谱法(HPLC)测定。将多糖样品配成1mg/mL的多糖溶液,过0.22μm滤膜后,将滤液注入高效液相色谱仪进行检测。通过峰型分布情况来判断样品的纯度,由标准葡聚糖的分子量对数值与保留时间求得标准分子量曲线,再由标准曲线计算得多糖相对分子质量。
1.7 沙枣多糖单糖组成分析
采用糖腈衍生化方法对标准单糖及沙枣多糖进行衍生化后进行气相色谱分析。
气相色谱条件:色谱柱:毛细管柱DB-17(30m×0.32mm×0.5m);检测器:氢火焰离子化检测器(FID);载气:N2;流速:1mL/min;进样口温度:280℃;柱温:190℃;检测器温度:280℃。
1.8 紫外光谱分析
取多糖样品少许溶解在少量的蒸馏水中,分别配制成1mg/mL的多糖溶液,用紫外可见分光光度仪自动扫描,波长范围为190~400nm,测其在260nm及280nm 波长处有无蛋白及核酸的吸收峰,检测多糖是否与核酸、蛋白质等杂质已完全分离。
1.9 红外光谱分析
采用溴化钾(KBr)压片法。
精确称取样品1mg,干燥的KBr 150mg,混合,研磨均匀,用5×107~10×107Pa压力在压油机上压成透明薄片,以空白KBr片为参比,利用傅立叶变换红外光谱仪进行扫描,测定样品的红外吸收光图谱。扫描范围:400~4000cm-1,分辨率:4cm-1,扫描次数:16。
1.10 刚果红实验
分别取1mg多糖溶于2mL水中,取200μL糖溶液,加入100μL 24.4μmol/L的刚果红溶液,同时配制2mol/L的NaOH溶液,加入NaOH,使其浓度变化范围在0~0.5mol/L之间,浓度梯度为0.05mol/L,不足部分以蒸馏水补齐,使之混合后总体积为400μL,充分混合后静置30min,然后在紫外可见全波长扫描仪上测定最大吸收波长λmax,波长扫描范围为700~400nm,不加多糖样品,作为对照。
1.11 核磁共振分析
称取多糖样品30mg,溶于0.5mL重水,充分溶解后装入核磁管中,由DRX-400核磁共振仪进行检测。
1.12 原子力显微镜
将干燥的多糖样品配制成1×10-3mg/mL的溶液,滴于干燥、清洁的适度大小的云母片上,在室温下自然晾干或置于干燥器内1.5h以上,然后即可在原子力显微镜下观察。若出现粘针现象,则需要稀释样品溶液,重新扫描。
2 结果与分析
2.1 沙枣多糖的提取
经脱脂等预处理的沙枣粉经热水浸提、浓缩、醇沉、离心得沙枣粗多糖,其得率为5.9%。
2.2 沙枣多糖的纯化
2.2.1 DEAE-52离子交换柱分级纯化结果 从粗多糖EAP经DEAE-52纤维素柱分离可得到三个组分,如图1所示,依次命名为EAP-1、EAP-2和EAP-3。其中EAP-1为以蒸馏水作为流动相的洗脱产物,说明EAP-1不带电荷;而EAP-2、EAP-3分别为以0.05、0.1mol/L NaCl为流动相的洗脱产物,说明两者带有负电荷。三种物质带电量差异明显,可以明显区分。蛋白质跟踪检测结果表明,EAP-1、EAP-2、EAP-3组分不含蛋白质,或者含量极少无法检出。
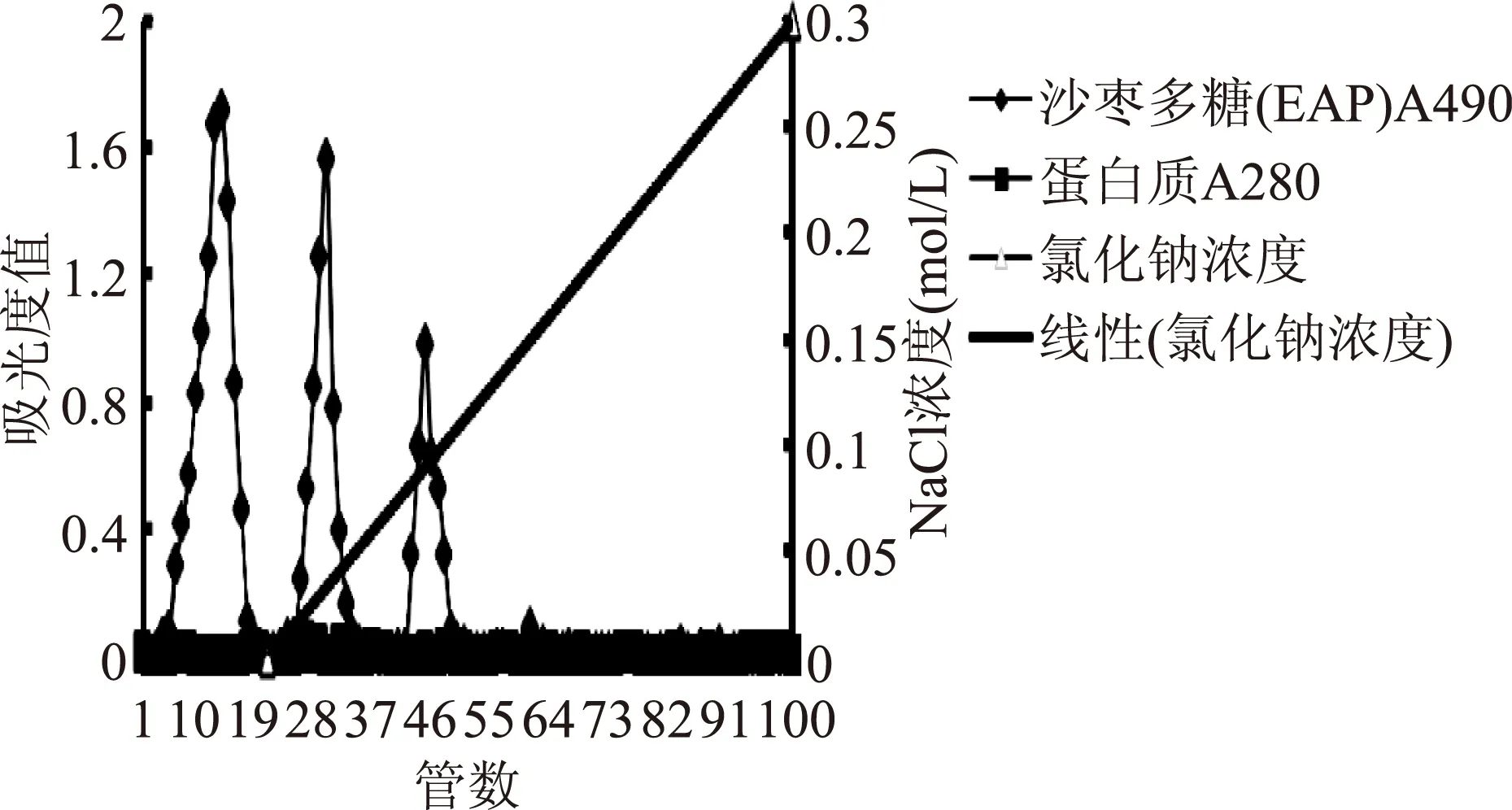
图1 EAP 的DEAE-52离子交换柱洗脱曲线Fig.1 The elution curve of EAP on DEAE-52
2.2.2 Sephadex G-100凝胶柱层析纯化结果 经过离子交换柱色谱分离得到的组分具有相近的电荷性质,而凝胶柱层析能够依据多糖组分相对分子质量的不同将相近理化性质(如溶解度、带电性质)的组分很容易分离开来,这种方法已经被广泛的应用在许多生物活性物质的分离纯化的过程中。因此,利用Sephadex G-100凝胶柱对经离子柱纯化后收集的糖含量较高的EAP-1进行进一步的分离纯化。由图2可以看出,经凝胶柱分离,EAP-1含有三个峰,收集组分的大峰,冷冻干燥,得率为1.03%,命名为EAP-1a。

图2 Sephadex G-100葡聚糖凝胶纯化洗脱曲线Fig.2 Elution profiles of EAP-1 on Sephadex G-100
2.3 糖含量及蛋白质的测定
EAP-1a的糖含量和蛋白质含量分别采用苯酚-硫酸法和考马斯亮蓝法测定。由图3葡聚糖标准曲线所得标准方程为Y=6.1319x-0.0003(R2=0.9993),由图4蛋白质标准曲线所得标准方程为Y=0.0078x+0.0765(R2=0.9998),经计算得到多糖的糖含量和蛋白质含量分别为79.25%和0.54%。
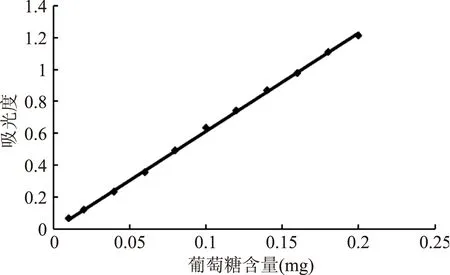
图3 多糖含量标准曲线Fig.3 The standard curve of total sugar
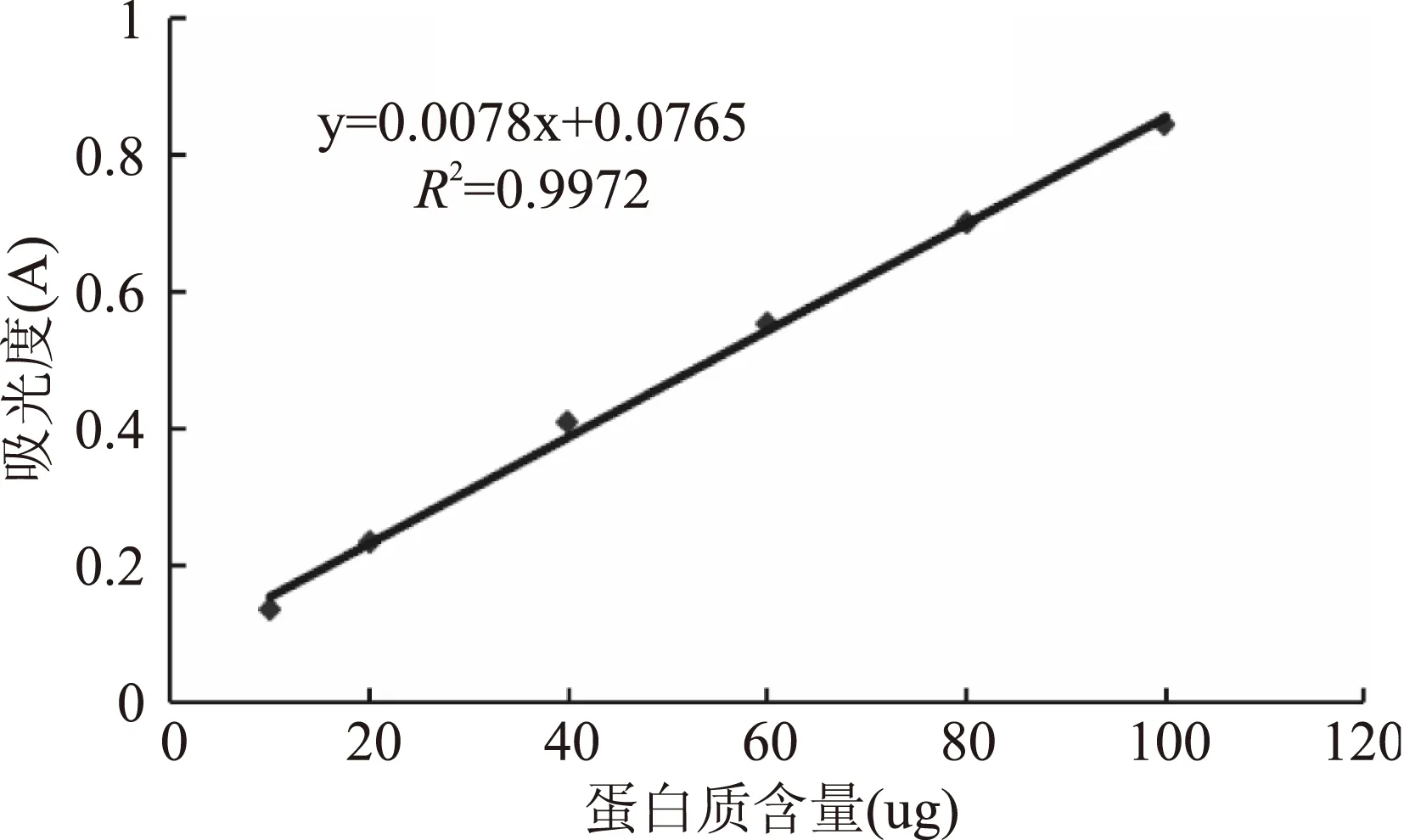
图4 蛋白质标准曲线Fig.4 The standard curve of protein
2.4 多糖纯度的鉴定及分子量的测定
由图5可知,经过DEAE-52和Sephadex G-100葡聚糖凝胶纯化后,主信号变成较为对称的峰,多糖含量为98.1%,中小分子多糖几乎被洗掉,说明EAP-1a为分子量较为均一的多糖。根据高效液相色谱图中各信号的出峰时间和多糖分子量标准曲线,计算得出多糖组分所对应的分子量的大致范围。各组分出峰时间分别为5.941、10.008、12.692min,计算得主信号峰的数均分子量为61421u。
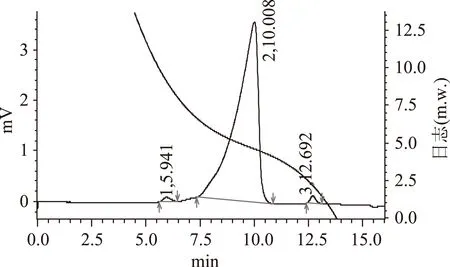
图5 EAP-1a的液相图谱Fig.5 HPLC of EAP-1a
表1 EAP-1a的分子量分布表
Table 1 The molecular weight distribution of EAP-1a

保留时间(min)数均分子量(Mn,u)重均分子量(Mw,u)Mw/Mn峰面积比(%)5.94173487296214170315631.928270.846210.008614211379272.2455898.121412.6921221461.197091.0324
2.5 单糖组成分析
本实验采用三氟乙酸酯衍生化法进行GC测定,各种标准单糖的出峰顺序依次为鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖,以及内标肌醇。标准单糖组成的气相色谱检测结果见图6及表2。经过葡聚糖凝胶柱纯化的沙枣多糖主要由阿拉伯糖、木糖、葡萄糖及半乳糖组成,还含有少量的鼠李糖和甘露糖,其摩尔比为0.029∶0.74∶0.51∶0.039∶1.0∶5.19。EAP-1a单糖组成的气相色谱检测结果见图7及表3。
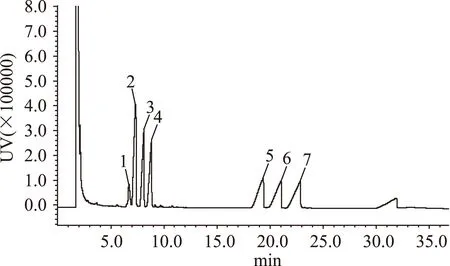
图6 标准单糖气相色谱图Fig.6 GC chromatogram of complex monosaccharide derivative注:1.核糖;2.鼠李糖;3.阿拉伯糖;4.木糖;5.甘露糖;6.葡萄糖;7.半乳糖,图7同。
表2 标准单糖气相色谱检测结果
Table 2 GC chromatogram results of standard monosaccharide

单糖组成出峰时间(min)摩尔比核糖+鼠李糖6.7140.28阿拉伯糖7.3141.76木糖8.1171.07甘露糖18.0141.64×10-3葡萄糖19.3221.0半乳糖21.0370.93
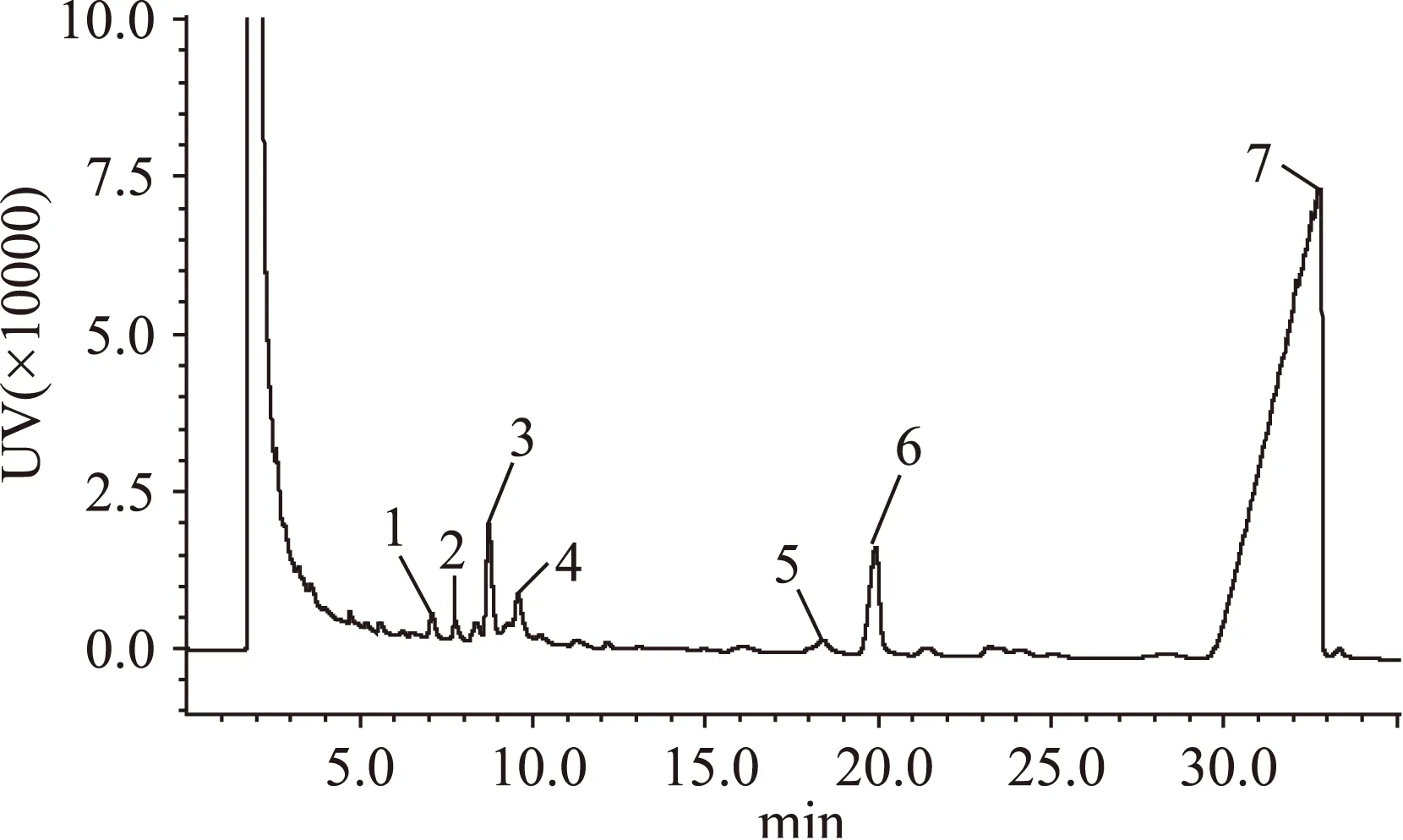
图7 EAP-1a气相色谱图Fig.7 GC chromatogram of EAP-1
表3 EAP-1a气相色谱检测结果
Table 3 GC chromatogram results of EAP-1a

单糖组成出峰时间(min)摩尔比核糖+鼠李糖6.7440.029阿拉伯糖7.0840.74木糖7.7420.51甘露糖17.4210.039葡萄糖18.3781.0半乳糖19.9265.19
2.6 紫外光谱分析
由图8可知,EAP-1a在260nm和280nm处无吸收峰,说明不含有核酸和蛋白质,或者含量极少无法检出。而在190~200nm(多糖特征吸收峰)处都有单一的吸收峰。说明EAP-1a具有多糖特征。
2.7 沙枣多糖红外光谱分析
图9展示了EAP-1a的红外光谱图,3369cm-1为-OH吸收峰,2944~2924cm-1为不对称C-H伸缩振动,相对较弱,1402cm-1处为C-H变角振动,此三处一般为糖类物质的特征吸收峰;此外,1622~1592cm-1处为C=O非对称伸缩振动峰;1257cm-1处为-COOH中O-H变角振动峰,说明可能含有-COOH基团;1079cm-1处为O-H变角振动峰;913~881cm-1处为末段脱氧糖-CH2振动峰;896cm-1处为β-型的C-H键的吸收峰;839cm-1处是α-型吡喃糖C-H键变角振动的特征吸收峰,表明有α-型糖苷键。
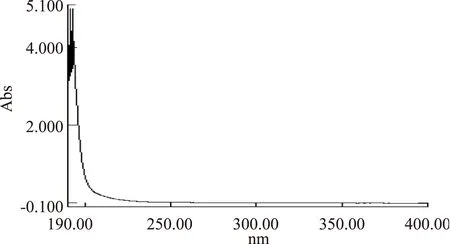
图8 EAP-1a紫外光谱分析Fig.8 UV spectrum of EAP-1a

图9 EAP-1a红外光谱分析Fig.9 IR spectra of EAP-1a
2.8 刚果红实验
由图10可知,在Na0H浓度较低时,沙枣多糖与刚果红形成复合物的最大吸收波长会随着NaOH浓度的升高而向长波长方向增加,当NaOH浓度超过0.4mol/L时,溶液的最大吸收波长值基本保持不变。可以推测出,在碱浓度较低时,最大吸收波长发生红移,刚果红复合物发生了单股螺旋结构的转变,进而可以推断EAP-1a可能以三股螺旋结构存在于水溶液中。

图10 多糖刚果红复合物的最大吸收波长变化Fig.10 Maximum absorption wavelength of Congo-red compound
2.9 核磁共振分析
2.9.11HNMR分析1HNMR通过测定糖环上1位质子的化学位移和偶合常数来进一步确定多糖结构中糖苷键的构型。糖环碳上大部分质子的化学位移由于受羟基的屏蔽作用而位于3~4ppm范围内,且信号重叠严重,导致解析困难。但异头氢质子的化学位移处于较低场,大多数堆集在4.5~5.5ppm的狭小范围内,一般情况下,此区域内有几个质子信号,表示有几种单糖种类。在1H-NMR光谱中,α-型吡喃糖的H-1质子化学位移大于4.95ppm,而β-型吡喃糖的H-1质子化学位移则小于4.95ppm,以此可判断多糖的糖苷键构型[6]。
图11展示了EAP-1a的1HNMR光谱图,从图中可以看出,EAP-1a的H-1质子的δ值在大于δ5.0有位移,说明EAP-1具有α-糖苷键构型。在4.6ppm附近有小峰,说明EAP-1a也存在β-糖苷键;δ<3.5ppm有系列小峰,说明该糖中可能有烷基或蛋白质中支链氨基酸残基的存在。
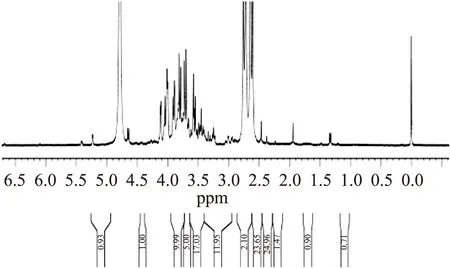
图11 EAP-1a的1HNMR图谱Fig.11 1HNMR spectra of EAP-1a
2.9.213C-NMR分析13C-NMR的化学位移范围比1H-NMR的要广,可达300ppm,分辨率也较好,而且许多文献中有单糖、寡糖和多糖的碳谱数据[7],可用于确定各种碳的化学位移。同1H-NMR一样,糖的异头碳处于较低场,在δ95~110ppm,且此范围内有几个信号,则表示多糖含有几种单糖组分。另外,同一种单糖在多糖中的位置不同,可能会导致异头碳具有不同的化学位移,而且一般比较接近,几乎重叠[8]。在13C-NMR光谱中,对于吡喃糖来说,若化学位移值小于103ppm,则为α型,而大于103ppm则为β型[9];对于呋喃糖来说,异头碳信号比吡喃型多糖来说低,一般顺式-1,2构型在103.5ppm,而反式-1,2构型在109ppm[10]。
图12展示了EAP-1a的13C-NMR图谱。在异头碳区域发现的信号,化学位移均小于103ppm,由此可以确定该多糖中的糖残基呈α异头构型。在δ95~110ppm范围内有四个主要的信号峰,表明主要含有四种单糖组分。糖苷键主要以α-糖苷键为主,β-糖苷键少量存在,与1H-NMR谱得出的结论一致。

图12 EAP-1a的13C-NMR图谱Fig.12 13C-NMR spectra of EAP-1a
由EAP-1a的1H-NMR和13C-NMR光谱图可得出结论:沙枣多糖为α-吡喃型构型,进一步验证了红外光谱和单糖组成的分析结论。
2.10 原子力显微镜分析
图13为原子力显微镜对浓度为1μg/mL的EAP-1a多糖溶液进行表征的结果。图13a和图13b可知,EAP-1a在云母片表面形成了棒状的聚集体,而且大小较为均一,但有少许大聚集体的出现,这是由于云母片表面带电荷,与多糖形成的分子间的排斥作用难以聚集成大的聚合体[11]。由图13(c)可知,多糖高度为7.14~9.57nm,长度为2.49μm,一个多糖的高度为0.3nm,因此EAP-1a的高度是单链分子的数倍,推测可能是由于多条分子链缠绕所致,分子大小远大于单链分子的估算值,这可能是由于扫描过程中的增宽效应引起的。

图13 EAP-1a的原子力显微镜扫描图Fig.13 Pictures of EAP-1 aon AFM注:a:平面图;b:3D图;c:线形图。
3 结论
本文主要采用了化学和仪器的方法对纯化后的沙枣多糖结构进行了初步研究。结果表明,EAP-1a主要由阿拉伯糖、木糖、葡萄糖及半乳糖组成,还含有少量的鼠李糖和甘露糖组成,α-吡喃糖苷键为主,β-吡喃糖苷键少量存在。首次应用核磁共振技术考察沙枣多糖的结构,信息量较少,1H-NMR和13C-NMR光谱图进一步验证了红外光谱和气象色谱的分析结论。空间结构上EAP-1a在水溶液中可能具有三股螺旋结构。显微形貌观察到EAP-1a呈长链状形态,可缠绕形成棒状纳米聚集体。目前对沙枣多糖一级结构、高级结构和生物活性的研究报道甚少,这将对进一步研究沙枣多糖的结构、性质以及生物活性与构效关系奠定了基础。
[1]石磊岭,魏鸿雁,夏提古丽. 阿不利孜,等. 沙枣成分及药理作用研究进展[J].中国医药指南,2011,9(31):36-38.
[2]江发寿,刘金荣,但建明,等.沙枣多糖的超声提取和含量测定[J]. 西北药学杂志,2002,17(1):13-14.
[3]侯小涛,赵超超,邓家刚.甘蔗叶多糖除蛋白工艺研究[J].食品工业科技,2012,33(20):240-244.
[4]Dubois M,Gillis KA,Hamilton JK,et al. Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28:350-356.
[5]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein binding[J].Anal Biochem,1976,72:248-254.
[6]Arifkhodzhaev AO.Galactans and galactan-containing polysaccharides of higher plants[J].Chem Nat Compd,2000,36(3):229-224.
[7]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999.
[8]Kitamura S,Hori T,Kurita K,et al.An antitumor,branched(1→3)-β-D-glucan from a water extract of fruiting bodies of Cryptoporusvolvatus[J].Carbohydr Res,1994,263(1):111-121.
[9]Ashraf GM,Banu N,Ahmad A,et al.Purification,characterization,sequencing and biological chemistry of galectin purified from Capra hircus(goat)Heart[J].Protein Journal,2011,30:39-51.
[10]Gorin PAJ. Carbon-13 Nuclear magnetic resonance spectroscopy of polysaccharides[J]. Advances in Carbohydrate Chemistry and Biochemistry,1981,38:171.
[11]李岱,张静,孙润广.超声波处理对柴胡多糖提取率、微观形貌特征及生物活性的影响[J].生物加工过程,2009(2):29-34.
Purification and preliminary analysis ofElaeagnusangustifoliaL. polysaccharide-1a
LIU Xiao-qing,LIU Hui-ping*,ZHAO Fan,ZHANG Chen-ping,WANG Yu,XU Jiao-jiao
(College of Food Engineering and Biotechnology,Tinajing Univisity of Science and Technology,Tianjing 300457,China)
Polysaccharide ofElaeagnusangustifoliaL.(EAP)was extracted by hot water. And EAP-1a was made by investiguted deproteinization with sevage method,ethanol precipitation,centrifugation,diasylis,DEAE-cellouse 52 and Sephadex G-100,concentration and lyophilization. Meanwhile,the composition,content and structure of EAP-1a was investigated through phenol-sulfuric acid method,UV,IR,gas chromatography(GC),Congo-red test,NMR and AFM. The results showed that,EAP-1a was mainly composed of rhamnose,arabinose,xylose,mannose,glucose and galactose with a molar ratio of 0.029∶0.74∶0.51∶0.039∶1.0∶5.19. The molecular weight of EAP-1a was 61421u;IR spectra and NMR showed EAP-1a had α-glucose which was structural characteristic of the polysaccharide. AFM showed EAP-1a had long chain,which could be winded rod-shaped nano aggregation and no triple helix conformation.
ElaeagnusangustifoliaL;polysaccharide;purification;stucture
2014-09-16
刘晓庆(1990-),女,硕士,研究方向:粮食油脂及植物蛋白工程。
*通讯作者:刘会平(1965-),男,博士,教授,研究方向:乳品科学、功能性蛋白肽及植物多糖。
TS255.1
A
1002-0306(2015)13-0138-06
10.13386/j.issn1002-0306.2015.13.020

