黑小麦麸皮色素结构分离及鉴定
杨兆艳,孙元琳,田艳花
(1.山西药科职业学院食品工程系,山西太原 030031;2.运城学院生命科学系,山西运城 044000)
黑小麦麸皮色素结构分离及鉴定
杨兆艳1,孙元琳2,田艳花1
(1.山西药科职业学院食品工程系,山西太原 030031;2.运城学院生命科学系,山西运城 044000)
本文以黑小麦麸皮为原料,通过大孔吸附树脂纯化浸提液,采用光谱分析对该色素进行初步鉴定,层析分离色素,HPLC鉴定。结果表明:黑小麦麸皮色素为水溶性花色苷类色素,至少含有三种花色苷。本研究结果可以为黑小麦麸皮色素的结构分离及深入分析奠定基础。
黑小麦麸皮,色素 ,结构,分离,鉴定
作为食品添加剂,天然色素与合成色素相比较,除可以着色外,还具有安全、营养、保健等优势,因此其取代合成色素已成必然。目前以天然色素为主导的市场,国外发展迅速。目前,我国也开发出几十种天然色素,有百余家生产企业,年产量超过万吨。但由于天然色素性质不稳定,生产技术不够先进,使用受到限制。因此生产高度纯化的天然色素,同时对其结构进行鉴定,可以为天然色素产品精制、生物活性的研究及其应用奠定基础[1]。
研究中采用黑小麦为河东乌麦(526),该原料是山西运城小麦研究开发中心近年来选育成功的黑小麦新品种[2]。目前,国内育种成功的黑小麦有十几个品种,不同品种黑小麦中色素的种类不同。当前,国内外对于黑小麦的营养成分、稳定性及抗氧化活性研究较多[3-8],对某些黑小麦品种色素的结构分离鉴定也有研究报道[9-12],但对于河东乌麦(526)色素结构的分离及分析鉴定几乎为空白。本研究课题以黑小麦麸皮为原料,将纯化后的黑小麦麸皮色素通过纸层析和薄层层析法分离,并对其结构进行初步鉴定,可以为黑小麦麸皮及其色素的深入研究及应用奠定基础。
1 材料与方法
1.1 材料与仪器
黑小麦麸皮 河东乌麦526麸皮,山西省运城市黑麦黑色食品有限公司。
无水乙醚、丙酮、乙酸、丁酸、石油醚、正丁醇、95%乙醇、甲醇、盐酸、异丁醇、乙酰丙酮等均为分析纯试剂;磷酸、乙腈等为色谱纯;HZ801大孔吸附树脂、新华3号滤纸、聚酰胺薄膜(规格是10cm×10cm),上海摩速科学器材有限公司。
1100型高效液相色谱仪 Agilent;SZ-93自动纯水蒸馏水器 上海亚荣生化仪器厂;移液枪Tripette(5~50μL) 德国普兰德;722N可见分光光度计 上海精密科学仪器有限公司;DHZ-A恒流泵与BSZ-100部分自动收集器 分析仪器厂;Z系列(Ø1.0x20)层析柱 上海泸西分析仪器厂;HHS型电热恒温水浴锅 天津市华北实验有限公司;SHZ-D(Ⅲ型)环水式多用真空泵 巩义市予华仪器有限公司。
1.2 实验方法

表1 纸层析展开剂Table 1 Paper chromatography developing solvent

表2 聚酰胺薄膜薄层层析展开剂Table 2 Polyamide film TLC developing solvent
1.2.1 黑小麦麸皮色素的提取 黑小麦麸皮→粉碎→过筛(40~60目)→超声波提取(提取剂70%乙醇,料液比1∶16,超声时间12min,超声功率500W)[13]→提取液→抽滤→真空浓缩(温度≤45℃)→色素溶液(样液1)
1.2.2 黑小麦麸皮色素的纯化 样液1→配制溶液(pH3.0,吸光度0.800,)→大孔吸附树脂纯化色素(吸附条件:吸光度0.800,pH3.0,不含盐类离子,温度50℃,吸附流速1BV/h;解吸条件:70%乙醇,pH1.0,温度30℃,解吸流速3BV/h)[13]→收集纯化液(样液2)→减压浓缩→色素溶液(样液3)
1.2.3 黑小麦麸皮色素的光谱特性 用0.01%盐酸-甲醇溶液将样液3稀释10倍,在240~550nm的波长范围内进行扫描,分析其光谱特征。
1.2.4 黑小麦麸皮色素纸层析分离实验 采用新华3号滤纸,分别采用样液1、样液2、样液3,经过筛选,按照表1中展开剂展开。
1.2.5 黑小麦麸皮色素薄层层析分离实验 采用聚酰胺薄膜,分别采用样液1、样液2、样液3,经过筛选,选择表2中展开剂进行实验。
1.2.6 层析实验 (具体见表3)。

表3 层析实验条件Table 3 Experiment conditions of TLC
注:展开均在室温条件下进行(25~30℃)。
1.2.7 高效液相色谱检测
1.2.7.1 色谱条件的选择 选择Eclipse XDB-C18色谱柱(4.6mm×50mm,5μm),采用乙腈-4%磷酸作为流动相,流速为1.0mL/min,检测波长为520nm;柱温为25℃。
1.2.7.2 样液的制备 样液用层析法分离之后,分别用1%盐酸-甲醇溶液洗脱各个色斑,洗脱液过0.45μm滤膜后吸取10μL进样。
2 结果与分析
2.1 黑小麦麸皮色素的光谱特性
由图1知,黑小麦麸皮色素在可见光区510nm处有最大吸收峰,在紫外光区310nm处也有最大吸收峰。花色苷在可见光区的最大吸收峰位于500~540nm附近,在紫外光区位于270~320nm附近[1,14],所以可判断该色素为花色苷类色素。

图1 黑小麦麸皮色素光谱特性曲线图Fig.1 Black wheat bran pigment spectral characteristic curve
2.2 层析实验
结合表3和图2可以分析出,条件16(纯化浓缩液,固定相聚酰胺薄膜,展开剂体积比为4∶1∶5的乙醇∶正丁醇∶水、展开时间1.5h)展开效果最好,可以得到清晰的两个斑点,分别为斑点1(Rf1=0.800,紫红色)和斑点2(Rf2=0.678,棕色)。且经过重复实验验证,该条件下分离结果比较稳定,重现性较好,见表4。

表4 实验结果Table 4 Test results

表5 黑小麦麸皮色素的Rf值Table 5 Rf values of the black wheat bran pigment
2.3 高效液相色谱检测
图4显示色斑1主要含有两种花色苷,在520nm处的峰面积分别为41.352%和58.648%,用聚酰胺薄膜不能将这两种花色苷有效分离,说明这两种花色苷比较接近,分别命名为ANT1和ANT2;图5显示,色斑2为单一色素,命名为ANT3;且ANT1、ANT2、ANT3色素峰的保留时间分别为1.731、2.190、10.070min。由于缺少标品,未能进一步定性及定量分析,后续研究过程中将结合标品和多种分析手段对其结构进行鉴定分析。

图2 条件16层析图像Fig.2 Tomographic image of condition 16注:样液3,固定相为聚酰胺薄膜,展开剂为EBW,展开时间1.5h。

图3 样液3液相色谱图Fig.3 Liquid chromatogram of sample solution 3
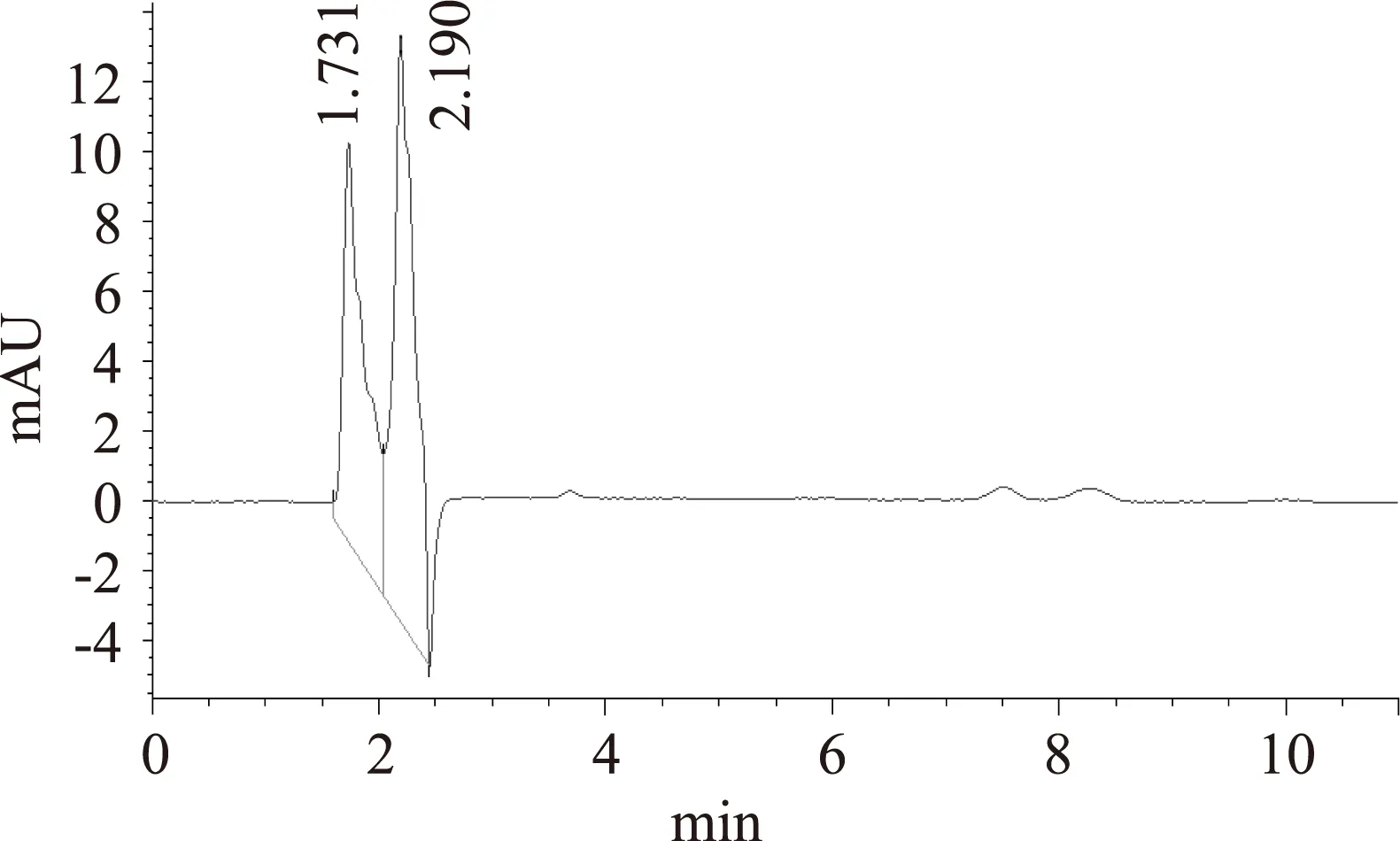
图4 色斑1(Rf1=0.800)液相色谱图Fig.4 Liquid chromatogram of spots 1(Rf1=0.800)

图5 色斑2(Rf2=0.678)液相色谱图Fig.5 Liquid chromatogram of spots 2(Rf2=0.678)
3 结论
本研究确定的层析条件为:聚酰胺为吸附剂体积比乙醇∶正丁醇∶水(4∶1∶5)为展开剂,展开时间为1.5h。该条件下得到两个清晰斑点,比移值分别为Rf1=0.800、Rf2=0.678,经HPLC色谱分析,斑点1(Rf1=0.800)含有两种性质比较接近的花色苷,命名为ANT1和ANT2,斑点2(Rf2=0.678)为单一花色苷命名为ANT3,故可推断黑小麦麸皮色素至少含有三种花色苷。
同时,本研究还分别讨论了可能影响层析分离效果的因素,影响层析分离因素主要有:吸附剂,展开剂,展开时间,点样量和样液纯度。
本文结果将对薄层层析分离色素的方法及黑小麦麸皮色素的深入研究提供参考。 后续研究中将结合花色苷标品及其它多种分析手段对分离得到的ANT1、ANT2及ANT3进行更为深入的结构分析鉴定,得到其具体详细的结构。
[1]凌文华,郭红辉.植物花色苷[M]. 北京:科学出版社,2009,9:1-114.
[2]刘惠芳,郭志远,张立功.黑麦开发谈[R],全国作物优异资源暨黑色食品研讨会论文,广州,1997.
[3]王秋叶,姚景珍,李秀绒,等.黑麦营养特性、品质性状及其在食品中的应用[J].耕作与栽培,2007,(6):35-37.
[4]周桂娟,王坤,李集临,等.黑粒小麦色素稳定性的研究[J].中国农学通报,2012,28(15):92-96.
[5]杨希娟,党斌,张国权.黑小麦色素提取工艺优化及其稳定性研究[J].食品工业科技,2011,32(07):353-358.
[6]张东阳,李集临,张杰.黑粒小麦的选育及其抗氧化特性[J].中国农学通报,2010,26(05):93-96.
[7]Li W D,Shan F,Sun S H,et al. Free radical scavenging properties and phenolic content of Chinese black-grained wheat[J]. Journal of Agriculture,2005,53(22):8533-8536.
[8]Chun H,Cai Y Z,Li W,et al. Anthocyanin characterization and bioactivity assessment of a dark blue grained wheat(Triticum aestivum L.cv.Hedong Wumai)extract[J]. Food Chemistry,2007,104(3):955-961.
[9]李伟,姜媛,唐晓珍等.采用高效液相色谱串联质谱法分析黑粒小麦麸皮中的花色苷组成[J]. 食品与发酵工业,2011,37(07):161-166.
[10]赵善仓,刘宾,赵领军,等.蓝、紫粒小麦籽粒花色苷组成分析[J].中国农业科学,2010,43(19):4072-4080.
[11]Hosseinian F S,Li W D,Beta T.Measurement of anthocyanins and other phytochemicals in purple wheat[J]. Food Chemistry,2008,109(47):916-924.
[12]Abdel-Aal E-S M,Abou-Arab A A,Gamel T H,et al. Fractionation of blue wheat anthocyanin compounds and their contribution to antioxidant properties[J]. Journal of Agriculture[J]. 2008,56(23):11171-11177.
[13]杨兆艳,孙元琳,张乃麟.黑麦麸皮色素纯化工艺及稳定性研究[J]. 中国粮油学报,2010,25(12):111-116.
[14]王金亭.天然黑小麦色素研究进展[J].粮食与油脂,2013,26(3):45-48.
Separation and identification of pigment extractionfrom black wheat bran
YANG Zhao-yan1,SUN Yuan-lin2,TIAN Yan-hua1
(1.Department of Food Engineering,Shanxi Pharmaceutical College,Taiyuan 030031,China;2.Department of Life Sciences,Yuncheng College,Yuncheng 044000,China)
With Hedong black wheat bran as raw material,the pigment was extracted and then purified by macroporous resin. Spectrum,TLC and HPLC were used to separate and identify the pigment. The results showed that the pigment was water-soluble anthocyanin pigment,and at least involved three anthocyanin. The results could provide some reference for the structure separation and further research of Hedong black bran pigment.
black wheat bran;pigment;structure;separation;identification
2014-09-03
杨兆艳(1981-),女,硕士,讲师,研究方向:食品科学。
山西省自然科学基金(2012011031)。
TS251.1
A
1002-0306(2015)13-0150-04
10.13386/j.issn1002-0306.2015.13.022

