长根菇多糖对小鼠肠道菌群及分泌型IgA的影响
王 雪,张圣方,赵龙玉,赵凤春,杨正友
(山东农业大学生命科学学院微生物系,农业微生物重点实验室,山东泰安 271018)
长根菇多糖对小鼠肠道菌群及分泌型IgA的影响
王 雪,张圣方,赵龙玉,赵凤春,杨正友*
(山东农业大学生命科学学院微生物系,农业微生物重点实验室,山东泰安 271018)
为了研究长根菇多糖对小鼠的肠道菌群及肠黏膜分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)的影响,选取18~22g健康清洁级雄性昆明小鼠进行肠道菌群和SIgA的检测。利用盐酸林可霉素灌胃建立肠道微生态失调小鼠模型。60只小鼠随机分为五组,正常对照组、自然恢复组、低剂量多糖组(75mg/kg·bw)、中剂量多糖组(150mg/kg·bw)和高剂量多糖组(300mg/kg·bw)。灌胃14d后分别进行肠道双歧杆菌、乳酸杆菌、大肠杆菌、肠球菌检测和肠黏膜SIgA测定。结果显示,与空白对照组比较,其余各组均有双歧杆菌、乳酸杆菌、SIgA减少以及大肠杆菌、肠球菌增多的现象;与自然恢复组比较,多糖组上述指标得到明显改善,差异显著(p<0.05)。结果表明,长根菇多糖对肠道菌群失调小鼠的肠道菌群具有调整作用并能提高肠黏膜SIgA含量。
长根菇,多糖,小鼠,肠道菌群,分泌型免疫球蛋白A
在人和动物体内,肠道正常微生物平衡、肠黏膜上皮屏障以及肠道免疫系统为正常肠道屏障功能提供了保障[1]。数量庞大的肠道菌群对宿主具有营养、免疫和生物拮抗等作用[2]。肠道菌群失调可导致人体的多种疾病,保持肠道微生态平衡对于维持人体健康是必要的[3]。分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)是肠黏膜表面主要的免疫球蛋白,在肠道黏膜防御中起着重要作用。以SIgA为主的体液免疫是防御病原菌在肠道黏膜黏附和定植的第一道防线[4]。近年来,抗生素滥用带来的危害已经引起人们的重视,抗生素能破坏正常微生物的组成,导致肠道菌群失调,致使耐药性细菌产生和传播[5]。随着研究的深入,发现多糖具有改善动物体内肠道微生态的作用[6-7],起到益生元的效果,是理想的微生态调节剂。
长根菇(Collybiaradiata),又名长根小奥德蘑,隶属于真菌界,担子菌门,伞菌纲,伞菌目,膨湖菌科,小奥德蘑属[8]。其子实体肉质鲜嫩,味美可口。长根菇的子实体、菌丝体及菌丝体发酵液中含有多种药用成分,有益于人体健康,如长根菇多糖具有抗病毒、抗肿瘤[9]及防止动脉硬化[10]的作用,长根菇素有降压[11]等功效。长根菇作为一种食药两用名贵真菌,具有巨大的开发潜力。
目前对长根菇的研究主要集中在菌种的驯化、栽培和菌丝体的培养方面。长根菇多糖在具体功能方面研究甚少。盐酸林可霉素(Lincomycin Hydrochloride,LIH),是临床常用抗菌药物,对大多数革兰氏阳性菌有较强的抑制作用[12]。本研究拟通过盐酸林可霉素诱导的肠道菌群失调小鼠模型,观察长根菇菌多糖对小鼠肠道菌群和SIgA的影响。
1 材料与方法
1.1 材料与仪器
长根菇菌 购自四川省绵阳市食用真菌研究所。
BBL琼脂培养基、伊红美蓝琼脂(Eosin Methylene Blue,EMB)、Pfizer肠球菌选择性琼脂和MRS琼脂培养基 青岛高科园海博生物技术有限公司;盐酸林可霉素注射液(300mg/mL) 河南福森药业有限公司;分泌型免疫球蛋白A试剂盒 北京方程生物科技有限公司;ICR清洁级昆明小鼠,雄性,体重(20±2)g,小鼠的饲养环境保持室温(25±1)℃,相对湿度(55±10)%,灯光控制12h昼夜交替,由泰山医学院动物实验中心提供。
LDZX-50KB立式压力蒸汽灭菌器 上海申安医疗器械厂;C-32厌氧培养盒 日本三菱瓦斯化学株式会社;SW-CJ-1F超净工作台 苏净集团苏州安泰空气技术有限公司;DHP-9162电热恒温培养箱 上海一恒科学仪器有限公司;BIO-RAD680伯乐酶标仪 美国Bio-rad公司。
1.2 实验方法
1.2.1 制备长根菇胞外多糖 菌种活化后接种于液体培养基,摇瓶培养7d后离心去除菌丝体、收集发酵液。将获得的发酵液采用乙醇沉淀法提取粗多糖。粗多糖依次经过sevage法脱蛋白、活性炭除色素、透析除小分子杂质,最终得到长根菇胞外精多糖。用苯酚-硫酸法[13]对长根菇多糖进行定量测定。
1.2.2 实验动物分组、造模和给药 60只清洁级雄性昆明小鼠,体质量(20±2)g。随机取出12只作为正常对照组,剩余48只用盐酸林可霉素(300mg/mL)灌胃,每次0.3mL,2次/d,连续三天。以模型组小鼠出现溏便、背毛失去光泽、行动迟缓为造模成功的标准。正常对照组灌胃等体积生理盐水。造模成功后,随机将模型组小鼠均分为4组:自然恢复组和三个不同剂量的长根菇多糖组。饲养期间,供给充足的饲料和饮水供其自由摄取。按照表1的方案,每天使用生理盐水或不同浓度多糖溶液对小鼠进行定时灌胃,连续灌胃14d。

表1 实验小鼠分组和给药方案Table 1 Animal grouping and polysaccharides administration dosage
1.2.3 样品采集和处理
1.2.3.1 样品采集、均质化及稀释 最后一次灌胃24h后处死小鼠,将小鼠固定于解剖板,常规消毒,正中剖开腹腔,无菌收集回盲部末端10cm以内的盲肠内容物,置于干燥灭菌试管中。无菌取1g样品,加9mL灭菌生理盐水,震荡至盲肠内容物均质化。静置,沉淀粪便杂质。取此上清作为第一稀释度,用灭菌生理盐水进行10倍梯度稀释。制成一系列不同稀释度的菌液,至1×10-8。
1.2.3.2 肠黏液采集与处理 无菌取近回盲部小肠10cm,平铺并纵向剖开,轻刮,去除肠道内粪便,用载玻片轻刮肠黏膜表面,并用3mL 0.01mol/L无菌磷酸盐缓冲液(PBS)[pH=(7.5±0.1)]反复冲洗肠腔,收集洗脱液于5mL无菌离心管内,充分震荡混匀,4000r/min,低温离心,取上清,-80℃冻存待测。
1.2.3.3 细菌接种 根据预实验选择标本稀释度:大肠杆菌为10-5、10-6、10-7,肠球菌为10-4、10-5、10-6,乳酸杆菌为10-6、10-7、10-8,双歧杆菌为10-7、10-8、10-9。取不同稀释度的样品100μL接种于各选择性培养基上,用涂布棒进行涂布,每个稀释度做三个平行板。
1.2.3.4 培养与计数 接种后对肠道主要菌群进行培养,培养条件参照表2,用常规平板活菌计数法计数[14]。

表2 肠道主要菌群的培养条件Table 2 Culture conditions of intestinal flora
培养结束后,分别选择适当的稀释度,依据菌落形态、革兰氏染色镜检及生化反应等鉴定所需要的目的菌[15],统计并分析。
依据公式计算四种细菌不同稀释度的CFU/g标本,结果均以对数形式表示。
1.2.4 小鼠肠道内SIgA含量的测定 采用酶联免疫检测(enzyme linked immunosorbent assay,ELISA)法中的双抗体夹心法测定标本中小鼠分泌型免疫球蛋白A(SIgA)水平,按SIgA试剂盒说明书进行检测。
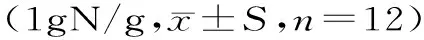
表3 各组小鼠肠道菌群定量检测结果比较
注:与空白对照组比较,*p<0.05,**p<0.01;与自然恢复组比较,#p<0.05,##p<0.01。
1.3 统计学方法
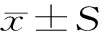
2 结果与分析
2.1 长根菇多糖对小鼠体重的影响
由图1可见,小鼠的初始体重在各组之间比较,差异无显著性(p>0.05)。实验后多糖组小鼠与空白对照组小鼠体重无显著性差异(p>0.05),自然恢复组与空白对照组小鼠体重差异显著(p<0.05)。说明盐酸林可霉素造成的肠道紊乱影响了模型组小鼠胃肠道的消化吸收功能,而灌胃长根菇多糖后,胃肠道的消化吸收功能恢复。
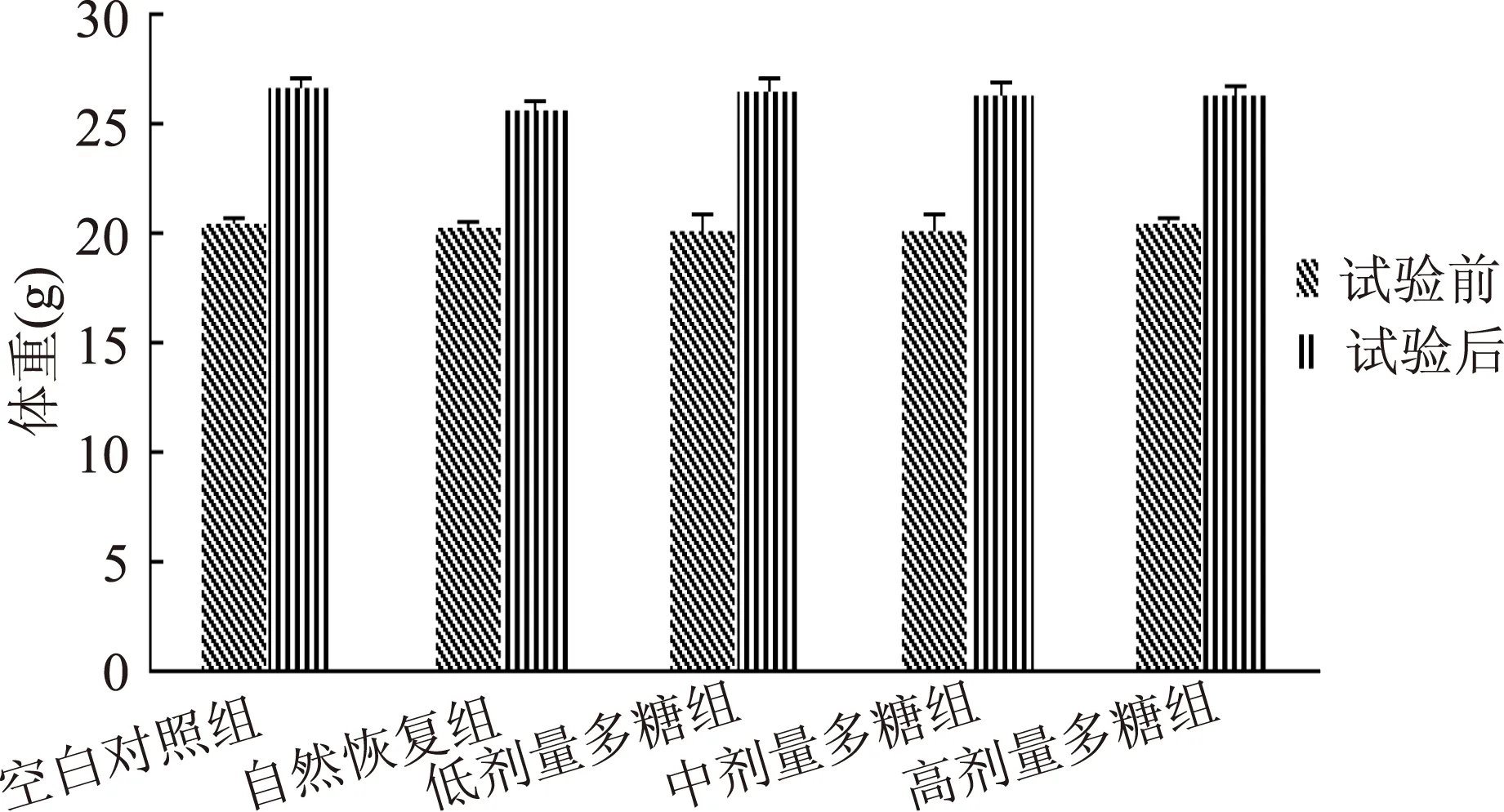
图1 实验前后各组小鼠的体重Fig.1 The body weight of mice in each group before and after experiment
2.2 小鼠肠道菌落形态观察及镜检
实验中对小鼠肠道四种主要细菌在其特异性选择培养基上的菌落性状、形态以及革兰氏染色等指标进行了观察。其中乳酸杆菌菌落呈圆形,中等大小,直径为(3±1)mm,凸起,乳白色,表面光滑,边缘整齐,革兰阳性杆菌;双歧杆菌菌落为光滑,凸圆,乳脂色,边缘整齐,菌落小于乳酸杆菌菌落,革兰阳性杆菌;大肠杆菌菌落呈暗红色,带有金属光泽,革兰阴性杆菌。肠球菌菌落呈灰白色,微凸,边缘整齐,在菌落周围的培养基颜色加深,革兰阳性球菌。
2.3 长根菇多糖对小鼠肠道菌群的影响
小鼠造模后,绝大多数小鼠行动迟缓,毛色干枯,饮食下降,出现溏样便。灌胃多糖后,从表3可知,乳酸杆菌:与空白对照组比较,自然恢复组、低剂量多糖组和高剂量多糖组乳酸杆菌菌量均极显著减少(p<0.01),且自然恢复组乳酸杆菌菌量最低,中剂量多糖组乳酸杆菌菌量差异不显著(p>0.05);与自然恢复组比较,三个不同剂量的多糖组乳酸菌群数量均极显著增加(p<0.01),其中中剂量多糖组菌量最高。双歧杆菌:与空白对照组比较,自然恢复组和三个不同剂量的多糖组双歧杆菌菌量均极显著减少(p<0.01),其中自然恢复组双歧杆菌菌量最低;与自然恢复组比较,三个不同剂量的多糖组双歧杆菌菌量均极显著增加(p<0.01),且中剂量多糖组菌量最高。大肠杆菌:与空白对照组比较,自然恢复组大肠杆菌菌量极显著增加(p<0.01),三个不同剂量的多糖组大肠杆菌菌量差异明显(p<0.01或p<0.05),其中自然恢复组菌量最高;与自然恢复组比较,多糖组大肠杆菌菌量均极显著减少(p<0.01),且中剂量多糖组菌量最低。肠球菌:与空白对照组比较,自然恢复组、低剂量多糖组和中剂量多糖组肠球菌菌量极显著增加(p<0.01),其中自然恢复组肠球菌菌量最高,多糖高剂量组差异不明显(p>0.05);与自然恢复组比较,多糖组肠球菌菌量均极显著减少(p<0.01),且随多糖剂量的增加而升高。说明盐酸林可霉素对肠道菌群造成了干扰和破坏,自然恢复组在14d中没有完全恢复到正常肠道状态,多糖组肠道菌群比自然恢复组菌群恢复效果明显。
2.4 长根菇多糖对SIgA的影响
2.4.1 SIgA标准曲线及回归方程 取标准品0.5、1.0、2、4、8μmol/L,以标准品的浓度值为横坐标,OD值为纵坐标,绘出标准曲线并得到直线回归方程式为y=0.0798x-0.0099,相关系数的平方为R2=0.9899。
2.4.2 长根菇菌多糖对小鼠肠黏膜SIgA的影响 通过表4可以看出,与空白对照组比较,自然恢复组和低、高剂量多糖组小鼠肠黏膜SIgA浓度极显著降低(p<0.01),而中剂量多糖组小鼠肠黏膜SIgA浓度极显著增加(p<0.01),可见肠黏膜SIgA浓度并不是随着多糖浓度的升高而增加,中剂量多糖使肠黏膜SIgA浓度恢复并高于空白对照组。与自然恢复组相比,低、中、高剂量长根菇多糖组小鼠肠黏膜SIgA含量均极显著提高(p<0.01)。
3 讨论
在健康动物的体表和体内栖居着大量微生物,这就是正常微生物菌群[16],正常微生物菌群与宿主机体之间处于一种动态平衡状态,与此同时,不同菌群之间也保持着一定的比例关系,菌群的平衡与稳定对机体的各项生理功能具有重要的影响[17]。有研究显示,多糖能够有效促进肠道益生菌的增殖[18]而益生菌的增多可促使肠道有益菌优先利用肠上皮细胞的营养物质进行繁殖[19],并优先占据肠粘膜表面的黏附位点[20],阻止有害菌侵占。有益菌增多能够防止正常黏膜细胞和杯状细胞萎缩,保护肠黏膜屏障,保证肠黏膜SIgA的正常分泌[21]。


组别SIgA(浓度,μg/mL)空白对照组1.578±0.025##自然恢复组1.177±0.013**低剂量多糖组1.252±0.025**##中剂量多糖组1.653±0.025**##高剂量多糖组1.402±0.000**##
注:与空白对照组比较,*p<0.05,**p<0.01;与自然恢复组比较,#p<0.05,##p<0.01。
实验结果显示,与空白对照组比较,模型组小鼠肠道中的双歧杆菌和乳酸杆菌数量明显下降,大肠杆菌和肠球菌数量则明显增加,差异显著,表明肠道菌群紊乱,益生菌定植能力下降,降低了肠黏膜屏障功能,使用盐酸林可霉素灌胃成功建立了微生态失调小鼠模型。与自然恢复组相比,多糖组小鼠肠道中双歧杆菌和乳酸杆菌的数量回升,大肠杆菌和肠球菌的数量则低于自然恢复组,其中中剂量多糖组双歧杆菌和乳酸杆菌菌量均高于低、高剂量多糖组,而大肠杆菌菌量则低于其余两组,肠球菌菌量在高剂量多糖组中最低。说明长根菇多糖在一定程度上能够调节盐酸林可霉素导致的肠道紊乱,对肠道菌群有恢复作用,其中中剂量的多糖对肠道益生菌的改善效果最好,对条件性致病菌也有一定的拮抗作用。
SIgA是肠黏膜固有层浆细胞分泌的免疫球蛋白,是肠道黏膜免疫的主要效应因子,能够中和肠黏膜上皮内的病原体[22],在机体黏膜局部抗感染中发挥重要作用,具有免疫排除功能。本实验探究发现,抗生素能够抑制肠道内SIgA的分泌,通过灌胃长根菇多糖溶液,多糖组小鼠肠道SIgA含量较自然恢复组显著提高,说明长根菇多糖能够促进小鼠肠黏膜SIgA的分泌量增加,在一定程度上拮抗盐酸林可霉素造成的SIgA分泌抑制。
肠道菌群与SIgA在肠道中并不是孤立存在的,而是在菌群生长、SIgA形成过程中相互影响,在功能上相辅相成。双歧杆菌增殖能够促进肠道蠕动、净化肠道,同时提高SIgA含量,增强宿主免疫力。乳酸杆菌则能清除体内有毒物质,抵御外来致病菌。SIgA通过免疫作用能够维持肠道内的正常菌群平衡,而肠道粘膜分泌SIgA受肠道微生物的影响。多糖组小鼠肠道益生菌群及SIgA水平较自然恢复组明显提高,中剂量的多糖对肠道益生菌的恢复效果最显著,对条件性致病菌的拮抗效果也较好,肠道菌群的恢复促进了肠黏膜SIgA分泌,中剂量多糖组SIgA浓度恢复并高于空白对照组,表明长根菇多糖在一定程度上能够拮抗盐酸林可霉素造成的肠道菌群失调和SIgA分泌抑制,具有调节和改善肠道微生态的功能,多糖剂量为150mg/kg·bw时对肠道的改善效果最明显。
[1]Hecht G. Innate mechanisms of epithelial host defense:spotlight on intestine[J]. American Journal of Physiology-Cell Physiology,1999,277(3):C351-C358.
[2]Macpherson A J,Harris N L. Interactions between commensal intestinal bacteria and the immune system[J]. Nature Reviews Immunology,2004,4(6):478-485.
[3]郭贵海,王崇文. 肠道菌群调节剂的研究进展[J]. 临床内科杂志,2002,19(2):88-90.
[4]武金宝,王继德,张亚历.肠黏膜屏障研究进展[J].世界华人消化杂志,2003,11(5):619-623.
[5]罗兰,陈光,遇常红,等.香菇多糖对微生态失调小鼠肠道菌群及免疫功能的调节作用[J].中国微生态学杂志,2013,25(1):36-38.
[6]李琨,刘安军,王稳航,等.决明子活性成分对小鼠肠道菌相的影响[J].天津科技大学学报,2005,20(2):19-21.
[7]王庭欣,夏立娅,刘峥颢,等.海带多糖对小鼠肠黏膜SIgA肠道菌群的影响[J].食品科技,2009,34(5):249-251.
[8]Yang ZL,Zhang LF,Mueller GM,et al. A new systematic arrangement of the genus Oudemansiella s. str.(Physalacriaceae,Agaricales)[J]. Mycosystema,2009,28(1):1-13.
[9]吴梧桐,高美风,吴文俊.多糖的抗肿瘤作用研究进展[J].中国天然药物,2003,1(3):182-186.
[10]黄伟坤. 食品检验与分析[M].北京:轻工业出版社,1989.
[11]Tsantrizos YS,Zhou F,Famili P,et al. Biosynthesis of the Hypotensive Metabolite Oudenone by Oudemansiella radicata. 1. Intact Incorporation of a Tetraketide Chain Elongation Intermediate [J]. The Journal of Organic Chemistry,1995,60(21):6922-6929.
[12]朱建平,张菁,刘云. 盐酸林可霉素有关物质测定方法的研究[J].中国药品标准,2011,12(1):54.
[13]Weijie Z. Biochemical Research Technology of Complex Carbohydrates [M]. Zhejiang:Zhejiang University Press,1994:23-30.
[14]张艳,刘均娥. 平板活菌计数法检测粪便中的肠道菌群[J].首都医科大学学报,2008,29(1):85-86.
[15]宋克玉,江振友,严群超,等.党参及茯苓对小鼠肠道菌群调节作用的实验研究[J].中国临床药理学杂志,2011,27(2):142-145.
[16]杨景云. 医用微生态学[M].北京:中国医药科技出版社,1997.
[17]Shen J,Zhang B,Wei G,et al. Molecular profiling of the Clostridium leptum subgroup in human fecal microflora by PCR-denaturing gradient gel electrophoresis and clone library analysis[J]. Applied and Environmental Microbiology,2006,72(8):5232-5238.
[18]徐永杰,张波,张神腾.牛蒡多糖的提取及对小鼠肠道菌群的调节作用[J]. 食品科学,2009,30(23):428-431.
[19]Bamman M M,Hill V J,Adams G R,et al. Gender differences in resistance-training-induced myofiber hypertrophy amo ng older adults[J]. The Journals of Gerontology Series A:Biological Sciences and Medical Sciences,2003,58(2):B108-B116.
[20]孙伟,王鹏,丁家桐,等.湖羊Myostain和Myogenin基因表达的发育性变化及与屠宰性状的关联分析[J].中国农业科学,2010,43(24):5129-5136.
[21]王广. 党参多糖对肠道菌群失调小鼠的调整作用机制的初步研究[D].佳木斯:佳木斯大学,2010.
[22]陈丹丹,顾胜华,张金娜,等.肠道菌群对免疫系统的影响及其群落分析方法[J].应用与环境生物学报,2013,19(3):542-546.
Effect ofCollybiaradiatapolysaccharides onintestinal flora and secretory immunoglobulin A in mice
WANG Xue,ZHANG Sheng-fang,ZHAO Long-yu,ZHAO Feng-chun,YANG Zheng-you*
(Department of Microbiology,College of Life Science,Key Laboratory for Agriculture Microbiology,Shandong Agricultural University,Tai’an 271018,China)
To investigate the effect ofCollybiaradiatapolysaccharide on intestinal flora and secretory immunoglobulin A(SIgA)of mouse,the detection of intestinal flora and SIgA were carried out on the mice kunming mice. Lincomycin hydrochloride intragastric administration was used to construct mouse intestinal dysbacteriosis model. Sixty mice were randomly put into one standard control group,one spontaneous recovery group and three different doses ofCollybiaradiatapolysaccharide treatment groups,fed polysaccharide at dosage of 75,150mg/kg·bw,and 300mg/kg·bw,respectively. After being treated for 14 days,the counts ofBifidobacterium,Lactobacillus,Escherichiacoli,Enterococcusand SIgA were assayed. The results showed that compared with the standard control group,intestinal microflora was disturbed and the content of intestinal mucosal SIgA was significantly decreased in the other four groups. And compared with the spontaneous recovery group,the above indexes renewed to some extent. The results indicated thatCollybiaradiatapolysaccharide has played a role in adjusting intestinal flora and improving content of SIgA.
Collybiaradiata;polysaccharide;mice;intestinal flora;secretory immunoglobulin A
2014-11-13
王雪(1989-),女,硕士研究生,研究方向:食品质量与安全。
*通讯作者:杨正友(1971-),男,博士,教授,研究方向:食品质量与安全,及食品微生物学。
国家自然科学基金(30972050,31271873);山东省自然科学基金(ZR2010CM015)。
TS201.4
A
1002-0306(2015)13-0376-05
10.13386/j.issn1002-0306.2015.13.071

