普洱熟茶中黄酮醇类物质杨梅素、槲皮素和山奈酚的分离纯化
关文玉,李燕丽,李艳芳,李加伟,史寅骅,李家华,*
(1.云南农业大学龙润普洱茶学院,云南昆明 650201;2.梁河县曩宋阿昌族乡农业综合服务中心,云南梁河 679200)
普洱熟茶中黄酮醇类物质杨梅素、槲皮素和山奈酚的分离纯化
关文玉1,李燕丽1,李艳芳1,李加伟2,史寅骅1,李家华1,*
(1.云南农业大学龙润普洱茶学院,云南昆明 650201;2.梁河县曩宋阿昌族乡农业综合服务中心,云南梁河 679200)
本文以云南普洱熟茶为实验材料,以不同浓度乙醇水溶液为洗脱液,利用MCI GEL CHP 20P(75~150 μm)树脂色谱柱和SephadexTMLH-20葡聚糖凝胶色谱柱,并结合高效液相色谱(HPLC)法,对普洱熟茶中主要黄酮醇类物质进行了分离和定性。结果表明:普洱熟茶提取液浓缩后过MCI GEL CHP 20P(75~150 μm)树脂色谱柱,经不同浓度(10%,30%,50%,70%,90%)乙醇溶液洗脱分离后,将获得的70%和90%的洗脱液过SephadexTMLH-20葡聚糖凝胶色谱柱,70%的洗脱液经90%乙醇溶液洗脱分别获得了HPLC纯度为96.0%的杨梅素和HPLC纯度为98.5%的槲皮素;90%的洗脱液经70%的乙醇溶液洗脱获得了HPLC纯度为95.6%的山奈酚。
普洱熟茶,黄酮醇类化合物,树脂柱色谱,葡聚糖凝胶,HPLC
普洱茶是云南的特色茶,是国家地理标志性产品,研究表明,普洱茶具有减肥、降脂、防止动脉硬化、抗衰老、抗癌、拟菌、消炎、抗毒、抑菌等多种功效[1-5]。普洱茶在其加工过程中按后发酵工序的有、无可分为普洱熟茶和普洱生茶两大类[6]。两者不仅在品质特征上有明显差异,在内含物的化学成分上也相差悬殊[7-8]。目前为止,国内外研究者对普洱茶生茶或晒青毛茶的植物化学开展了一定的研究。如:周志宏等从普洱茶原料晒青毛茶中分离鉴定出了包括儿茶素、黄酮及其苷类、酚酸类化合物在内的21个化合物,从云南云县普洱茶中分离鉴定出了12个化合物,其中有两个为新化合物普洱素(Puerin)A和B[9];林智等也从双江县普洱茶中分离鉴定出了杨梅素、山奈酚、山奈酚-3-O-β-D-葡萄糖苷,山奈酚-3-O-芦丁糖苷,槲皮素,槲皮素-3-O-β-D-葡萄糖苷等包括黄酮醇及其苷类在内的11种化合物[10]。但普洱熟茶的后发酵阶段,在微生物、热和多种复杂酶类的作用下,普洱熟茶中含天然酚类化合物在内的生化成分容易发生氧化,水解、异构、裂解等化学变化,形成聚合度更高的复杂多聚体,给以普洱熟茶为研究对象的植物化学研究带来了较大的难度,从而制约了普洱熟茶功效的深度研究[11]。为此,本文以茶叶中主要的生理活性成分,同时对茶叶品质也有重要影响的黄酮醇类物质为研究目标,采用了有机溶剂提取以及传统的柱色谱法对其开展了分离纯化效果的探索性研究,旨在探讨柱色谱法对普洱茶中黄酮醇类化合物的分离效果和深入开展普洱熟茶生化成分的精细化研究提供理论依据和技术支撑。
1 材料与方法
1.1 材料与仪器
普洱熟茶 由大益集团提供(批次:201;生产日期:2012年4月10日);槲皮素(纯度≥97.4%)、山奈酚(纯度≥98%)、杨梅素(纯度≥98%) 购于SIGMA公司;甲醇(色谱级,MADE IN USA),乙醇、磷酸为AR级 天津市风船化学试剂科技有限公司;超纯水 实验室自制;高效液相色谱仪(HPLC)分析装置 美国Agilent 1200型高效液相色谱系统;TSKgel ODS-80TM色谱柱 4.6 mm×250 mm,5 μm,日本Tosoh公司;电子天平 型号:CP214,奥豪斯仪器(上海)有限公司;旋转蒸发仪 德国IKARV 8V-C;EPED-E2-20TH易普易达实验室级超纯水器 南京易普易达科技发展有限公司;孔径0.45 μm过滤膜 天津津腾实验设备有限公司;砂芯过滤装置 天津津腾实验设备有限公司;MCI GEL CHP 20P 75~150 μm产于日本;SephadexTMLH-20 瑞典。
1.2 实验方法
1.2.1 黄酮醇类化合物的提取方法 称取500 g普洱熟茶→加2 L 70%乙醇水溶液→室温(提取24 h)→提取液→过滤→滤液减压蒸馏去乙醇→浓缩提取液。(整个提取过程重复3次)
1.2.2 黄酮醇类化合物的分离纯化方法 装柱:色谱柱规格有7 cm×60 cm、5.5 cm×50 cm两种,其中7 cm×60 cm的色谱柱中装填20 cm高的MCI GEL CHP 20P(75~150 μm)树脂,5.5 cm×50 cm的色谱柱装填20 cm高的SephadexTMLH-20葡聚糖凝胶。装填好的色谱柱经甲醇洗脱后再经纯水洗净备用。
浓缩提取液过直径7 cm的树脂MCI GEL CHP 20P(75~150 μm)色谱柱,依次用3倍体积10%乙醇溶液、2倍体积30%乙醇溶液、2倍体积50%乙醇溶液、2倍体积70%乙醇溶液、2倍体积90%乙醇溶液以9~10 mL·min-1流速进行梯度洗脱,将收集的洗脱液分别浓缩,获得10%浓缩液、30%浓缩液、50%浓缩液、70%浓缩液和90%浓缩液。再将70%和90%的浓缩液分别过葡聚糖凝胶(SephadexTMLH-20)色谱柱,分别用不同浓度的乙醇水溶液以4~5 mL·min-1的流速洗脱,具体分离路线如图1所示。

图1 普洱熟茶黄酮醇类化合物的提取及分离路线图Fig.1 Extraction and separation roadmap of flavonols in cooked Pu-erh tea
1.2.3 色谱条件 色谱柱:TSK gel ODS-80TM色谱柱。流动相:A相:0.2%磷酸水溶液;B相:80%甲醇水溶液,梯度从40% B到90% B,流速0.8 mL/min,40 min内完成,检出波长360 nm,柱温40 ℃,进样量10 μL,每次完成后系统平衡7 min后再次进样。流动相A、B均用0.45 μm的滤膜过滤,分析样都经孔径0.45 μm的滤膜过滤后进行HPLC检测。
2 结果与分析
2.1 普洱熟茶提取液及其浓缩液上MCI GEL CHP 20P树脂色谱柱经不同乙醇浓度洗脱的分离效果
图2是普洱熟茶提取液(图2A)及其浓缩液上MCI GEL CHP 20P树脂色谱柱经10%乙醇洗脱液(图2B)、30%乙醇洗脱液(图2C)、50%乙醇洗脱液(图2D)、70%乙醇洗脱液(图2E)和90%乙醇洗脱液(图2F)的HPLC色谱图。从图2可以看出,普洱熟茶提取液黄酮醇类物质的色谱峰集中分布在保留时间3~28 min的区段内,且在保留时间12~23 min的区间出现了响应值较高的8个色谱峰(图2A,a~h);10%和30%乙醇浓度洗脱液只在保留时间为4.5 min时有1个响应值较大的色谱峰外,没有检测出太多的色谱峰,说明低浓度的乙醇水溶液对普洱熟茶黄酮醇类物质的洗脱效果不理想;50%洗脱液的黄酮醇类物质集中分布在保留时间10~25 min的区段内,且与普洱熟茶提取液的HPLC色谱图比较可以看出,50%乙醇洗脱液的黄酮醇类物质组成和普洱熟茶提取液中黄酮醇类物质的组成相似,在12~19 min的区间也出现图2中所示的响应值较高的6个(a~f)色谱峰,但保留时间在20 min以后的黄酮醇类物质没有被洗脱出来;70%乙醇洗脱馏分的黄酮醇类物质集中分布在保留时间16~29 min的区段内,且在23 min时出现了响应值较大的1个色谱峰(g),由此推断70%乙醇洗脱液可作为纯化此黄酮醇类物质的最佳洗脱液;90%乙醇洗脱液的黄酮醇类物质集中分布在保留时间为15~38 min区段内,也在27 min时出现了响应值较大的1个色谱峰(h),由此推断90%乙醇洗脱液也可作为纯化此黄酮醇类物质的最佳洗脱液。从上述结果可以看出,MCI GEL CHP 20P树脂色谱柱在分离普洱熟茶黄酮醇类物质有一定的初步分离效果。

图2 普洱熟茶提取液及经树脂色谱柱分离得到的不同乙醇浓度梯度洗脱液的HPLC色谱图Fig.2 HPLC chromatomap of tea extraction and different ethanol concentration by resin gel column chromatography eluting with a gradient fractions
2.2 葡聚糖凝胶SephadexTMLH-20色谱柱分离效果
为了获得纯度较高的普洱茶黄酮醇类物质,本实验按1.2.2中图1所示的分离纯化方法对普洱茶黄酮醇类物质进行了细分离和纯化。将经MCI GEL CHP 20P树脂色谱柱初分获得的70%乙醇洗脱液和90%乙醇洗脱液经减压蒸馏去乙醇的浓缩液分别过直径5.5 cm的葡聚糖凝胶SephadexTMLH-20色谱柱。浓缩后的70%乙醇洗脱液依次用3倍体积70%乙醇溶液、2倍体积80%乙醇溶液、2倍体积90%乙醇溶液以4~5 mL·min-1的流速洗脱,分别收集洗脱液,洗脱浓缩液过滤膜后进行HPLC检测;浓缩后的90%乙醇洗脱液依次用2倍体积70%乙醇溶液、2倍体积80%乙醇溶液、2倍体积90%乙醇溶液以4~5 mL·min-1的流速洗脱,分别收集洗脱液,浓缩后过滤膜进行HPLC检测。结果乙醇浓度为70%的浓缩液过葡聚糖凝胶(SephadexTMLH-20)色谱柱经2倍体积90%的乙醇溶液洗脱纯化,获得了Fr1和Fr2两种单体物质;乙醇浓度为90%的浓缩液过葡聚糖凝胶(SephadexTMLH-20)色谱柱经3倍体积70%的乙醇溶液洗脱纯化,获得了一种单体物质Fr3。鉴于获得的Fr1、Fr2和Fr3三种单体物质分别与杨梅素、槲皮素和山奈酚的保留时间相近,采用加标品确认的方法,在此三种物质中分别加入杨梅素、槲皮素和山奈酚的标准品,并经HPLC分析确认,Fr1与杨梅素的保留时间完全一致,且Fr1色谱峰与杨梅素的色谱峰完全重合,加入杨梅素标准品后Fr1色谱峰的响应值也相应增加(图3),说明Fr1为杨梅素;同样,Fr2与槲皮素的保留时间完全一致,Fr2色谱峰与槲皮素的色谱峰完全重合,且加入槲皮素标准品后Fr2色谱峰的响应值也相应增加(图4),说明色Fr2为槲皮素;Fr3与山奈酚的保留时间完全一致,Fr3色谱峰与山奈酚的色谱峰完全重合,且加入山奈酚标准品后Fr3色谱峰的响应值也相应增加(图5),说明Fr3为山奈酚。
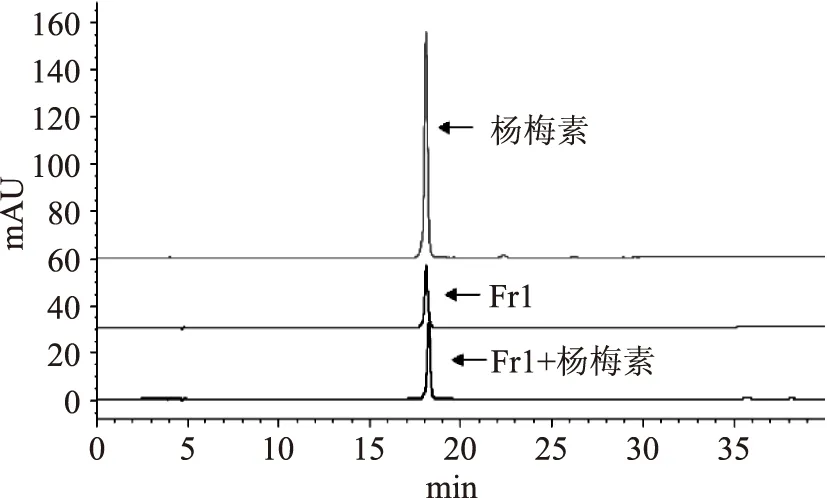
图3 杨梅素、Fr1及其加入杨梅素标准品的HPLC色谱图Fig.3 HPLC chromatomap of myricetin,Fr1 and standard addition of myricetin

图4 槲皮素、Fr2及其加入槲皮素标准品的HPLC色谱图Fig.4 HPLC chromatomap of quercetin,Fr2 and standard addition of quercetin

图5 山奈酚、Fr3及其加入山奈酚标准品的HPLC色谱图Fig.5 HPLC chromatomap of kaempferol,Fr3 and standard addition of kaempferol
从上述分离结果可知,与MCI GEL CHP 20P树脂色谱柱粗分离的效果相比,葡聚糖凝胶(SephadexTMLH-20)色谱柱对普洱熟茶黄酮醇类物质的分离效果显著。经MCI GEL CHP 20P树脂色谱柱初分获得的70%乙醇洗脱液过葡聚糖凝胶(SephadexTMLH-20)色谱柱,经90%的乙醇洗脱液洗脱纯化,获得了HPLC纯度为96.0%的杨梅素和98.5%的槲皮素;MCI GEL CHP 20P树脂色谱柱初分获得的90%的洗脱液过葡聚糖凝胶(SephadexTMLH-20)色谱柱经70%的乙醇溶液洗脱纯化,获得了HPLC纯度为95.6%的山奈酚。
3 结论
3.1 MCI GEL CHP 20P树脂色谱柱在分离普洱熟茶黄酮醇类物质有初步分离效果,70%乙醇溶液浸提获得的普洱熟茶提取浓缩液上MCI GEL CHP 20P树脂色谱柱,经不同浓度(10%,30%,50%,70%,90%)乙醇溶液洗脱分离后,提取液中的黄酮醇类物质被分离开来,各个不同浓度的乙醇洗脱液其物质组成各不相同,10%和30%乙醇浓度洗脱液中没有检测到太多的色谱峰,说明低浓度的乙醇水溶液对普洱熟茶黄酮醇类物质的洗脱效果不理想(图2B、图2C);50%乙醇洗脱液的黄酮醇类物质组成和普洱熟茶提取液中黄酮醇类物质的组成相似(图2D);70%和90%的乙醇洗脱液中分别在保留时间23 min和27 min时各自检测到了响应值较大的1个色谱峰g和h(图2E,图2F)。
3.2 经MCI GEL CHP 20P树脂色谱柱初分获得的70%乙醇洗脱液过葡聚糖凝胶(SephadexTMLH-20)色谱柱,经90%的乙醇溶液洗脱纯化,获得了HPLC纯度为96.0%的杨梅素和98.5%的槲皮素;MCI GEL CHP 20P树脂色谱柱初分获得的90%的洗脱液过葡聚糖凝胶(SephadexTMLH-20)色谱柱经70%的乙醇溶液洗脱纯化,获得了HPLC纯度为95.6%的山奈酚。说明葡聚糖凝胶(SephadexTMLH-20)色谱柱对普洱熟茶黄酮醇类物质的分离纯化效果显著。
[1]周红杰,秘鸣,韩俊,等.普洱茶的功效及品质形成机理研究进展[J].茶叶,2003,(2):76-77.
[2]Gong JS,Peng CX,He X,et al. Antioxidant Activity of Extracts of Pu-erh Tea and Its Material[J].Asian Journal of Agricultural Sciences,2009(1):48-54.
[3]方祥,李斌,陈栋,等. 普洱茶功效成分及其品质形成机理研究进展[J]. 食品工业科技,2008,29(6):313-314.
[4]赵龙飞,周红杰,安文杰,等. 云南普洱茶保健功效的研究[J]. 食品研究与开发,2005,26(2):114-116.
[5]东方,何普明,林智,等. 普洱茶的抗氧化活性研究进展[J]. 食品科学,2007,28(5):364-365.
[6]崔文锐. 普洱茶的品质特点及鉴赏[J]. 茶苑,2005(2):22-23.
[7]宛晓春. 茶叶生物化学[M]. 中国农业出版社,2003(第三版):275-278.
[8]杨崇仁,陈可可,张颖君. 茶叶的分类与普洱茶的定义[J].茶叶科学技术,2006(2):37-38.
[9]Zhou ZH,Zhang YJ,Xu M,et al. Puerins A and B,Two New 8-C Substituted Flavan-3-ols from Pu-er Tea[J].Journal of Agricultural and Food Chemistry,2005(53):8614-8617.
[10]林智,吕海鹏,催文锐,等.普洱茶的抗氧化酚类化学成分的研究[J]. 茶叶科学,2006,26(2):112-116.
[11]张春花,单治国,周红杰.云南普洱茶加工中黄酮醇类化合物的研究[J].茶叶通讯,2008(1):9-10.
Separation and purification of flavonols myricetin,quercetin and kaempferol in cooked Pu-erh tea
GUAN Wen-yu1,LI Yan-li1,LI Yan-fang1,LI Jia-wei2,SHI Yin-hua1,LI Jia-hua1,*
(1.College of Long Run Pu-erh Tea,Yunnan Agricultural University,Kunming 650201,China;2.Lianghe County Nang song Achang Nationality Township Comprehensive Agricultural Service Center,Lianghe 679200,China)
In this paper,Yunnan cooked Pu-erh tea was used as experiment material,separation and purification of flavonols were investigated with different concentrations of ethanol as eluent by column chromatography of resin and SephadexTMLH-20,combined with high-performance liquid phase chromatography(HPLC)method,and the main flavonols were isolated and characterized. The results showed that:the extract of cooked Pu-erh tea with different concentrations(10%,30%,50%,70%,90%)of ethanol by MCI GEL CHP 20P(75~150 μm),the myricetin with the HPLC purity of 96.0% and the quercetin with the HPLC purity of 98.5% were isolated from elution 70% eluent with 90% ethanol while kaempferol with the HPLC purity of 95.6% was isolated from elution 90% eluent with 70% ethanol by SephadexTMLH-20.
cooked Pu-erh tea;flavonols;resin gel column chromatography;sephadex gel;HPLC
2014-12-30
关文玉(1989-),女,硕士,研究方向:茶叶生化,E-mail:guanwenyu1989@163.com。
*通讯作者:李家华(1970-),男,博士,教授,主要从事茶叶生化方面的研究,E-mail:jiahua1124@hotmail.com。
国家自然科学基金项目(31160173)。
TS201.1
A
1002-0306(2015)21-0060-04
10.13386/j.issn1002-0306.2015.21.003

