嗜热脂肪芽孢杆菌耐热β-半乳糖苷酶功能位点的累积进化研究
董艺凝,陈海琴,张 灏,陈 卫
(1.滁州学院生物与食品工程学院,安徽滁州 239000;2.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122)
嗜热脂肪芽孢杆菌耐热β-半乳糖苷酶功能位点的累积进化研究
董艺凝1,陈海琴2,*,张 灏2,陈 卫2
(1.滁州学院生物与食品工程学院,安徽滁州 239000;2.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122)
针对嗜热脂肪芽孢杆菌(Geobacillusstearothermophilus)来源耐热β-半乳糖苷酶BgaB底物结合位点构建突变体,研究底物结合位点累积突变的功能进化及水解活性的变化规律。实验结果表明:Y272A与E351R的累积突变体比酶活为野生型酶的3.67倍,为单点突变体Y272A的2倍;Y272A/E351R突变体的Km值增大,其对乳糖的亲和力下降,但由于Kcat值增大,使累积突变体Y272A/E351R催化效率提高为野生型酶催化效率的7.8倍。本研究结果表明底物结合位点间的累积突变可改变底物亲和性,并对水解催化活性进化起到正向促进作用。
β-半乳糖苷酶,嗜热脂肪芽孢杆菌,累积进化,功能位点
β-半乳糖苷酶(β-d-galactoside galactohydrolase,EC 3.2.1.23)可以水解β-1,4-糖苷键,乳品工业用其水解乳糖生产低乳糖奶,以及利用β-半乳糖苷酶转糖苷活性合成低聚半乳糖(GOS)。嗜热脂肪芽孢杆菌来源的耐热β-半乳糖苷酶BgaB属于GH42家族,该家族β-半乳糖苷酶具有耐热、耐盐、耐酸以及耐碱等催化特性,但其对底物乳糖的利用效率普遍较低。因此,针对嗜热脂肪芽孢杆菌来源的耐热β-半乳糖苷酶BgaB功能进化及氨基酸位点的研究,可更好的改造β-半乳糖苷酶在特殊生产环境下的适应性。
自然界在进化过程将有益突变保留并累积以强化蛋白质功能[1-2]。人们在实验室环境下模拟自然进化过程,通过采用蛋白质或基因工程技术,包括易错PCR、定点突变以及点饱和突变等基因扩增技术,对酶分子进行功能改造。在获得功能优化的单点突变体基础上,进行不同功能氨基酸位点间的多点突变,可以使蛋白质功能获得进一步改善及“累积”[3-5]。如Cervelli M等[6],通过对活性口袋中底物结合位点的累积突变(E216L/S218A 和E216T/S218A)使spermine oxidase进化获得N1-acetylspermine oxidase activity。柯涛等[7]利用重叠延伸法对嗜热球菌Thermococcussp.的高温酸性α-淀粉酶基因BD5088进行体外A154C/G155C双点定点突变,酶学性质分析表明,突变淀粉酶拓宽了反应pH范围,尤其是酸性条件下提高更为显著。在前期研究中,笔者对耐热β-半乳糖苷酶BgaB底物结合位点进行了预测及功能改造,并获得了功能进化的单点突变体[8]。为了探索这些位点间协同进化规律,底物亲和性变化特点,进而开展了本项研究,探讨β-半乳糖苷酶功能氨基酸位点间累积进行对酶功能的影响。

表2 定点突变引物核酸序列
1 材料与方法
1.1 材料
1.1.1 菌株和质粒Escherichiacoli(E.coli)JM109(recA1,supE44,endA1,hsdR17,gyrA96,relA1,thi,([lac-proAB]F’[traD36,proAB+,lacIq,lacZΔM15]),DH5α(supE44ΔlacU169hsdR17(Φ80lacZΔM15)RecA1endA1gyrA96thi-1relA1);质粒载体pKK223-3均由江南大学食品生物技术中心菌种库(Culture Collection of Food Microorganisms,Jiangnan university CCFM)提供。
1.1.2 主要试剂及仪器设备 氨苄青霉素(Amp) 购自上海生工;限制性内切酶,T4 DNA连接酶,Taq DNA聚合酶 购自Takara公司;KOD plus高保真DNA聚合酶 购自Toyobo公司;DpnI 购自Fermentas公司;DNA琼脂糖凝胶电泳胶回收试剂盒 购自北京索莱宝科技有限公司;PCR产物纯化试剂盒 购自北京天根生化科技有限公司;BCA蛋白定量试剂盒 购自北京庄盟生物基因科技有限公司;葡萄糖测定试剂盒 上海荣盛生物药业有限公司;镍亲和柱(Ni-Chelaing Column) Qingen公司。
GS00001PCR仪 英国G-STROM公司;5415R/5804R冷冻离心机 德国Eppendorf公司;Power pac核酸电泳仪 Bio-Rad Laboratories;Basic 041BR蛋白质电泳仪 Bio-Rad Laboratories;Geldoc 2000凝胶成像系统 Bio-Rad Laboratories;SpectraMax M5/M5e微孔板检测系统 Molecular Devices;UV-2100可见分光光度计 尤尼柯上海仪器有限公司;MK3酶标仪 Thermo公司;VCX500超声波破碎仪 SONICS&MATERIALS公司。
1.2 实验方法
1.2.1 累积突变体设计 本文在已有研究基础上,将BgaB的不同功能进化的单点突变体进行突变累积研究,以进一步探讨及功能变化及作用机制。累积突变设计如表1所示。
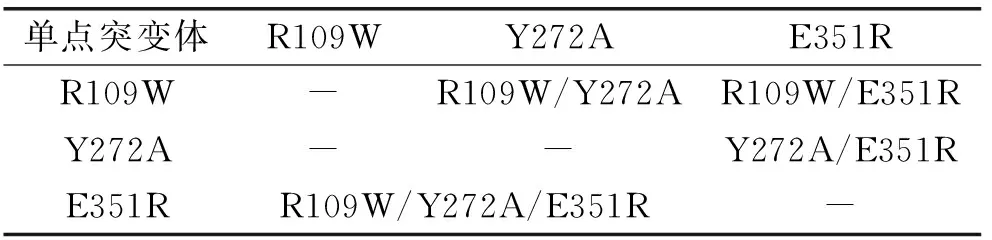
表1 累积突变实验设计表
1.2.2 累积突变体的构建 以构建质粒pKK223-3-bgaB的单点突变体(R109W,E351R)为模板,采用快速全质粒扩增突变法(QuickChange® site-directed mutagenesis protocol)针对选择位点引入累积位点突变体。三位点累积突变以构建双点突变体为模板。引物设计如表2。
1.2.3 野生型及突变酶的表达及纯化 以JM109作为宿主,pKK223-3作为表达载体对野生型及突变酶进行诱导表达。菌体破壁后将破胞液55℃热处理30min去除不耐热的杂蛋白后,12000r/min离心20min收集上清,即得粗酶液。经镍亲和柱(Ni-Chelating Column)纯化,然后用50mmol/L磷酸缓冲液(pH7.0)透析除去咪唑,再用聚乙二醇包埋浓缩制得纯化酶蛋白样品。
1.2.4 β-半乳糖苷酶活性测定 按中性乳糖酶酶活检测方法(Gist-Bracades法)[9]。以邻硝基苯β-d-半乳吡喃糖苷(oNPG)为底物,一个中性乳糖酶单位定义为:在pH6.5条件下,每分钟水解产生1μmol的oNP所需的酶量为一个中性乳糖酶活单位(NLU或U)。对嗜热脂肪芽孢杆菌源酶及其重组酶,反应温度定为55℃。
1.2.5 最适反应pH 配制不同pH的磷酸盐缓冲液,并用相应的缓冲液溶解底物oNPG,在最适反应温度下按中性乳糖酶酶活检测方法(Gist-Bracades法)测定相对酶活。
1.2.6 动力学常数测定 配制oNPG浓度0.1~15mmol/L,在50mmol/L磷酸盐缓冲液(pH 7.0),55℃条件下测定酶反应初速度。采用Lineweaver-Burk法对1/V-1/[S]作图,根据两轴上的截距求得Km值(x轴截距负倒数)与Vmax(y轴截距倒数),再由Vmax=kcat*[E]计算求出kcat;半乳糖抑制实验为在酶活测定反应体系中加入不同浓度半乳糖(0~200mmol/L),以Linweaver-Burk 作图法求Ki。
1.2.7 β-半乳糖苷酶热稳定性测定 将酶溶解于20mmol/L磷酸盐缓冲液(pH7.0)中,不同温度下保温一定时间后,取出迅速冷却,室温平衡后按1.2.4方法测定酶活。半衰期的测定方法为将野生型及突变体纯化酶置于70℃水浴保温,每间隔5min取样迅速置冰水中冷却。在最适反应温度条件下测定酶活。以未经热处理,最适反应温度下测得酶活100%,不同时间热处理后保留酶活对时间作图,求得野生型及突变体酶半衰期。
1.2.8 β-半乳糖苷酶BgaB结构模拟分子 结构模拟采用同源建模法,以同源家族晶体结构A4-β-Gal为模板(PDB:1kwk),采用在线建模服务器(http://swissmodel.expasy.org/)构建BgaB分子模拟结构。利用AutoDock软件对底物结合模式进行预测。
2 结果与分析
2.1 功能位点的预测与分析
耐热β-半乳糖苷酶以其良好的热稳定性,及适宜高温度条件下乳糖水解的特性,使之具有常温乳糖酶所不具有的催化优越性。但是由于其对乳糖的水解活性较低,限制了其在食品工业中的应用。在之前的研究中,通过同源序列比对预测了参与耐热β-半乳糖苷酶BgaB底物结合的位点,发现可能参与底物结合的位点包括Arg109,Asn147,Try272,Trp311,Phe341,Glu351和His354(如图1)。并针对所有位点构建了饱和突变体文库,通过突变体库的筛选,获得了乳糖水解活性提高的单点突变体E351R,Y272A和R109W。
图1 β-半乳糖苷酶BgaB与乳糖和半乳糖分子结合位点模型Fig.1 The binding modes of the lactose and galactose in the active site of BgaB注:A-乳糖结合位点示意图;B-半乳糖结合位点示意图。
2.2 累积突变设计及粗酶活分析
以本研究前期工作已经构建的单点突变酶基因为模板,采用全质粒扩增方法在酶基因序列上引入突变,所有累积突变体扩增得到大小为5000bp左右的条带(如图2),符合全质粒扩增产物大小。
图2 耐热β-半乳糖苷酶BgaB累积突变体全质粒扩增电泳图Fig.2 Electrophoresis of thermostable β-galactosidase BgaB cumulative mutagenesis by plasmid amplification注:1-pKK223-3-bgaB;2-R109W/E351R;3-Y272A/E351R;4-R109W/Y272A;5-R109W/Y272A/E351R. M-DNA Marker。
96孔板粗酶活比较结果如图3所示,相对于野生型酶活性提高的突变有Y272A/E351R。但是其中R109W/Y272A和R109W/E351R活性相对野生型酶及单点突变体,其反应体系吸光值均有不同程度下降,表明其酶活下降,而累积突变体R109W/Y272A/E351R未检测到405nm处吸光值。由于采用酶反应体系吸光值灵敏度受到表达量影响较大,故对突变体酶进行纯化分析。
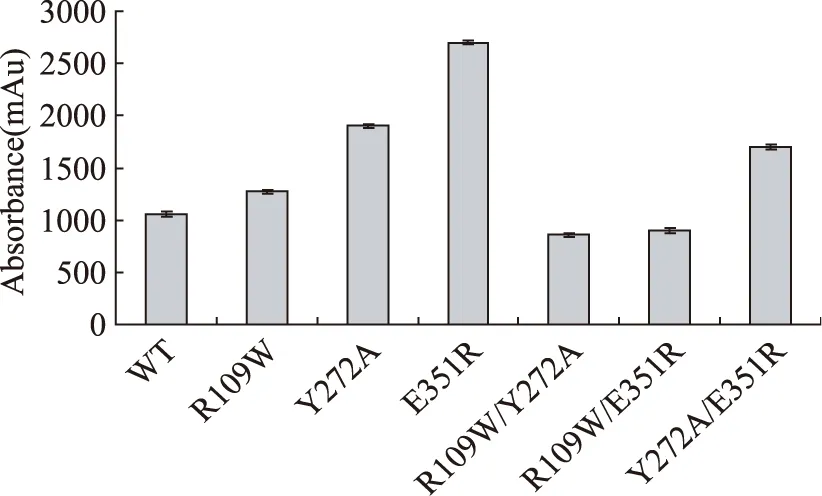
图3 突变酶与野生型酶粗酶活比较Fig.3 Comparative of the crude enzyme activity of mutants and wild-type enzymes
2.3 累积突变体水解活性分析
为了研究累积突变体酶的催化特性,首先对累积突变体R109W/Y272A,R109W/E351R,Y272A/E351R和R109W/Y272A/E351R进行蛋白纯化(如图4)。突变体酶与野生型相比,蛋白分子量大小相同均为70ku。分别对纯化突变体酶进行比酶活、最适pH及酶反应动力学测定。

图4 野生型及累积突变体酶SDS-PAGE分析Fig.4 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE)analysis of the purified wild-type and mutant enzymes.注:1-野生型酶;2-R109W/Y272A;3-R109W/E351R;4-Y272A/E351R;5-R109W/Y272A/E351R;M:蛋白质标准marker。
2.3.1 突变体比酶活变化分析 累积突变体比酶活分析结果如表3所示,R109,Y272和E351三个位点累积突变体中,双点突变体Y272A/E351R比酶活最高,为野生型酶比酶活的3.67倍,分别是单点突变体Y272A的2.1倍,是R109W突变体比酶活的3倍。双点突变R109W/Y272A和R109W/E351R的比酶活小于单点突变体,并下降为野生型酶比酶活的76%和68%。其中,单点突变体E351R是经定向进化筛选所得比酶活提高最多的突变体,其比酶活为野生型的3.5倍。其次是Y272A突变体比酶活为野生型酶的1.8倍。R109W是Arg109位点突变体库中筛选得到的最优突变,其比酶活比野生型提高了1.2倍。比酶活比较结果显示,双位点累积突变体酶活相对野生型及单位点突变体酶活变化呈提高和下降两种变化,但R109W/Y272A/E351R累积突变体酶失活。

表3 野生型及突变酶比酶活分析
注:N.D.-未检测到活性。
2.3.2 最适pH的变化 双点突变体最适作用pH与野生型酶及对应单点突变体比较结果如图5所示。突变体R109W/E351R最适pH为7.5,与单点突变体E351R相同,二者最适作用pH条件均相对野生型酶(pH7.0)及单点突变体R109W(pH 7.25)向碱性条件偏移(图5-A);双点突变R109W/Y272A相对野生型酶最适pH向酸性条件发生偏移,但与单点突变体Y272A最适pH相同均为6.75(图5-B)。双点突变体Y272A/E351R的最适pH介于单点突变Y272A(pH6.75)和单点突变体E351R(pH7.5)之间,相对野生型最适pH向碱性条件偏移(图5-C)。
通过与GH42家族A4-β-Gal晶体结构比较分析,发现BgaB的底物结合位点Arg109和Glu351位点均位于BgaB的活性口袋内,分别参与底物半乳糖基C3,C4结合(如图6)。Tyr272位点虽然未在结构模拟中分析到它的结合能,即该位点没有直接通过氢键作用参与底物结合,在同家族酶A4-(-gal结构中,与其对应的Tyr266和被认为具有调控催化氨基酸Glu312位点pka的功能[10]。本项研究中Tyr272位点的突变也改变了BgaB的最适作用pH条件,表明Tyr272位点(以BgaB氨基酸序列编码)可能在GH42家族糖苷水解酶中起到调控pH的作用,因此在催化过程中不可缺失。Arg109位点及Glu351氨基酸位点的改造及累积突变对pH的影响机制还有待进一步探讨。

图5 野生型、单点突变体及累积突变体最适pHFig.5 The optimum pH of the willd-type,single mutation and double mutation注:A-R109、E351双点突变体最适pH;B-R109、Y272双点突变体的最适pH;C-Y272、E351双点突变体最适pH。

图6 耐热β-半乳糖苷酶BgaB分子结构及底物结合位点模拟Fig.6 Homology model of the thermostable β-galactosidase BgaB and substrate binding注:A-耐热β-半乳糖苷酶BgaB与底物结合示意图;B-参与半乳糖分子结合的氨基酸位点示意图。

表4 野生型及突变酶水解oNPG和乳糖反应动力学参数
2.3.3 酶反应动力学参数分析 累积突变体的动力学参数测定结果及与野生型、单点突变体的比较如表4。以oNPG作为底物时,累积突变体R109W/E351R,R109W/Y272A和Y272A/E351R与野生型酶相比km值均增大。表明双点突变对底物的亲和力有所下降,但累积突变体转换常数kcat相对野生型变大。Y272A/E351R的催化效率(kcat/Km)高于单点突变体酶Y272A,E351R及野生型酶,是野生型酶催化效率的5倍。由此可以看出,双点突变Y272A/E351R的底物亲和力有所下降,但kcat的提高最终促进催化效率的提高增大。Arg109位点与Glu351位点的累积突变没有进一步提高催化效率,R109W/E351R和R109W/Y272A的催化效率相对野生型及单点突变均变小,这可能主要是由于底物亲和力显著降低造成的。
以乳糖为底物的动力学测定结果表明,Y272A/E351R相对野生型km值变大,对乳糖的亲和力下降。但由于kcat值同时增大,使累积突变体Y272A/E351R催化效率相对野生型和单点突变体均有所提高,为野生型酶催化效率的7.8倍。这表明Y272A/E351R对乳糖和oNPG为底物的动力学参数变化规律一致,累积突变可以使催化效率相对单点突变获得提高。累积突变体R109W/E351R以乳糖和oNPG为底物的动力学反应相对野生型的变化规律有所不同。虽然,R109W/E351R以oNPG为底物的催化效率相对野生型及单点突变均有所下降,但以乳糖为底物时,R109W/E351R相对野生型酶其Km值变小、kcat值增加。表明R109W/E351R突变体对乳糖的亲和力增加,反应速率增大,且催化效率提高为野生型酶的2倍。累积突变体R109W/E351R对不同底物催化效率发生改变的现象也表明,累积突变可能影响了底物的选择性。
2.4 累积突变体稳定性分析
对双点突变的热稳定性研究结果,如图7所示。70℃下双点突变体与野生型酶的热失活进程曲线相似,表明影响活性的Arg109,Try272及Glu351位点间累积突变后,未改变酶的稳定特性。从单点突变体与双点突变的最适作用温度比较还可以发现,野生型酶及双点突变体最适作用温度均为55℃(如图8)。其中,Y272A/E351R突变体酶活在不同温度条件下,比酶活均高于野生型酶。综合以上研究结果可知,R109W/E351R,R109W/Y272A以及Y272A/E351R突变体均未改变酶的热稳定性。该结果表明BgaB 功能位点间的累积突变不影响酶的稳定特性及最适作用温度。

图7 野生型及突变体酶热失活过程(70℃)Fig.7 Thermal inactivation curves of wild-type and mutants(70℃)

图8 野生型及突变酶比酶活的温度变化图Fig.8 Specific activity of wild-type and mutants over temperature
3 结论
通过对突变体比酶活及酶反应动力学结果分析表明,底物结合位点间的累积突变可以导致酶对底物亲和力发生变化,进而影响了酶的催化活性。这一研究结果说明,底物结合模式是影响底物亲和特异性及催化特性关键因素。本研究中,底物结合位点间的累积进化,可对酶的催化活性产生两种相反的改变,包括比酶活提高和比酶活的降低。但累积突变对于酶的催化活性影响产生负作用的可能性要大于其对酶功能的正向促进作用,且三点累积突变体可导致酶失活。说明功能位点耐受突变的程度有限,这一结果符合自然进化规律,即酶的催化位点都具有严格的保守性[11-12]。其原因可能在于保守氨基酸位点的突变及累积突变所带来的功能改变大多对于酶的催化特性而言是不利的[13]。但同时,对功能位点的改造可以实现酶的快速功能进化。参与底物结合位点间作用关系的揭示也将有助于蛋白质功能的改造和催化机制的完善。本研究结果也同时表明了,对底物结合位点间位点的累积突变,是一种提高β-半乳糖苷酶功能进化的高效策略。但氨基酸位点间的相互影响及作用关系十分复杂,对这种复杂变化的结构基础还有待进一步深入探讨。
[1]Moore JC,Jin HM,Kuchner O,et al. Strategies for theinvitroevolution of protein function:enzyme evolution by random recombination of improved sequences[J]. J Mol Biol,1997,272(3):336-347.
[2]Mildvan AS. Inverse thinking about double mutants of enzymes[J]. Biochemistry,2004,43(46):14517-14520.
[3]Silva C,Da S,Silva N. Engineered Thermobifida fusca cutinase with increased activity on polyester substrates[J]. Biotechnol J,2011:(Epub ahead of print).
[4]Sugiarto G,Lau K,Li Y. Decreasing the sialidase activity of multifunctional Pasteurella multocidaalpha2-3-sialyltransferase 1(PmST1)by site-directed mutagenesis[J]. Mol Biosyst 2011:(Epub ahead of print).
[5]Kim KP,Cho SS,Lee KK. Improved thermostability and PCR efficiency of Thermococcus celericrescens DNA polymerase via site-directed mutagenesis[J]. J Biotechnol 2011,155(2):156-163.
[6]Cervelli M,Angelucci E,Stano P. The Glu216/Ser218 pocket is a major determinant of spermine oxidase substrate specificity[J]. Biochem J,461(3):453-459.
[7]柯涛,刘征,杨建伟. A154C/G155C 双点突变对嗜热耐酸淀粉酶酶活性及热稳定性的影响[J]. 食品科学,2012,33(3):207-211.
[8]Dong YN,Liu XM,Chen HQ. Enhancement of the hydrolysis activity of beta-galactosidase from Geobacillus stearothermophilus by saturation mutagenesis[J]. J Dairy Sci,2011,94(3):1176-1184.
[9]Chen W,Chen H,Xia Y. Production,purification,and characterization of a potential thermostable galactosidase for milk lactose hydrolysis from Bacillus stearothermophilus[J]. J Dairy Sci,2008,91(5):1751-1758.
[10]Hidaka M,Fushinobu S,Ohtsu N. Trimeric crystal structure of the glycoside hydrolase family 42 beta-galactosidase from Thermus thermophilus A4 and the structure of its complex with galactose[J]. J Mol Biol,2002,322(1):79-91.
[11]Kirschner A,Bornscheuer UT. Directed evolution of a Baeyer-Villiger monooxygenase to enhance enantioselectivity[J]. Appl Microbiol Biotechnol,2008,81(3):465-472.
[12]Zhu Z,Wang M,Gautam A. Directed evolution of glucose oxidase from Aspergillus niger for ferrocenemethanol-mediated electron transfer[J]. Biotechnol J,2007,2(2):241-248.
[13]Fujii R,Nakagawa Y,Hiratake J. Directed evolution of Pseudomonas aeruginosa lipase for improved amide-hydrolyzing activity[J]. Protein Eng Des Sel,2005,18(2):93-101.
Coevolutionary study on the functionary amino acid residues ofGeobacillusstearothermophilusthermostable β-Galactosidase BgaB
DONG Yi-ning1,CHEN Hai-qin2,*,ZHANG Hao2,CHEN Wei2
(1.School of Biotechnology and Food Engineering,Chuzhou University,Chuzhou 239000,China;2. Shool of Food Science and Technology,State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
To study the coevolutionary of the functional residues and the variation of hydrolysis activity,the substrates binding residues simultaneous mutations ofGeobacillusstearothermophilusthermostable β-galactosidase were constructed. The results showed that the Y272A/E351R simultaneous mutant let a 3.67-fold increase in specific activity over the wild type enzyme and give a 2-fold increase over the single site mutation Y272A. Increased Km value of Y272A/E351R mutant occurred with decreased affinity of lactose binding,while the mutant increased the catalytic efficiency of the wild type enzyme by 7.8-fold. This study revealed that the simultaneous evolution of the substrate binding residues had its advantage on substrate affinity,and was favorable to the evolution of catalytic activity.
β-galactosidase;Geobacillusstearothermophilus;simultaneous evolution;functional residues
2014-06-16
董艺凝(1980-),女,博士,研究方向:酶的功能进化。
*通讯作者:陈海琴(1978-),女,博士,教授,研究方向:食品微生物功能发掘与利用。
国家青年科学基金项目(31301523);国家自然科学基金项目(31171636);十二五国家“863”计划(2011AA100905);安徽高校省级科学研究项目(KJ2013B187);滁州学院科研启动基金资助项目(2012qd14)。
TS201.3
A
1002-0306(2015)07-0148-06
10.13386/j.issn1002-0306.2015.07.023

