瘦素对大鼠肝纤维化的信号转导调控及槲寄生碱的干预作用
孟 霞,王学丛,丰 平,卢 静,王学江
(1.首都医科大学实验动物部,北京 100069;2.首都医科大学病理生理教研室,北京 100069)
瘦素对大鼠肝纤维化的信号转导调控及槲寄生碱的干预作用
孟 霞1,王学丛2,丰 平2,卢 静1,王学江2
(1.首都医科大学实验动物部,北京 100069;2.首都医科大学病理生理教研室,北京 100069)
目的 探讨瘦素调控大鼠肝纤维化的信号转导机制及槲寄生碱的干预作用。方法 以CCl4诱导的肝纤维化大鼠模型为研究对象,45只大鼠随机分为三组,分别为对照组、模型组、药物干预组。对照组不做任何处理,自由饮食、饮水;模型组和槲寄生碱治疗组分别腹腔注射40%CCl4-植物油溶液2mL/kg,每周2次,共8周。实验第9周,治疗组经灌胃给予大鼠槲寄生碱8g/(kg·d),模型组灌胃给予等剂量的生理盐水,共8周。实验第17周颈椎脱臼法处死所有动物,取出肝脏左前叶。采用HE染色、MASSON染色方法观察槲寄生碱对肝纤维化大鼠肝组织形态学的影响;免疫组织化学的方法观察槲寄生碱对大鼠肝星状细胞瘦素及瘦素受体的影响。Western Blot法检测大鼠肝脏组织JAK2、STAT3蛋白水平以及JAK2、STAT3蛋白磷酸化水平。结果 肝脏大体、HE染色以及Masson胶原染色结果提示:大鼠肝纤维化模型复制成功,槲寄生碱具有阻断逆转肝纤维化的作用。免疫组织化学染色显示,与模型组比较,槲寄生碱明显抑制模型大鼠肝组织瘦素、瘦素受体的表达。Western Blot显示,正常对照组JAK2、STAT3蛋白表达量最少;模型组JAK2、STAT3蛋白高表达;而药物处理组的JAK2、STAT3蛋白表达明显下调。结论 槲寄生碱可有效逆转大鼠肝脏纤维化,其作用机制可能是通过下调大鼠肝组织瘦素、瘦素受体的表达,进而影响JAK2/STAT3信号通路来完成的。
槲寄生碱;肝纤维化;肝星状细胞;瘦素;瘦素受体;JAK2/STAT3信号通路
肝纤维化是由于肝损伤引起纤维增生和纤维分解不平衡,导致肝脏纤维结缔组织的过度沉积所致。细胞、细胞因子及基质之间相互作用,使肝脏细胞外基质代谢紊乱,在窦周间隙过度沉积,继之肝窦毛细血管纤维化,造成纤维在肝脏内沉积过多,最后导致肝纤维化。目前认为,肝星状细胞激活、增殖并大量生成细胞外基质(extracellular matrix,ECM)的过程是肝纤维化病理机制的中心环节[1],而瘦素(leptin)与受体结合后,激活 JAK/STAT信号通路,引起下游的转录因子STAT3活化后发挥效应[2],从而促进细胞外基质的形成,促进肝纤维化的发生发展。肝纤维化目前是公认的肝癌前病变,由于肝纤维化过程是可逆的,因此对肝纤维化的治疗研究已成为当今我国肝病研究领域的热点课题。
方剂槲芪散(HQS)是国家级名老中医钱英教授在临床应用多年的经验方。前期临床观察研究表明该方在治疗慢性乙型病毒性肝炎疗效显著[3]。槲芪散的君药是槲寄生,我们前期实验证明,槲寄生提取物槲寄生碱具有明显的阻断肝癌前病变的作用[4],而肝纤维化已明确是肝癌前病变,因此我们认为槲寄生碱可以阻断肝癌前病变,因而对于肝纤维化也具有很好的治疗效果,为观察其作用及探讨作用机制,我们进行槲寄生碱对肝纤维化发生发展干预作用的研究。
1 材料和方法
1.1 实验动物
实验所需动物由北京维通利华实验动物技术有限公司提供【SCXK(京)2011-0011】。选用6周龄,健康、雄性SD大鼠45只,体重150~165g;动物饲养于首都医科大学实验动物部屏障环境动物实验室【SYXK(京)2010-0020】。
1.2 主要试剂、药物和仪器
DMEM高糖培养基(美国Gibco公司),APES (中杉金桥),DAB(中杉金桥),DMSO(美国Sigma公司),PBS(中杉金桥),SDS(美国Sigma公司),标准胎牛血清(美国 Gibco公司),蛋白预染 Marker (美国Sigma公司),蛋白预染Marker(美国Sigma公司),其他试剂为国产分析纯。中药槲寄生(北京同仁堂),槲寄生碱由北京中医研究所提取。
自动脱水机(LEICA ASP 300),包埋机(LEICA EG 1160),石蜡切片机(LEICA RM2125),图象分析处理系统(Leica Qwin)。电泳装置(美国Bio-Rad公司),电转装置(美国Bio-Rad公司),凝胶成像仪(美国Bio-Rad公司),二氧化碳培养箱(美国Revco公司),超速低温离心机(美国Sigma公司)。
1.3 实验方法
1.3.1 大鼠肝纤维化模型复制及药物干预
雄性SD大鼠45只,自由进食一周后进行实验。动物随机分成三组,分别为正常对照组、模型组、药物干预组。正常对照组不做任何处理,常规饲养,自由饮食、饮水;模型组和药物干预组分别进行腹腔注射40%CCl4-植物油溶液2mL/kg,每周2次,共8周,构建肝纤维化模型。8周末取一只模型组大鼠进行模型复制是否成功的鉴定。第9周开始,药物干预组用槲寄生碱灌胃8g/(kg·d),模型对照组灌等剂量的生理盐水,共8周。
1.3.2 肝脏标本采集
末次给药24 h后,大鼠称重,戊巴比妥钠麻醉,打开腹腔;肉眼观察新鲜肝脏的外形、色泽、质地等大体形态;分别在大鼠肝脏左前叶固定部位,取两块肝组织约(1×1×1)cm3大小,分别固定于10%中性福尔马林溶液和苦味酸固定液,做光镜观察和免疫组化用。
1.3.3 病理切片的的制作及 MASSON染色、HE染色
病理切片的制作:按照常规方法,从动物体内取下新鲜肝脏,置入 Bouin氏液(饱和苦味酸 85 mL,甲醛10 mL,冰醋酸5 mL)中固定24 h后,换成70%酒精,24 h后用LEICA ASP 300自动脱水机进行脱水。完成后用自动包埋机LEICA EG 1160包埋入石蜡并切成5μm厚度的连续切片。
Masson染色:切片脱蜡(烤箱55℃),水化(二甲苯两遍,各15 min,无水乙醇两遍,95%乙醇,80%乙醇各5 min)。放入 Bouin氏液作用一晚(4℃)或37℃烤箱1~2 h,然后流水冲洗切片至黄色消失再进行染色;苏木精浸染3 min,自来水洗3×3 min,氨水(自来水)返蓝3 min,1%盐酸酒精分化1~2 s,大量自来水洗10min(显微镜下观察);丽春红酸性品红染色7 min;蒸馏水冲洗3遍至浮色脱去;1%磷钼酸水溶液处理3 min;不用水洗,直接用1%亮绿液复染7 min;蒸馏水冲洗3遍至浮色脱去;0.2%冰醋酸处理3遍,每遍约5 s;无水乙醇快速脱水(两遍,共2 min),二甲苯透明(两遍,各15 min);中性树胶封片。
HE染色:石蜡切片,37℃烤片2~3 h。脱蜡、蒸馏水洗涤5 min。进行苏木素-伊红染色,用中性树脂,盖玻片封片,置通风柜内晾干。显微镜观察,拍照分析。
免疫组织化学染色:将肝组织切片置于60℃烤箱中烤1 h,然后二甲苯脱蜡透明2次,各10 min,100%乙醇2次,各5 min,90% ~70%乙醇每次3 min;PBS洗3次,每次5min。进行)抗原修复(微波修复),用3%H2O2,室温封闭5~10 min,用PBS洗3次,每次5 min,胎牛血清白蛋白封闭液,室温20 min,加一抗50μL,4度过夜,加二抗,PBS洗涤后,DAB显色5~8 min,镜下控制中止反应。苏木素复染,中性树脂封片,镜检。
1.3.4 Western blot免疫印记实验
Western blot免疫印记分析聚丙烯酰胺凝胶电泳采用40 g/L浓缩胶、120g/L分离胶,上样量30 μg,电压80 V待蛋白跑出浓缩胶后调致100 V,电泳结束后取出凝胶,用夹心方法把滤纸,凝胶,硝酸纤维素薄膜,滤纸依顺序放好,然后用海绵布、筛孔板固定好,插入电转移槽中,并加入电转移缓冲液,保证凝胶在阴极,硝酸纤维素薄膜在阳极方向。放入 Bio-Rad半干电转仪中,15V电压转50 min左右,根据分子量的大小进行调整。用5%奶粉室温封闭3 h以上,孵育结束后,用PBST洗膜液在摇床上剧烈摇动漂洗,3×15 min。分别加入一抗1:1000稀释(用抗体稀释),4℃过夜,孵育结束后,用PBS洗膜液在摇床上剧烈摇动漂洗,3×15 min。二抗1:2000稀释(用抗体稀释),室温孵育1 h,孵育结束后,用PBST洗膜液在摇床上剧烈摇动漂洗,3 ×15 min。加Santa Crus发光试剂,暗室显影并冲洗胶片,用ImageJ对条带进行定量析。测定目的条带的平均吸光度值,并将5次实验结果的平均值作为蛋白含量的相对值。
1.3.5 统计分析
数值以mean±SEM表示,应用SPSS11.5统计软件,采用t检验,P <0.05认为差异有统计学意义。
2 结果
2.1 肝纤维化模型复制及药物干预
2.1.1 肉眼观察结果:正常对照组大鼠肝脏表面光滑,边缘锐利,质地较软,色暗红,有光泽。模型组大鼠肝脏表面较正常组欠光滑,颜色均较正常组浅,边缘钝,质地硬,部分标本表面凹凸不平,呈小结节状,黄褐色。药物干预组大鼠肝脏表面较光滑,颜色较红,无颗粒状结节(封2图1)。
2.1.2 光镜下形态学变化:正常对照组肝小叶和汇管区结构正常,肝细胞呈索状分布,无明显肝细胞坏死,间质无扩增,胶原纤维主要分布于汇管区和中央静脉周围。模型组正常肝小叶结构破坏,肝索排列紊乱,可见肝细胞点状坏死,炎细胞浸润,肝细胞空泡变性散在分布,间质增生明显,胶原纤维构成的纤维间隔形成,其破坏界板,分割、包绕肝小叶,部分动物形成较多完整的假小叶。药物干预组肝小叶结构明显改善,胶原纤维间隔较少,肝细胞坏死、炎性细胞浸润少见,汇管区结缔组织增生不明显,但个别大鼠仍有不完全性假小叶(封2图2、彩插1图3)。
2.2 槲寄生碱对肝纤维化大鼠肝组织瘦素(leptin﹞及瘦素受体(OB-Rb﹞的影响
2.2.1 leptin的表达
正常组肝细胞内无表达,肝窦间隙、汇管区基质及间质细胞内有极少量表达。模型组肝内leptin的表达明显增强,主要见于肝星状细胞中。纤维间隔有弱阳性表达。阳性物质主要集中在胞质内,胞膜上有少量表达。药物治疗组阳性染色程度较模型组明显减轻,主要表达集中在肝星状细胞中(彩插1图4)。
2.2.2 0B-Rb表达
正常肝组织不表达或仅微弱表达于门静脉、小叶中央静脉周围细胞及汇管区的结缔组织,着色浅淡;模型组汇管区周围细胞、门静脉及中央静脉周围细胞和纤维间隔内均见OB-Rb阳性着色细胞,且着色明显增强,主要见于非实质细胞(包括肝星状细胞、窦内皮细胞、枯否细胞等)胞质及胞膜上,部分可定位于胞核;药物治疗组阳性染色程度较模型组明显减轻,主要表达集中在肝星状细胞中(彩插2图5)。
2.3 槲寄生碱对肝纤维化大鼠肝组织 JAK2/STAT3信号转导通路的影响
用Western Blot法检测肝脏组织内 JAK2、STAT3表达情况,两种总蛋白三组之间表达比较均一;检测肝脏组织内P-JAK2、P-STAT3表达情况,正常组蛋白表达量最少,各药物处理组蛋白条带颜色均较浅,模型组条带颜色最深。与正常组比较,模型组P-JAK2、P-STAT3蛋白程度均增高,差异有显著统计学意义(P <0.01);与模型组相比,药物治疗组的P-JAK2、P-STAT3蛋白表达显著降低,差异具有统计学意义(P <0.01)(图6)。
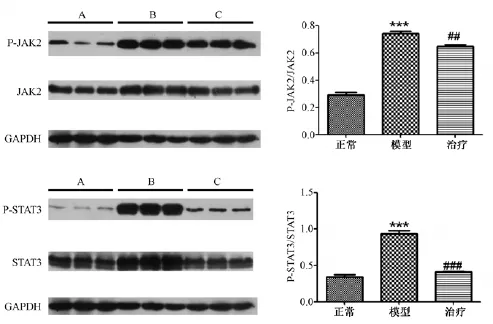
图6 大鼠肝脏组织内JAK2和STAT3Western blot结果Note:A.Normal group,B.Model group,C.Therapeutic group.Data are presented asmean±SEM of three independent experiments.***P<0.01 vs.normal group;###P<0.01 vs.model group.Fig.6 Expression of JAK2/STAT3 protein in liver tissue detected by western blot
3 讨论
肝纤维化发生的机制至今尚未完全清楚。目前认为,肝星状细胞(hepatic stellate cell,HSC)激活、增殖并大量生成ECM的过程是肝纤维化病理机制的中心环节[5]。肝纤维化过程中,启动HSC增殖及使其持续的因素尚未完全阐明。最近有文献[1]报导枯否细胞也与肝纤维化有密切的关系。己知HSC的激活和增殖受多种细胞因子(cytokines,CK)的调控[6-7]。
瘦素(leptin)是新发现的促肝纤维化的细胞因子,大量的临床与实验研究显示,瘦素与肝纤维化的形成之间有着密切联系。在慢性病毒性肝炎、酒精性肝硬化、原发性胆汁性肝硬化等患者中均可见血清瘦素水平明显升高[8]。瘦素与OB-Rb相结合激活HSC内相应的信号分子,在某些转录因子的作用下,转导信号入核,促进相关靶基因的转录和表达,从而进一步活化HSC,使其增殖、并转化为肌样成纤维细胞(myofibrosblast,MFB),合成、分泌大量细胞外基质(ECM)[9]。有研究表明,HSC内瘦素受体后信号转导途径可能涉及到JAK-STAT途径,另外,活化的JAK激酶可激活Ras-Raf-MEK-MAPK、PI3K/AKT等其他信号转导途径。而在肝纤维化中,瘦素的信号转导机制主要与 JAK2[10]与STAT3[11]磷酸化有关,但不完全依赖该通路。
目前推测leptin介导的JAK-STAT信号转导途径可能是:leptin与其受体结合后则可诱导受体形成同源或异源二聚体,吸引非受体型酪氨酸激酶JAK2。JAK2能磷酸化OB-Rb上的酪氨酸位点(即酪氨酸Tyr残基磷酸化,Tyr-P),使OB-Rb上产生了与STAT3结合的区域。STAT3在没有特异性的刺激时定位于胞质内,当细胞受到刺激时,STAT3上的SH2结构域与OB-Rb上被磷酸化的酪氨酸残基结合,同时自身被 JAK2磷酸化。两个磷酸化的STAT3分子可通过Tyr-P和SH2域形成二聚体,结合在靶基因上游的反向重复序列上,启动特定基因的表达、转录并翻译特定蛋白质,迅速提高目的基因的转录效率,活化HSC促进肝纤维化的发展等疾病发生[12],从而发挥leptin的生物学功能。此外有人证明leptin可从其他信号转导途径发挥其生物学功能[13]。
本实验首先通过体内实验探讨瘦素和肝纤维化的关系,免疫组织化学实验结果显示,模型组大鼠瘦素和瘦素受体的表达量明显增高,而且其下游的信号通路JAK2/STAT3蛋白磷酸化的水平明显提高,这说明瘦素确实与肝纤维化密切相关,并且是通过与功能受体结合,从而激活下游JAK2/STAT3信号通路蛋白磷酸化而发挥致纤维化作用的。
我们实验室前期的实验证明槲芪散在治疗肝纤维化,使调节能量代谢的酶类基本维持在正常水平,保护实验性肝损伤,抑制/逆转肝癌前病变方面疗效显著[14],并可干预肝纤维化的发生发展。其君药槲寄生性平、味苦,具有强筋骨、安胎、祛风湿、益血、补肝肾等功能。近年来,槲寄生的抗癌作用受到国内外医药学界的广泛重视[15-16],并且已从多种槲寄生植物中提取到具有抗癌活性的凝集素,毒肽,植物糖蛋白和生物碱。我们前期研究证实,槲寄生碱具有明显阻断肝癌前病变的作用,而肝纤维化已明确是肝癌前病变,因此我们认为槲寄生碱可以阻断肝癌前病变,因而对于肝纤维化也具有很好的治疗效果,为探讨其发生机制,我们进行研究。实验结果显示,槲寄生碱治疗组肝脏大体和光镜下结果都明显好于模型组,治疗组免疫组化和Western Blot结果显示,瘦素,瘦素受体,JAK2/STAT3信号通路蛋白磷酸化水平都较模型组低,这都说明槲寄生碱对肝纤维化有很好的治疗效果,且是通过抑制瘦素,瘦素受体,JAK2/STAT3信号通路蛋白磷酸化这一机制而实现的。
综上所述,CCl4引起肝损伤发生时,触发HSC活化并大量表达瘦素,其后瘦素作用于OB-Rb,激活其JAK-STAT信号转导途径,促进窦内皮细胞等表达TGF-pl,并在其介导下进一步诱导HSC的增殖、活化,进而促进胶原(尤其是I型胶原)等ECM的合成和分泌,如此循环反复,最终促进了肝纤维化的发生、发展。槲寄生碱可有效逆转大鼠肝脏纤维化,其作用机制可能是通过下调大鼠肝组织瘦素、瘦素受体的表达,进而影响JAK2/STAT3信号通路来完成的。槲寄生碱能干预瘦素在肝星状细胞内的信号转导,致肝星状细胞JAK2、STAT3蛋白低表达,这可能是其抗肝纤维化的机制之一。
[1] Reeves HL,Friedman SL.Activation of hepatic stellate cells-a key issue in liver fibrosis[J].Front Biosci,2002,7:808-826.
[2] Wei Zhang,Minghui Niu,Kunfeng Yan,et al.Stat3 pathway correlates with the roles of leptin inmouse liver fibrosis and sterol regulatory element binding protein-1c expression of rat hepatic stellate cells[J].The International Journal of Biochemistry&Cell Biology,2013,45(3):736-744.
[3] 高连印,车念聪,付修文.槲芪散治疗慢性乙型病毒性30例疗效分析[J].北京中医,2001(3):49-50.
[4] 文朝阳,丰平,史争鸣,等.槲寄生总碱和多糖对黄曲霉菌毒素诱发大鼠肝癌前病变时血清同工酶含量的影响[J].中国药理学与毒理学杂志,2009,23(3):201-207.
[5] Juliane S.Troeger,Ingmar Mederacke,Geum–Youn Gwak,et al.Deactivation of Hepatic Stellate Cells During Liver Fibrosis Resolution in Mice[J].Astroenterology,2012,143(4):1073 -1083.
[6] Yan Wang,Juncha Gao,Di Zhang,et al.New insights into the antifibrotic effects of sorafenib on hepatic stellate cells and liver fibrosis[J].Journal of Hepatology,2010,53(1):132-144.
[7] Jiayi He,Jin Gong,Qiang Ding,et al.Suppressive effect of SATB1 on hepatic stellate cell activation and liver fibrosis in rats[J].FEBS Letters,2015,589(12):1359-1368.
[8] Stergios A.Polyzos,Jannis Kountouras,Christos S.Mantzoros.Leptin in nonalcoholic fatty liver disease:A narrative review[J].Journal of Ethnopharmacology,2014,158:230-238.
[9] Aleksandar Sokolovicˊ,Cindy P.A.A.van Roomen,Roelof Ottenhoff,et al.Fasting reduces liver fibrosis in amousemodel for chronic cholangiopathies[J].Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease,2013,1832(10):1482 -1491.
[10] Anna Ptak,Ewa L.Gregoraszczuk.Bisphenol A induces leptin receptor expression,creating more binding sites for leptin,and activates the JAK/Stat,MAPK/ERK and PI3K/Akt signalling pathways in human ovarian cancer cell[J].Toxicology Letters,2012,210(3):332-337.
[11] Nobuhiro Wada,Satoshi Hirako,Fumiko Takenoya, et al.Leptin and its receptors[J].Journal of Chemical Neuroanatomy,2014,61–62:191-199.
[12] Anil Arora,Praveen Sharma.Non-invasive Diagnosis of Fibrosis in Non-alcoholic Fatty Liver Disease[J].Journal of Clinical and Experimental Hepatology,2012,2(2):145-155.
[13] Ki Tae Suk,Dae Yong Kim,Kyoung Min Sohn,et al.Chapter Two-Biomarkers of Liver Fibrosis[J].Advances in Clinical Chemistry,2013,62:33-122.
[14] 王学江,钱英,丰平,等.槲芪散对肝癌前病变血清同功酶影响的研究[J].北京中医药大学学报,2000,23:35-37.
[15] 陈柏年,杨官娥,漆小梅,等.槲寄生抗肿瘤有效成分研究进展[J].中国新药杂志,2005,14(10):1131-1136.
[16] Neeraj K.Saxena, Frank A.Anania.Adipocytokines and hepatic fibrosis[J].Trends in Endocrinology&Metabolism,2015,26(3):153-161.
学术不端行为是指违反学术规范、学术道德的行为,国际上一般用来指捏造数据(fabrication)、窜改数据(falsification)和剽窃(plagiarism)三种行为。但是一稿多投、侵占学术成果、伪造学术履历等行为也可包括进去。学术不端行为在世界各国、各个历史时期都曾经发生过,但是像中国当前这样如此泛滥,严重到被称为学术腐败的地步,却是罕见的。这不仅表现在违反者众多、发生频繁,各个科研机构都时有发现,而且表现在涉及了从院士、教授、副教授、讲师到研究生、本科生的各个层面。由于目前中国缺乏学术规范、学术道德方面的教育,科技工作者在学习、研究过程中发生不端行为,经常是由于对学术规范、学术道德缺乏了解,认识不足造成的。因此,对科技工作者进行学术规范、学术道德教育,防患于未然,是遏制学术腐败、保证中国学术研究能够健康发展的一个重要措施。
早在2007年,中国科协就发布了科技工作者科学道德规范,本刊重温此规范,以期在我刊营造一种健康的学术研究氛围,由于版面限制,我刊陆续将规范全文刊出。
The signal transduction pathway of rats w ith liver fibrosis regulated by leptin and interfering effects ofm istletoe alkali
MENG Xia1,WANG Xue-cong2,FENG Ping2,LU Jing1,WANG Xue-jiang2
(1.Department of experimental animals,Capital Medical University,Beijing 100069,China;
2.Department of pathophysiology,Capital Medical University,Beijing 100069,China)
Objective To investigate the signal transduction pathway mechanisms of rats with liver fibrosis regulated by leptin and interfering effects ofmistletoe alkali.Methods The hepatic fibrosis in ratsmodelwas established by injecting carbon tetrachloride.Forty-five SD ratswere randomly divided into normal group,model group and therapeutic group.All rats except rats in normal group were intraperitoneally injected with 40%carbon tetrachloride in peanut oilwith a dose of 2.0 mL/100g according to the body weight twice a week for 8 weeks.Then,the therapeutic group was givenmistletoe alkali(8g/(kg·d))for 8 weeks via gastrogavage.Rats in normal and model group were served with distilled water at the same time.At the end of the 16th week,blood and tissue specimens were taken from all the rats.The influence ofmistletoe alkalion livermorphology in liver fibrosis ratmodel was reviewed by HE and Masson staining.The effects of mistletoe alkali on the expression of Leptin and its receptor(OB-Rb)in HSC in fibrosis rat model were determined by immunohistochemistry(IH).The expression of JAK2,STAT3 and the activity of phospho-JAK2,phospho -STAT3 were detected by Western blotting analysis.Results The degree of fibrosis of themodel group wasmore severe than the normal group and the treatment group,which suggested thatmistletoe alkali can reverse liver fibrosis in rats.Immunohistochemical staining showed thatmistletoe alkali reduced the hepatic expression of leptin and OB-Rb in ratswith liver fibrosis in comparison with their expression in themodel group.Compared with the normal group,the expression of JAK2 and STAT3 increased in themodel group.However,the expression of JAK2 and STAT3 decreased in themedication groups compared with the model group.Conclusion Mistletoe alkali can effectively ameliorate liver fibrosis in rats possibly through inhibiting hepatic leptin and its receptor expressions,which through inhibiting hepatic leptin and its receptor expressions,thus inhibit the JAK2/STAT3 signaling pathway.
Mistletoe alkali;Liver fibrosis;Hepatic stellate cells;Leptin;OB-Rb;JAK2/STAT3 signaling pathway
R-332
A
1671-7856(2015﹞10-0001-06
10.3969.j.issn.1671.7856.2015.010.001
国家自然科学基金资助项目(81272757);北京市属高等学校创新团队建设与教师职业发展计划项目(IDHT20150502)。
孟霞(1973-),女,主管技师,研究方向:动物实验及实验动物管理,E-mail:mengxia@ccmu.edu.cn。
卢 静(1969-),女,副教授,研究方向:实验动物模型研究,E-mail:lijing@ccmu.edu.cn;王学江(1957-),女,教授,研究方向:病理生理学研究,E-mail:xjwang@ccmu.edu.cn。
﹞2015-08-19

