PARP-2在大鼠心肌肥大中的作用*
周广友,耿 彪,耿 涛,安儒峰,田 芳,刘培庆(泰山医学院附属医院药剂科,山东泰安7000;中山大学药学院药理毒理实验室,广东广州50006)
PARP-2在大鼠心肌肥大中的作用*
周广友1▲,耿彪1▲,耿涛1,安儒峰1,田芳1,刘培庆2△
(1泰山医学院附属医院药剂科,山东泰安271000;2中山大学药学院药理毒理实验室,广东广州510006)
[摘要]目的:在细胞和整体水平研究多聚腺苷酸二磷酸核糖基聚合酶2( PARP-2)在心肌肥大过程中表达的变化规律以及PARP-2对心肌肥大的调控作用。方法:健康雄性SD大鼠采用腹主动脉缩窄法( AAC)建立心肌肥大动物模型,采用real-time PCR和Western blot检测PARP-2的mRNA和蛋白表达变化;使用PARP-2特异性的siRNA干扰序列来处理细胞后,通过检测心肌细胞表面积及ANF、BNP和β-MHC的mRNA表达变化来作为评判心肌细胞肥大状况。结果: AAC大鼠心脏组织中PARP-2的蛋白和mRNA表达均显著上调;在AngⅡ诱导的心肌细胞肥大模型中,AngⅡ能时间和剂量依赖性地上调PARP-2的mRNA和蛋白表达;用siRNA干扰序列沉默PARP-2能够逆转AngⅡ所诱导心肌细胞的肥大。结论:在AngⅡ诱导的心肌细胞肥大的体外模型和腹主动脉缩窄诱导的心肌肥大动物的体内模型中,PARP-2的mRNA和蛋白水平均显著上调;特异性沉默PARP-2能够抑制AngⅡ诱导的心肌细胞肥大。
[关键词]多聚腺苷酸二磷酸核糖基聚合酶2;血管紧张素Ⅱ;腹主动脉缩窄;心肌肥大
▲并列第1作者
早期心肌肥大是心脏对机械负荷及神经体液因子的改变进而维持适当收缩功能的代偿反应[1],但长期应激所导致的持续性病理性心肌肥大可发展为心脏扩大、充血性心力衰竭和猝死,是心功能恶化及心源性死亡的独立危险因素,其发病机制复杂[2-3]。因此,研究心肌肥大的机制及其防治策略具有十分重要的意义。
多聚腺苷酸二磷酸核糖基聚合酶[poly ( ADP-ribose) polymerases,PARP]是真核细胞内具有多聚腺苷酸二磷酸核糖基[poly ( adenosine diphosphate-ribose),PAR]催化活性的蛋白酶,是以烟酰胺腺嘌呤二核苷酸( nicotinamide adenine dinucleotide,NAD)为底物催化合成PAR聚合物,在细胞内进行翻译后修饰,该修饰作用于许多蛋白,涉及到染色体的稳定,DNA损伤修复,基因转录,细胞的增长、死亡和凋亡等方面[4-6]。很多研究表明PARP家族与心血管疾病密切相关,PARP的药理性抑制剂对于很多心血管疾病的动物模型均有明显改善作用。PARP-1是第1个被发现具有PAR修饰活性的蛋白,也是PARP家族中最为典型的成员。PARP-1在心血管疾病中的研究已经相当深入,其抑制剂在心肌肥厚、心肌缺血及再灌注以及动脉粥样硬化等疾病中均有明显作用,一些新型的PARP-1抑制剂已经进入临床试验,主要适应症是恶性肿瘤及严重心血管疾病,并显示出良好的治疗效果[7-9]。
PARP家族的另一重要成员PARP-2与PARP-1具有69%的同源性,晶体结构类似,而且二者是PARP家族目前仅有的能够因DNA的断裂或损伤而诱发其催化活性的成员,但是PARP-2相对于PARP-1仅占了全部酶活性的5%~10%,二者有不同的DNA结合位点和蛋白靶点,决定了其不同的生理功能[10-11]。关于PARP-2在心肌肥大甚至心血管疾病中的作用报道较少,有待进一步研究。
在本研究中,我们检测到在血管紧张素Ⅱ( angiotensinⅡ,AngⅡ)诱导的心肌细胞肥大体外模型和腹主动脉缩窄( abdominal aortic coarctation,AAC)诱导的心肌肥大体内模型中,PARP-2的表达均明显上调。在此基础上,我们通过采用RNA干扰( RNA interference,RNAi)的方法,首次证实了下调PARP-2能够明显逆转AngⅡ所诱导的心肌肥大。上述发现提示了PARP-2与心肌肥大的密切关系,也为进一步研发PARP-2特异性的抑制剂防治心肌肥大等心血管疾病提供了科学依据。
材料和方法
1材料
出生1~2 d的Sprague-Dawley( SD)大鼠购自中山大学动物实验中心,合格证号为0067950。PARP-2抗体和AngⅡ购自Sigma; PARP-2 siRNA(上海吉玛公司) ; Lipofectamine 2000( Invitrogen)。
2方法
2.1乳鼠心肌细胞培养取出生1~2 d乳鼠心脏,用胰酶消化法,即将剪好的心脏小块置于配好的胰蛋白酶溶液中,首先冰上冷消化20 min后,37℃水浴多次消化。将乳鼠左心室消化成单细胞悬液,经过差速贴壁分离后,调节细胞密度种于培养皿中,并在DMEM培养基中避光加入0. 1 mmol/L的BrdU以抑制成纤维细胞生长。置于37℃、5% CO2培养箱中孵育48 h更换无血清培养基,进行后续实验。
2.2大鼠腹主动脉缩窄模型的建立雄性SD大鼠20只,随机分为2组:假手术组( sham组)和手术组( AAC组),每组各10只。首先腹腔注射1%戊巴比妥钠进行麻醉( 40 mg/kg),常规消毒铺巾,沿腹腔正中纵行切口,将腹腔打开,分离腹主动脉,旁置1根6号针,使腹主动脉缩窄达70%~80%。假手术对照组只分离腹主动脉,穿线但不结扎,其它步骤同手术组一致。
2.3大鼠超声心动图检测腹主动脉缩窄手术后8周,对大鼠行超声心动图检测。探头置于大鼠胸骨左侧,取胸骨旁左室长轴和短轴切面。利用二维超声引导M型曲线并进行测量。超声心动检测指标包括左室舒张末期内径( left ventricular internal dimensions at end-diastole,LVIDd)、左室收缩末期内径( left ventricular internal dimensions at end-systole,LVIDs)、舒张末期室间隔厚度( interventricular septal wall dimensions at end-diastole,IVSd)、收缩末期室间隔厚度( interventricular septal wall dimensions at end-systole,IVSs)、舒张末期左室后壁厚度( left ventricular posterior wall dimensions at end-diastole,LVPWd)、收缩末期左室后壁厚度( left ventricular posterior wall dimensions at end-systole,LVPWs)、左室长轴缩短分数( fractional shortening,FS)和射血分数( ejection fraction,EF)。
2.4Real-time PCR实验按照TRIzol说明书步骤提取细胞总RNA,利用紫外分光光度仪测定RNA的浓度和纯度。参照TaKaRa的SYBR Premix EX TaqTM试剂盒说明书进行逆转录反应,采用两步法进行PCR扩增。扩增条件为: 95℃10 s; 95℃5 s,60℃30 s,循环50次; 95℃15 s,60℃1 h; 65℃30 s,循环61次。以PCR反应液作为空白对照,每组样品设置3个复孔,以保证实验数据的有效性和可靠性。所有引物均由英韦创津合成,实验中所用的引物序列见表1。

表1 引物序列Table 1.The sequences of the primer used for real-time PCR
2.5Western blot实验用裂解液提取细胞和组织中的总蛋白,蛋白定量后进行Western blot实验。SDS-PAGE,转膜,将PVDF膜置于5%的BSA封闭液中室温封闭1 h后,TBST洗3次后加入I抗,4℃孵育过夜。用TBST洗膜后加入II抗室温孵育1 h后。加入ECL发光液,曝光、显影、定影。
2.6RNA干扰实验按照Lipofectamine 2000说明书进行。换用OPTI-MEMI培养基后加入A液( 10 μL干扰序列+ 250 μL OPTI-MEMI培养基)和B液( 5 μL Lipofectamine 2000 + 250 μL OPTI-MEMI培养基)充分混匀,加无血清培养基至2 mL,置于培养箱转染48 h后进行后续实验。
3统计学处理
所有数据均以均数±标准差( mean±SD)表示,采用SPSS 13. 0统计软件,以多组间单因素方差分析或t检验作统计学处理。以P<0. 05为差异有统计学意义。
结果
1AngⅡ诱导的体外心肌细胞肥大模型的建立
采用100 nmol/L浓度的AngⅡ分别刺激心肌细胞6 h、12 h、24 h和48 h,检测肥大相关因子心房钠尿因子( atrial natriuretic factor,ANF)、脑钠尿肽( brain natriuretic peptide,BNP)和β-肌球蛋白重链(β-myosin heavy chain,β-MHC) mRNA表达的变化。如图1所示,在AngⅡ作用24 h后,心肌细胞中ANF、BNP和β-MHC的mRNA水平显著增加( P<0. 05),表明100 nmol/L浓度的AngⅡ刺激24 h可成功诱导心肌细胞肥大。
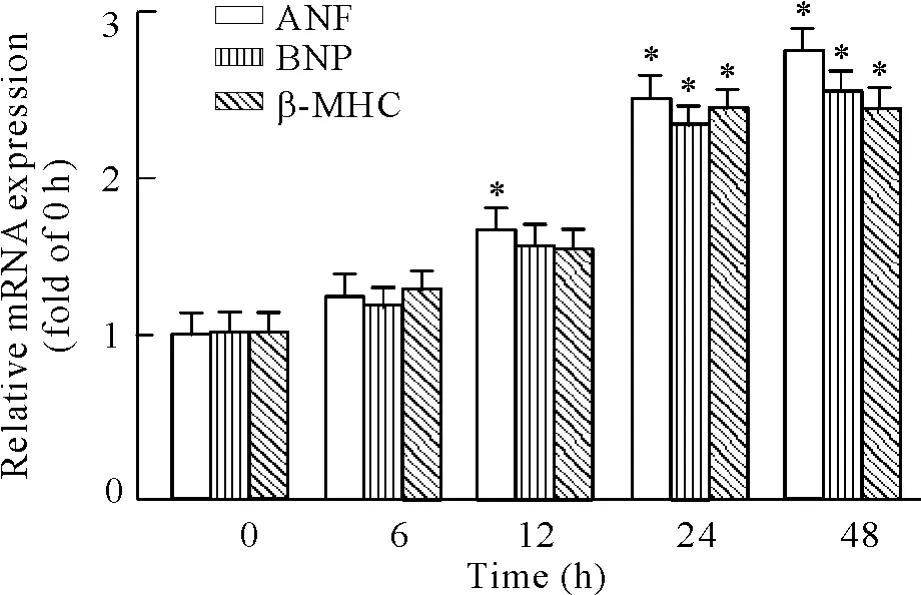
Figure 1.The effects of AngⅡ( 100 nmol/L) on the mRNA expression of ANF,BNP and β-MHC detected by realtime PCR.Mean±SD.n =3.*P<0. 05 vs 0 h.图1 AngⅡ诱导的心肌肥大模型中肥大基因表达的变化
2AngⅡ诱导心肌细胞肥大模型中PARP-2的mRNA和蛋白表达增加
以real-time PCR和Western blot方法分别检测PARP-2的mRNA和蛋白水平变化。如图2所示,不同浓度的AngⅡ( 0、1、10、100和1 000 nmol/L)分别处理24 h后,PARP-2的mRNA和蛋白表达随AngⅡ浓度的增加而明显增加( P<0. 05)。选定100 nmol/ L的AngⅡ分别刺激心肌细胞6 h、12 h、24 h和48 h,检测PARP-2的mRNA和蛋白表达随时间增加而上升( P<0. 05),超过24 h时达到最高。这表明AngⅡ诱导的心肌细胞肥大模型中PARP-2的mRNA和蛋白表达明显增加。
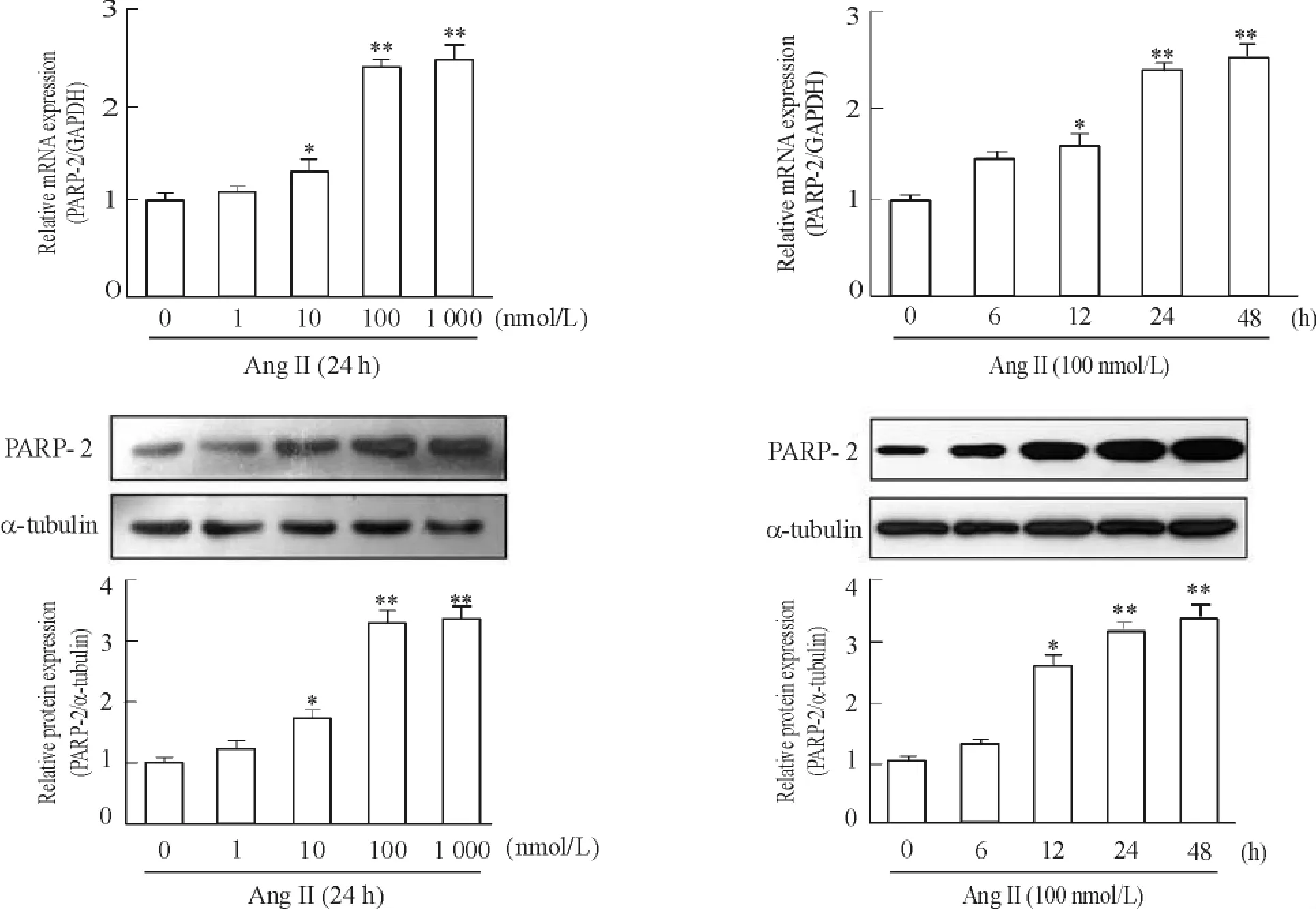
Figure 2.The expression of PARP-2 in neonatal rat cardiomyocytes treated with AngⅡ.Mean±SD.n =3.*P<0. 05,**P<0. 01 vs control ( 0 nmol/L or 0 h).图2 AngⅡ诱导心肌细胞PARP-2 mRNA和蛋白的表达变化
3腹主动脉缩窄致大鼠心肌肥大模型的鉴定
对大鼠实施AAC手术从而建立心肌肥大模型,与假手术组比较,AAC模型组的IVSd、IVSs、LVPWd 及LVPWs等超声心动参数均明显增高( P<0. 05),LVIDs明显下降( P<0. 05),见表2。而且心脏体积明显增大提示AAC模型组大鼠发生明显左室肥厚。
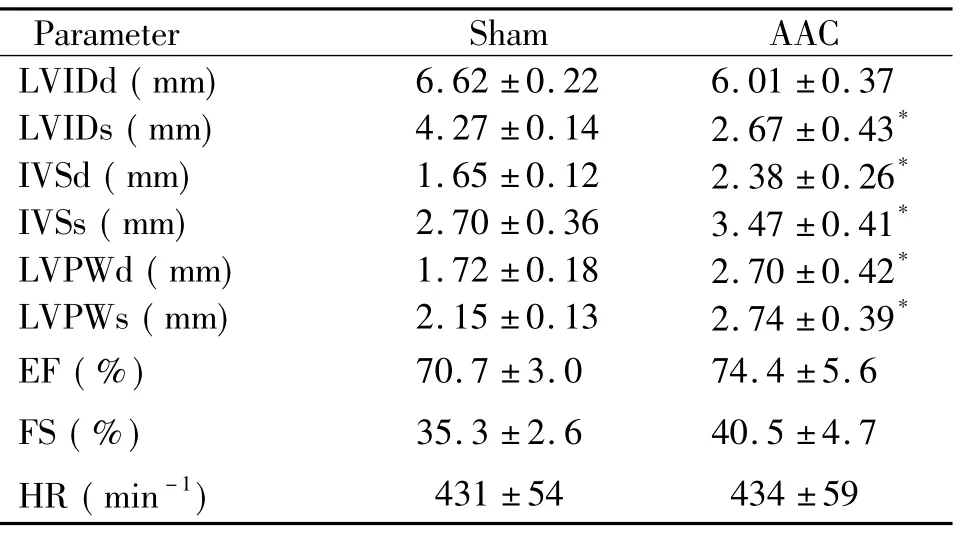
表2 各组大鼠超声心动学参数Table 2.Echocardiographic parameters of sham and AAC rats ( Mean±SD.n =8)
将病理切片进行HE染色,检测肥大相关因子ANF、BNP和β-MHC的mRNA水平,与对照组相比均上升6~10倍,表明AAC术后大鼠心脏呈现典型的向心性肥厚,动物模型建立成功,见图3。
4心肌肥大动物模型中PARP-2蛋白和mRNA的表达增加明显
为明确PARP-2在心肌肥大动物模型中的变化情况,本实验分别采用Western blot和real-time PCR法检测PARP-2的蛋白表达和mRNA表达的变化,与假手术组比较,AAC模型的大鼠心脏中PARP-2的mRNA和蛋白的表达量显著增加,见图4。
5沉默PARP-2对心肌细胞肥大的影响
心肌细胞进行转染48 h之后,分别采用realtime PCR和Western blot检测PARP-2 mRNA和蛋白表达的变化。通过与正常对照( control,Con)组和阴性对照( negative control,Neg)组相比,si003干扰效率最高,达到80%以上,PARP-2的mRNA水平和蛋白水平均显著下降,PARP-1蛋白表达无明显变化,见图5,表明干扰序列可特异性地沉默PARP-2。
利用si003序列对PARP-2进行沉默,然后分别通过real-time PCR和激光共聚焦显微镜来观察ANF、BNP和β-MHC的mRNA水平变化和心肌细胞表面积的变化。AngⅡ组和阴性对照组与空白对照组相比较心肌细胞表面积均明显增加( P<0. 05),但是si003组与AngⅡ组相比心肌细胞表面积均明显减小( P<0. 05)。此外,AngⅡ组相对于空白对照组ANF、BNP和β-MHC的mRNA水平显著升高( P<0. 05),但是si003组与AngⅡ组相比ANF、BNP和β-MHC的mRNA水平显著下降( P<0. 05),与空白对照组水平一致,见图5。这表明PARP-2基因沉默能够逆转AngⅡ所诱导的心肌细胞肥大。
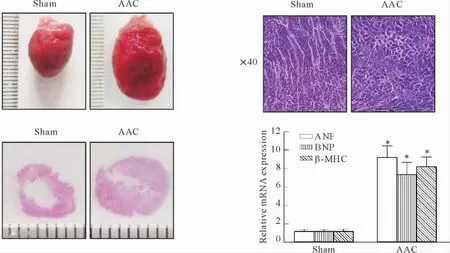
Figure 3.A rat model of cardiac hypertrophy induced by abdominal aortic constriction ( AAC).Mean±SD.n = 8.*P<0. 05 vs sham.图3 腹主动脉缩窄诱导大鼠心肌肥大模型的建立
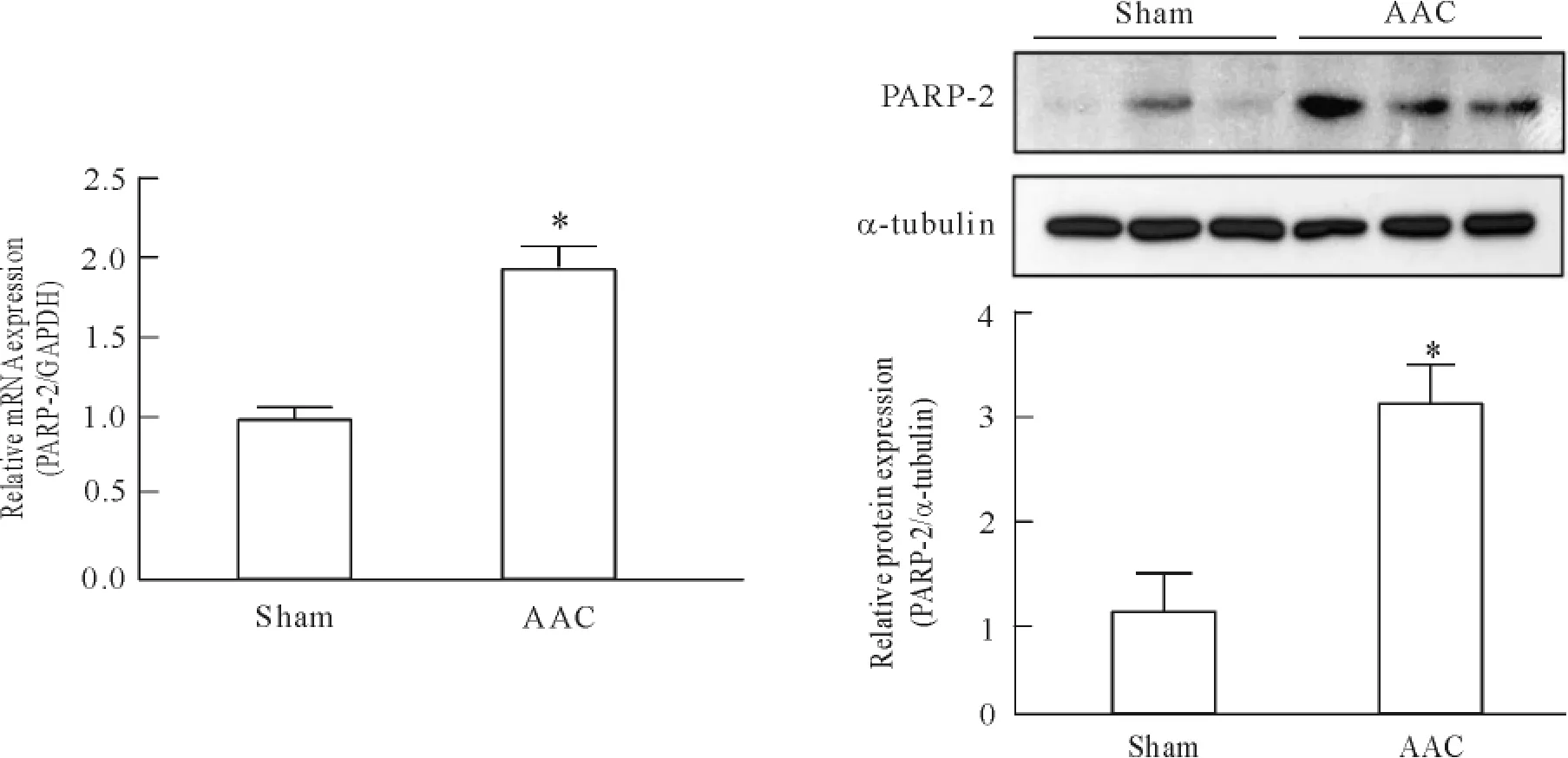
Figure 4.PARP-2 mRNA and protein expression was up-regulated in abdominal aortic constriction rats.Mean±SD.n =8.*P<0. 05 vs sham.图4 AAC模型中PARP-2蛋白和mRNA表达的变化
讨论
本研究中,我们首次发现在AngII诱导的体外和AAC诱导的体内心肌肥大的模型中,PARP-2的蛋白和mRNA水平均有明显上升,且沉默PARP-2可以有效逆转AngⅡ所诱导的心肌肥大,这些研究结果为利用PARP-2特异性抑制剂来治疗和预防心肌肥大提供了初步的实验依据,并为我们后续研究PARP-2介导心肌肥大的下游分子通路提供实验基础。
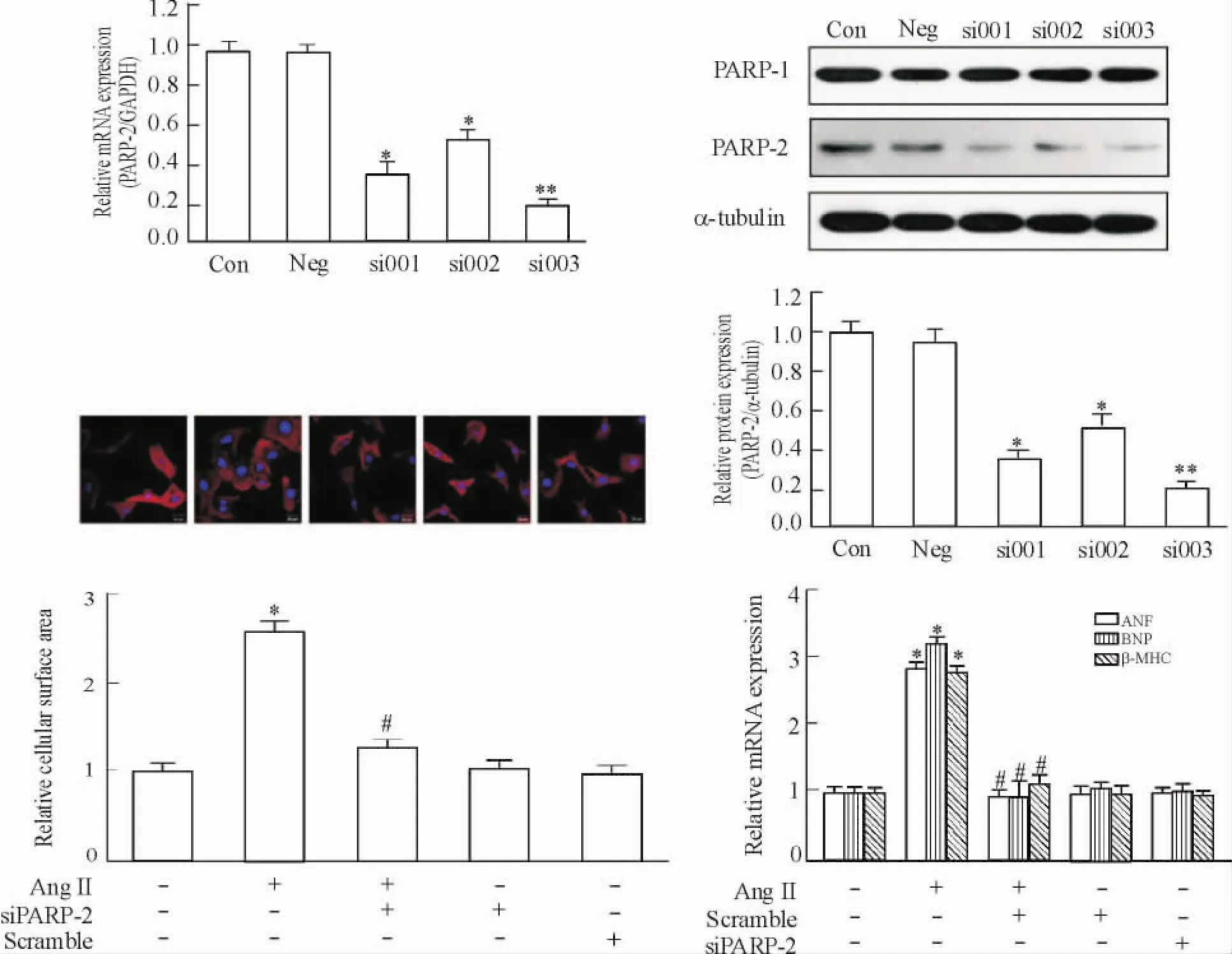
Figure 5.PARP-2 knockdown blocked the hypertrophic responses induced by AngⅡ.Mean±SD.n =3.*P<0. 05,**P<0. 01 vs Con;#P<0. 05 vs AngⅡ.图5 沉默PARP-2后能够逆转AngⅡ所诱导的心肌细胞肥大
PARP家族重要成员之一的PARP-1与心血管疾病是关系密切,其抑制剂在心肌肥厚、心肌缺血及再灌注、动脉粥样硬化等疾病中均有明显作用,为临床上开发其新型的抑制剂来治疗心肌肥大等心血管疾病提供了证据。然而我们也知道PARP-1作为PARP家族最重要成员,其酶活性达到了整个家族的90% ~95%左右,在染色体的稳定,DNA损伤修复,基因转录,细胞的增长、死亡和凋亡等方面都有十分重要的生理作用[12],因此单方面地将其完全抑制,所产生的副作用和不利方面也是不言而喻的。我们所研究的PARP-2在人体内大量存在于骨骼肌、中枢神经系统、心脏、肝脏、胰腺等组织器官中,其与PARP-1具有69%的同源性,而且晶体结构类似,可以相互作用,功能上互补,但不完全重合[10]。此外二者不同的DNA结合位点和蛋白靶点,决定了二者不同的生理功能。近年来,关于PARP-2特殊的生理功能越来越得到人们的广泛关注。我们实验结果中主要通过“功能缺失”( RNA干扰)的方法,阐明了PARP-2缺失可以有效逆转AngⅡ所诱导的心肌肥大。由于PARP-2的酶活性只占了该家族酶活性的5%~10%,不会影响PARP家族正常的生理活性,因此开发特异性的PARP-2抑制剂对临床治疗心肌肥大有十分重要的意义。
目前对于新型的PARP-2选择性抑制剂的研发得到人们的广泛关注[12]。Moroni等[13]研究表明选择性的PARP-2抑制剂UPF1069可以增加海马切片中的细胞凋亡,但是可以保护缺血性脑损伤模型中的皮质细胞。因此UPF1069可以作为十分有用的工具开发PARP-2新的生物学功能,也可以用来区分其与PARP家族其它成员在细胞生长与凋亡等机制中的不同。越来越多的人们意识到PARP-2蛋白在DNA损伤修复、基因组的稳定以及炎症方面的特殊作用以及PARP-2所参与的特定的分子信号途径,为临床研发其抑制剂提供了有力证据以及治疗疾病的新的靶点。
我们的结果也同样表明,用siRNA干扰序列特异性沉默PARP-2后能够有效逆转AngⅡ所诱导的心肌肥大,对开发选择性的PARP-2抑制剂用于临床治疗心肌肥大提供一定的科学依据。
[参考文献]
[1]Frey N,Katus HA,Olson EN,et al.Hypertrophy of the heart: a new therapeutic target?[J].Circulation,2004,109( 13) : 1580-1589.
[2]邹剑,周后先,先志伟,等.激活PPARα表达对AngII诱导的心肌肥大及核因子NFATc4/p65-NFκB相互作用的影响[J].中国病理生理杂志,2014,30( 6) : 1017-1022.
[3]李瑞芳,乐康,高洁,等.抑制PPARα表达对ET-1诱导的心肌肥大和PI3K/Akt/GSK3β-NFATc4通路的影响[J].中国病理生理杂志,2009,25( 12) : 2289-2294.
[4]Yélamos J,Schreiber V,Dantzer F.Toward specific functions of poly( ADP-ribose) polymerase-2[J].Trends Mol Med,2008,14( 4) : 169-178.
[5]Ying W,Garnier P,Swanson RA.NAD+repletion prevents PARP-1-induced glycolytic blockade and cell death in cultured mouse astrocytes[J].Biochem Biophys Res Commun,2003,308( 4) : 809-813.
[6]Schreiber V,Dantzer F,Ame JC,et al.Poly( ADP-ribose) : novel functions for an old molecule[J].Nat Rev Mol Cell Biol,2006,7( 7) : 517-528.
[7]Pacher P,Szabó C.Role of poly( ADP-ribose) polymerase 1 ( PARP-1) in cardiovascular diseases: the therapeutic potential of PARP inhibitors[J].Cardiovasc Drug Rev,2007,25( 3) : 235-260.
[8]Bartha E,Solti I,Kereskai L,et al.PARP inhibition delays transition of hypertensive cardiopathy to heart failure in spontaneously hypertensive rats[J].Cardiovasc Res,2009,83( 3) : 501-510.
[9]Pillai JB,Gupta M,Rajamohan SB,et al.Poly( ADP-ribose) polymerase-1-deficient mice are protected from angiotensin II-induced cardiac hypertrophy[J].Am J Physiol Heart Circ Phy-siol,2006,291( 4) : H1545-H1553.
[10]Oliver AW,Amé JC,Roe SM,et al.Crystal structure of the catalytic fragment of murine poly( ADP-ribose) polymerase-2[J].Nucleic Acids Res,2004,32 ( 2) : 456-464.
[11]Schreiber V,Amé JC,Dollé P,et al.Poly( ADP-ribose) polymerase-2 ( PARP-2) is required for efficient base excision DNA repair in association with PARP-1 and XRCC1 [J].J Biol Chem,2002,277( 25) : 23028-23036.
[12]Bartha E,Kiss GN,Kalman E,et al.Effect of L-2286,a poly( ADP-ribose) polymerase inhibitor and enalapril on myocardial remodeling and heart failure[J].J Cardiovasc Pharmacol,2008,52( 3) : 253-261.
[13]Moroni F,Formentini L,Gerace E,et al.Selective PARP-2 inhibitors increase apoptosis in hippocampal slices but protect cortical cells in models of post-ischaemic brain damage[J].Br J Pharmacol,2009,157( 5) : 854-862.
Role of PARP-2 in cardiac hypertrophy in rats
ZHOU Guang-you1,GENG Biao1,GENG Tao1,AN Ru-feng1,TIAN Fang1,LIU Peiqing2
(1Department of Pharmacy,Affiliated Hospital of Taishan Medical University,Taian 271000,China;2Department of Pharmacology and Toxicology,School of Pharmaceutical Sciences,Sun Yat-sen University,Guangzhou 510006,China.E-mail: liupei_qing1964@163.com)
[ABSTRACT]AIM: To investigate the expression of poly( ADP-ribose) polymerase-2 ( PARP-2) during rat cardiac hypertrophy in vitro and in vivo,and to explore the effects of PARP-2 on the cardiac hypertrophy.METHODS: Abdominal aortic coarctation ( AAC) was performed to establish a model of pressure overload-induced cardiac hypertrophy in SD rats.The expression of PARP-2 at mRNA and protein levels in the myocardium was determined by real-time PCR and Western blot.The hypertrophy model of the cardiomyocytes was induced by treating the cells with angiotensinⅡ( AngⅡ).PARP-2 was knocked down by siRNAs in neonatal rat cardiomyocytes and the cardiomyocyte hypertrophy was evaluated by measuring the mRNA levels of ANF,BNP,and β-MHC and the cellular surface area.RESULTS: The expression of PARP-2 at mRNA and protein levels was both increased in the AAC rats as compared with those in the sham animals.The expression of PARP-2 at mRNA and protein levels was also increased in a time-and concentration-dependent manner in AngⅡ-induced hypertrophy model of the cardiomyocytes.In the neonatal rat cardiomyocytes,knockdown of PARP-2 expression by siRNA attenuated AngⅡ-induced cardiac hypertrophy of the cardiomyocytes,indicating that endogenous PARP-2 played a positive regulatory role in cardiac hypertrophy.CONCLUSION: The mRNA and protein levels of PARP-2 increase in the in vitro and in vivo models of cardiac hypertrophy.Knockdown of PARP-2 protects cardiomyocytes from hypertrophy.
[KEY WORDS]Poly( ADP-ribose) polymerase-2; AngiotensinⅡ; Abdominal aortic coarctation; Cardiac hypertrophy
通讯作者△Tel: 020-39943116; E-mail: liupei_qing1964@163.com
*[基金项目]国家自然科学基金资助项目( No.81072641; No.81273499)
[收稿日期]2015-01-23[修回日期]2015-04-13
[文章编号]1000-4718( 2015)07-1153-07
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.001

