胸腺素α原在正常组织与肿瘤组织中的定位研究
崔若辰,蔡报伟,苏劲红,胡鑫炎,孙雨涵,郭 权,周克夫
(厦门大学环境与生态学院,福建厦门361102)
胸腺素α原在正常组织与肿瘤组织中的定位研究
崔若辰,蔡报伟,苏劲红,胡鑫炎,孙雨涵,郭 权,周克夫*
(厦门大学环境与生态学院,福建厦门361102)
检测并分析胸腺素α原(prothymosinα,Pro Tα)在小鼠正常肝组织与肝肿瘤组织中表达、分布的情况.取20只昆明雄性小鼠随机分为对照组和移植性肝癌模型组,每组10只,模型组接种H22肝癌组织,建立移植性肝癌模型.7 d后将模型组肝癌组织和对照组正常肝的组织取出,部分组织按常规石蜡包埋方法制片,免疫组织化学法分别检测肝癌组织与正常肝组织中Pro Tα的表达分布情况;部分组织按提取胞质蛋白的方法获得蛋白用于Western-blot分析.在Westernblot中,Pro Tα在肝癌组织细胞质的表达量明显低于正常肝组织;在免疫组织化学法中,正常肝组织的细胞核呈阴性,胞质呈强阳性;而在肝癌组织中胞核呈强阳性,胞质呈弱阳性.Pro Tα在正常组织与肿瘤组织中的表达分布有明显差异.由于在Western-blot中所提的蛋白主要为胞质蛋白,在癌变的组织中,Pro Tα主要集中在细胞核中,因此推测,当胞质中的Pro Tα大量表达时对于肝细胞稳定、抑制细胞发生癌变有重要功能,此结果为进一步研究Pro Tα在肿瘤发生和诊断中的作用提供了重要的理论依据.
胸腺素α原;H22细胞株;肝癌;定位
原发性肝癌(primary hepatic cancer)简称肝癌,是肝脏的恶性肿瘤,也是世界十大恶性肿瘤之一[1].肝癌起病比较隐匿,早期症状不明显,中期甚至部分晚期患者症状仍不明显,一旦出现比较典型的症状,到医院就诊已多属晚期,错过最佳治疗时期.根据最新统计[2],全世界每年新发肝癌患者约78万,居恶性肿瘤的第五位,因此,揭示肝肿瘤的癌变机理以及早期诊断是目前医学研究的热点.
胸腺素α原(prothymosinα,Pro Tα)是一种天然无二级结构、强酸性小分子蛋白,其功能与细胞免疫调节、细胞增殖[3]、凋亡有着密切关系.作为一种典型的肿瘤相关蛋白,在细胞增殖和凋亡调控方面的深入研究有助于发现细胞癌变的发生机理,曾在多种癌症中检测到了Pro Tα水平的升高[4];这种在癌细胞中高水平的Pro Tα蛋白产物不仅维持细胞处于高度增殖状态,还保护细胞避免进入凋亡途径.体外实验,在凋亡过程中,Pro Tα被caspase-3切割而发生断裂[5],导致核定位信号遭到破坏,进而使断裂的ProTα从细胞核转移到胞质和胞外,由于Pro Tα不能在核内积聚而削弱了其核内与增殖相关的功能,这种现象并不见于正常细胞;而且,胞核和胞质定位的Pro Tα衍生物对肿瘤坏死因子诱导的Hela细胞凋亡[6]均有抵抗作用,所以,研究Pro Tα在癌变过程中的定位有助于揭示细胞癌变的发生机理.目前国内外有关移植性肝癌和正常肝组织中Pro Tα水平和定位的研究还未见报道.我们应用本课题组克隆表达的重组人Pro Tα[7]制备了多克隆抗体[8],采用Western-blot和免疫组织化学的方法对小鼠正常肝组织和肿瘤组织中的Pro Tα进行了分析,其结果将对研究Pro Tα在肿瘤发生和治疗中的作用以及肿瘤临床医学的诊断预测有重要价值.
1 材料与方法
1.1 材 料
实验动物:SPF级昆明小鼠20只,雄性,质量22~30 g,6~8周龄,购自厦门大学实验动物中心,置于温度20℃左右,湿度65%左右的室内,以普通小鼠饲料喂养.

肝癌细胞株:小鼠H22腹水型肝癌细胞株由厦门大学实验动物中心提供,SPF级昆明小鼠传代.
主要试剂:大鼠抗Pro Tα多克隆抗体均由本实验室制备;辣根过氧化物酶(HRP)标记的山羊抗大鼠IgG抗体购自美国联科生物产品,UltraSensitiveTMSP试剂盒、DAB试剂盒购自福州迈新公司.
1.2 方 法
1.2.1 H22实体瘤荷瘤小鼠和移植性肝癌模型制备
无菌条件下将H22腹水肿瘤按1∶8稀释计数,然后调整浓度为3×107m L ̄1,以100μL/只接种,其细胞数为3×106个/只,接于小鼠的前肢腋下,观察生长情况.当肿瘤长至0.5 cm时,无菌条件下取出肿瘤组织.将组织切细后用手术方法将组织移植到小鼠肝组织中,伤口用医用生物胶封闭.肿瘤小鼠模型养至7 d,取肿瘤小鼠与正常小鼠的新鲜肝组织用多聚甲醛固定24 h(4℃).
1.2.2 Western-blot检测ProTα的表达水平
按文献[9]提取胞质蛋白的方法提取正常肝组织与肝癌组织细胞中的胞质.提取蛋白后移至离心管,1× 104r/min低温离心15 min,取上清液用蛋白试剂盒进行浓度测定并平衡,加4×Loading Buffer煮样10 min进行聚丙烯酰胺凝胶电泳(SDS-PAGE),再电转至聚偏二氟乙烯膜(PVDF)上,洗膜3次(每次5 min)后用5%(质量分数)脱脂奶粉封闭1 h,加大鼠抗ProTα抗体(1∶1 000稀释)4℃过夜,洗膜3次(每次5 min)后,加HRP标记的山羊抗大鼠IgG(1∶2 000稀释)常温孵育1 h,洗膜3次(每次5 min,若背景过高,可每次洗5~10 min)后加二氨基联苯胺(DAB)显色剂进行显色,β微管蛋白(β-Tubulin)作参照,检测ProTα的表达量.
1.2.3 免疫组织化学法检测ProTα的表达分布
将存于多聚甲醛中的正常组织与肝癌组织固定24 h后取出,梯度脱水透明后进行包埋、切片、贴片、烤片;将制成的石蜡切片在60℃烘箱烘烤1 h,梯度透明及复水;利用抗原修复液进行抗原修复并洗片,加UltraSensitiveTMSP试剂盒中A试剂(内源性过氧化物酶阻断剂)10 min后洗片,再加B试剂(正常动物非免疫血清)10 min后洗片,最后加入大鼠抗Pro Tα多克隆抗体(1∶1 000稀释)4℃过夜,阴性对照组用磷酸盐缓冲液代替一抗;次日,洗片后依次加C试剂(生物素标记的第二抗体)、D试剂(链霉菌抗生物素-过氧化物酶)各10 min并洗片后就可以进行染色;用新制备好的DAB试剂进行显色,苏木精复染,梯度脱水及透明后,用中性树脂进行封片.
1.2.4 HE染色法检测肝组织的形态结构
取肝组织切片经二甲苯脱蜡、梯度酒精复水后,用苏木精染色4 min,盐酸酒精分色30 s,伊红染色2 min,再一次进行酒精脱水,二甲苯透明,中性树胶封片晾干并置于显微镜上进行观察拍照.
2 结 果
2.1 Western-blot法检测结果
Western-blot实验结果显示,Pro Tα在正常肝细胞质中的表达量高(图1(a)),而在肝癌细胞质中几乎无表达(图1(b)).
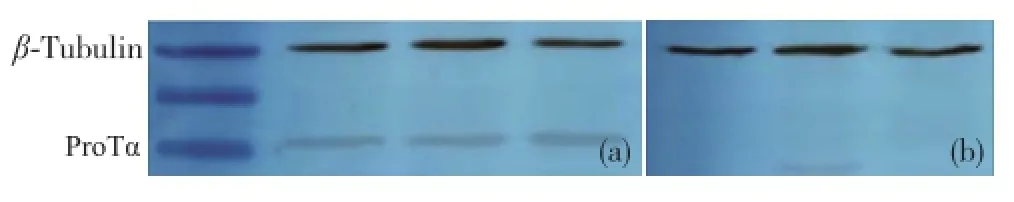
图1 Pro Tα在正常肝细胞质(a)和肝癌细胞质(b)中的表达水平(Western-blot)Fig.1 The expression level of ProTαin normal liver(a)and hepatocellular carcinoma tissues(b)by Western-blot
2.2 免疫组织化学法检测结果
免疫组织化学结果如图2所示,在正常肝组织中,Pro Tα蛋白的表达主要位于肝细胞的胞质(图2(a)中白色箭头),强阳性表达为清晰的棕黄色颗粒,而胞核则为阴性,为苏木精着色(图2(a)中黑色箭头).正常肝组织的HE染色显示胞质和胞核的位置(图2(b)),胞核大小适中,肝索清晰,同时证明在免疫组织化学中显示阳性部位在胞质而不是胞核;但在肝癌组织中,从HE染色可以看出,癌细胞的细胞核所占细胞比例大,胞质比例明显减少,肝索紊乱(图2(e)黑色箭头为胞核,白色箭头为胞质).免疫组织化学结果显示,肝癌组织中的细胞核显示强棕色反应,胞质也有部分棕色反应,但与胞核相比明显弱(图2(c),黑色箭头为强阳性胞核,白色箭头为弱阳性胞质);而阴性对照组(图2(d))细胞核并未着色,为苏木精复染的蓝色,胞质比例小,并且免疫组织化学也未见明显棕色反应.免疫组织化学结果与Westernblot结果一致.
3 讨 论
研究显示,与正常组织对照,一些癌组织中有高水平的Pro Tα表达.Pro Tα作为肝癌[10]、肺癌[11]和神经母细胞瘤[]的标志物用以判断预后.免疫组织化学研究显示,Pro Tα在高分化甲状腺乳头状和滤泡状癌的表达量明显高于滤泡性腺瘤、甲状腺肿和正常组织[13].Pro Tα作为一种核蛋白[]在细胞中的定位及其表达量具有重要的理论和实践意义,研究表明此蛋白具有一定的可扩散性,是一种穿梭蛋白[15].本实验采用移植性肝癌作为正常细胞转变为肝癌细胞模型,应用Western-blot法及免疫组织化学法对Pro Tα在小鼠正常肝组织与肝癌组织中的表达、分布情况进行了测定.Western-blot结果显示,当肝组织正常时,Pro Tα分布在胞质中(图2(a)),而当肝组织转变为肝癌细胞时,胞质中的Pro Tα迅速减少(图2(c));进一步的免疫组织化学定位结果显示,免疫组织化学强阳性结果在正常肝组织中主要存在于胞质中而胞核中较少(图2(b)),相反,当细胞癌变后,强阳性结果却主要集中到细胞核中(图2(e)).两种方法检测结果高度一致,与文献[15]结果相符.以上实验证明,在正常肝细胞中Pro Tα主要分布在胞质,当细胞发生癌变之后,肝癌细胞核中Pro Tα的水平明显升高.此外由正常肝细胞质中Pro Tα高表达可以推测,该蛋白对稳定细胞防止癌变有重要作用,相关机理有待进一步研究.本结果目前只在动物肿瘤中发现,如果应用于人的相应肿瘤进行验证,证明结果一致,将有利于临床肿瘤的诊断和预后,并为其提供科学依据.

图2 免疫组织化学法观察Pro Tα在肝组织中的表达水平(×40)Fig.2 The expression level of Pro Tαin liver homogenate by immunohistochemical method(×40)
[1] Ferlay J,Shin H R,Bray F,et al.Estimates of worldwide burden of cancer in 2008:Globocan 2008[J].International Journal of Cancer,2010,127(12):2893-2917.
[2] Parkin D M,Bray F,Ferlay J,et al.Estimating the world cancer burden:Globocan 2000[J].International Journal of Cancer,2001,94(2):153-156.
[3] Piñeiro A,Cordero O J,Nogueira M.Fifteen years of prothymosin alpha:contradictory past and new horizons[J]. Peptides,2000,21(9):1433-1446.
[4] 刘从容,杨京平,王玉平,等.胸腺素β10在人类乳腺癌中的表达[J].中国肿瘤临床,2004,31(9):481-484.
[5] Enkemann S A,Wang R H,Trumbore M W,et al.Functional discontinuities in prothymosinαcaused by caspase cleavage in apoptotic cells[J].Journal of Cellular Physiology,2000,182(2):256-268.
[6] Shiau A L,Chu C Y,Su W C,et al.Vaccination with the glycoprotein D gene of pseudorabies virus delivered by nonpathogenic Escherichia coli elicits protective immune responses[J].Vaccine,2001,19(23):3277-3284.
[7] 李俊燕,周克夫.胸腺素α原基因的克隆及在大肠杆菌中的融合表达[J].厦门大学学报:自然科学版,2006,45(5):722-725.
[8] 周克夫,杨彩霞,韩伟.抗胸腺素α原多克隆抗体及其制备方法与应用:中国,201110200674.2[P].2011-07-18[2014-09-22].
[9] 罗彦彦,林有坤,黄翠丽,等.肝细胞浆蛋白诱导系统性红斑狼疮兔模型的实验研究[J].免疫学杂志,2011,27(8):710-714.
[10] Wu C G,Habib N A,Mitry R R,et al.Overexpression of hepatic prothymosin alpha,a novel marker for human hepatocellular carcinoma[J].British Journal of Cancer,1997,76(9):1199-1204.
[11] Sasaki H,Nonaka M,Fujii Y,et al.Expression of the prothymosin-αgene as a prognostic factor in lung cancer[J].Surgery Today,2001,31(10):936-938.
[12] Sasaki H,Sato Y,Kondo S,et al.Expression of the prothymosinαm RNA correlated with that of N-myc in neuroblastoma[J].Cancer Letters,2001,168(2):191-195.
[13] Shiwa M,Nishimura Y,Wakatabe R,et al.Rapid discovery and identification of a tissue-specific tumor biomarker from 39 human cancer cell lines using the SELDI ProteinChip platform[J].Biochemical and Biophysical Research Communications,2003,309(1):18-25.
[14] Letsas K P,Frangou-Lazaridis M,Skyrlas A,et al.Transcription factor-mediated proliferation and apoptosis in benign and malignant thyroid lesions[J].Pathology International,2005,55(11):694-702.
[15] Enkemann S A,Ward R D,Berger S L.Mobility within the nucleus and neighboring cytosol is a key feature of prothymosin-α[J].Journal of Histochemistry&Cytochemistry,2000,48(10):1341-1355.
Study on the Localization of Prothymosinαin Normal and Tumor Tissues
CUI Ruo-chen,CAI Bao-wei,SU Jin-hong,HU Xin-yan,SUN Yu-han,GUO Quan,ZHOU Ke-fu*
(College of the Environment&Ecology,Xiamen University,Xiamen 361102,China)
To study and analyze the expression and distribution of prothymosinα(Pro Tα)in normal and tumor cells of mice,twenty male Kunming mice were randomly divided into normal group and model group.Mice in the model group were inoculated with H22(Hepatoma 22)tumor cell.After 7 days,part of livers of the normal and hepatocellular carcinoma tissues were extracted to make slices for immunohistochemistry test and HE staining of ProTα,while part of tissues were homogenized,and cell lysates were extracted for Western-blot to test the expression level of Pro Tαin normal liver and hepatocellular carcinoma tissues.The results showed that the expression level of Pro Tαin the cytoplasm of normal liver cell was significantly higher than that of hepatocellular carcinoma tissue.Immunohistochemistry showed the strong positive reaction in the cytoplasm of normal tissue,and negative in the nuclei.On the contrary,hepatocellular carcinoma tissue showed strong positive immunoreactivity in the nuclei,but weak positive response in cytoplasm.The results indicated that the distribution of Pro Tαin the normal and tumor tissues was changeable and nuclei translocation of Pro Tαgradually took place during the occurrence and development of hepatocellular carcinoma.These results laid the foundation for the mechanism study of ProTαin tumor occurrence,and would be beneficial to develop diagnosis method of cancer.
prothymosinα;H22cells;hepatocellular carcinoma;localization
R 73
A
0438-0479(2015)04-0474-04
10.6043/j.issn.0438-0479.2015.04.006
2014-09-22 录用日期:2015-02-11
福建省自然科学基金(2013J01383)
*通信作者:zhkefu@xmu.edu.cn
崔若辰,蔡报伟,苏劲红,等.胸腺素α原在正常组织与肿瘤组织中的定位研究[J].厦门大学学报:自然科学版,2015,54(4):474-477.
:Cui Ruochen,Cai Baowei,Su Jinhong,et al.Study on the localization of prothymosinαin normal and tumor tissues[J]. Journal of Xiamen University:Natural Science,2015,54(4):474-477.(in Chinese)

