细柱五加多糖的提取工艺优选
刘欣欣 王中彦
(沈阳药科大学,辽宁 沈阳 110016)
细柱五加(Acanthopanax gracilistylus W. W. Smith)为五加科(Araliaceae)五加属植物,在我国,主要分布于湖南、湖北等地,多以根皮入药,是常用于祛风湿和强壮筋骨的传统中药。主要用于治疗风湿痹病,筋骨萎软、小儿行迟,体虚乏力等症[1]。
多糖是指由10个或10个以上单糖聚合而成的一类生物大分子。研究发现多糖不仅具有抗癌、抗炎、抗病毒、抗衰老等多方面药理活性[2],而且对物理的、化学的及生物来源的多种活性氧簇(ROS)具有良好的清除作用,能抑制UV所导致的脂质过氧化、减少脂质过氧化产物丙二醛(MDA)的生成,抑制体外H2O2诱导的红细胞溶血[3-9],增加超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px )活性等[10],使多糖具有较好的抗氧化活性,而抗氧化作用是一些多糖抗衰老、抑肿瘤、降血脂、降血糖的作用机制之一[11],近年来国内外已将抗氧化检测用于抗衰老等保健食品的评价[12-13]。加之多糖本身低毒、来源广泛,已成为近年来的研究热点。
采用正交试验来确定细柱五加多糖超声提取的最佳工艺,以期为细柱五加多糖药物及功能性食品的开发提供理论依据。
1 仪器与试剂
1.1 材料:细柱五加(Eleutherococcus nodiflorus(Dunn)S. Y.Hu )购于江苏省盱眙中药饮片厂。
1.2 试剂:D-无水葡萄糖(中国药品生物制品检定所,供含量测定用)。浓硫酸、铝片、苯酚、95%乙醇等所用试剂均为分析纯。
UV-1700型分光光度计(日本岛津公司);R-210型旋转蒸发仪(瑞士BüCHI公司);KQ-500DE 医用数控超声波清洗器 (昆山超声仪器有限公司);FSD-100型电动粉碎机(杭州托普仪器有限公司);DSY-1-4孔电热恒温水浴锅(北京爱琦霞商贸有限公司);SHZ-D循环水式真空泵(巩义市英予华仪器厂),Labconco FreeZone冷冻干燥仪(美国LABCONCO 公司)。
2 方法与结果
2.1 对照品溶液的制备:取在105 ℃干燥至恒重的无水葡萄糖202.7 mg,精密称定,加纯水溶解并定容至100 mL,作为母液备用。再取适量母液稀释至质量浓度为0.203 mg/mL的葡萄糖溶液为标准溶液。4 ℃冰箱保存,备用。
2.2 苯酚溶液的配制:称取苯酚200 g,加入铝片0.2 g和碳酸氢钠0.1 g,进行蒸馏,收集182 ℃馏分,精密称取25.0 g馏分,用纯水溶解,并于棕色瓶中定容至500 mL,即得5%苯酚溶液,于4 ℃温度下避光保存备用。见图1。

图1 多糖的提取工艺流程
2.3 多糖的提取工艺流程:①预处理:将材料洗净、烘干,粉碎,过三号筛,加入乙醚浸泡12 h,挥干乙醚,残渣加95%的乙醇回流2 h,残渣挥干溶剂,保存备用。②sevag法脱蛋白:沉淀依次用无水乙醇、丙酮、无水乙醇洗涤至无色,再加水复溶,按1∶1的比例用水复溶,置锥形瓶中,加入其体积1/4的sevag试剂[三氯甲烷∶正丁醇=4∶1(v∶v)的混合溶液]剧烈震摇15 min,4000 r/min离心10 min,取上清液再加入相当于其体积 1/4 的sevag试剂,重复以上操作直到无白色絮状物产生为止。浓缩,真空冷冻干燥,即得。
2.4 粗多糖含量测定。式(1)中:C为测得的样品溶液的葡萄糖质量浓度/(μg/mL);V为供试液体积/mL;m为供试品的质量/mg;式(2)中:m为醇沉后得到的多糖质量/g;M为称取的细柱五加的质量/g。

2.5 测定波长的选择:精密吸取0.5 mL葡萄糖对照品溶液和2.0 mL供试品溶液于具塞试管中,各加入5%苯酸1.0 mL,混匀,迅速加入5.0 mL浓硫酸,摇匀,室温放置5 min,再于100 ℃水中保温15 min,取出,室温放冷,在200~600 nm处进行扫描,对照品和供试品在490 nm处有最大吸收波长(波长扫描光谱图,见图2)。
2.6 线性关系考察:取6个具塞试管,分别加入对照品溶液0.3、0.4、0.5、0.6、0.7、0.8 μL,精密吸取,加纯水至2 mL,以纯水为空白,各加入5%苯酚溶液1.0 mL,摇匀,迅速加入5.0 mL浓硫酸,摇匀,室温放置5 min,再于100 ℃水中保温15 min,取出,室温放冷,在490 nm波长处测定吸光度。以吸光度为纵坐标,对应的葡萄糖溶度为横坐标制作标准曲线,得回归方程为:A= 0.0092C+0.1084,r=0.9990,在30.41~81.08 μg/mL浓度范围内呈良好线性关系。见表1和图3。

图2 200~600 nm波长吸光度谱图
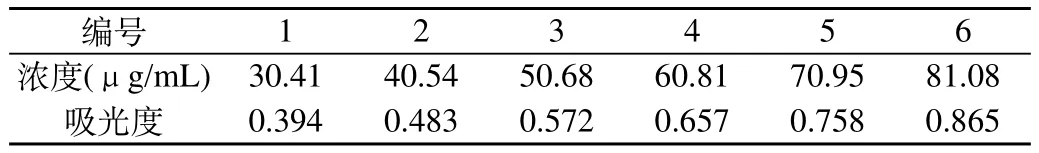
表1 葡萄糖线性关系考察

图3 葡萄糖标准曲线
2.7 单因素试验:考察不同提取方式、溶剂用量、提取时间、提取次数、提取温度对细柱五加多糖提取率的影响。
2.7.1 提取方式考察:准确称取细柱五加药材粉末(过三号筛)10.0 g,置于提取容器中,加入纯水100 mL,密塞,称定重量,分别60 ℃环境下热浸、超声60 min,再称定重量,用纯水不足减失的重量,摇匀,过滤。按“多糖的提取工艺流程”操作制得粗多糖。结果表明:超声能够加速药材中多糖溶解于溶剂中,使得提取粗多糖得率较高,因此选用超声提取方法。见图4。

图4 提取方式对多糖提取率的影响
2.7.2 溶剂用量对多糖得率的影响:准确称取10.0 g细柱五加药材(过三号筛),超声提取,提取时间为60 min,提取温度为60 ℃,提取次数为1次。分别加入纯水50、100、150、200、250 mL。按“多糖的提取工艺流程”操作制得粗多糖。随着溶剂用量的增加,多糖提取率也随着提高,达到150 mL后趋于缓慢。因此确定溶剂用量为150 mL。见图5。
2.7.3 提取时间对多糖得率的影响:准确称取10.0 g药材,加入纯水150 mL,提取温度为60 ℃,每次提取时间分别为30、60、90、120、150 min。按“多糖的提取工艺流程”操作制得粗多糖,随提取时间的增加,多糖提取率也增加,这是超声波提取过程时原料中多糖成分不断溶出并向提取液中扩散的过程。随着提取时间的增加,提取溶剂中多糖的含量逐渐增大,而同时原料组织中,多糖含量逐渐降低,则多糖物的浓度梯度不断减少,至趋近于平衡,所以在90 min后多糖提取率增加较缓慢。综合考虑,提取时间选择90 min。见图6。

图5 提取溶媒用量对多糖提取率的影响

图6 提取时间对多糖提取率的影响
2.7.4 不同提取次数对多糖得率的影响:准确称取10.0 g药材,加入纯水150 mL,提取温度为60 ℃,提取时间为90 min,提取次数分别为1次、2次、3次、4次、5次。按“多糖的提取工艺流程”操作制得粗多糖,细柱五加多糖提取率随着提取次数的增加而增加,由多次造成药材细胞内外多糖的浓度差,使细胞内的多糖不断向外扩散,如此多次往返,直至细胞内多糖几乎完全溶出,达到动态平衡,从图可以看出当提取次数达到3 次时,再增加提取次数,多糖提取率增大的幅度不大,而且消耗时间也会延长,工作量加大,从经济等多方面综合考虑,选择最佳提取次数为3次。见图7。
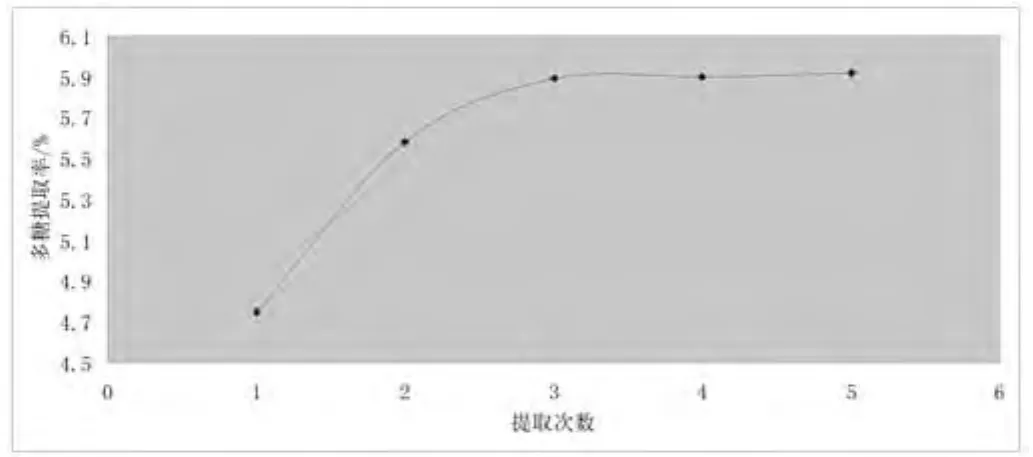
图7 不同提取次数对多糖提取率的影响
2.7.5 提取温度对多糖得率的影响:准确称取10.0 g药材,加入纯水150 mL,提取时间为90 min,提取次数为3次,提取温度分别为40、50、60、70、80 ℃。按“多糖的提取工艺流程”操作制得粗多糖,在60 ℃之前,随着温度的升高,多糖溶出率增加,提取率随温度的升高而增加;在60 ℃后,多糖提取率随温度的增加而降低,可能是因为温度高,在超声的空化作用和高温的双重作用下使得多糖降解,从而使提取率降低。所以,提取温度选择60 ℃较为适宜。见图8。
2.8 正交试验:根据单因素试验结果,选用 L9(34) 正交表,选取溶剂用量、提取时间、提取次数、提取温度为考察因素(表2),并选择适当的因素水平范围,对多糖提取工艺进行正交试验。正交试验设计及结果见表3、4。
由表3直观分析表明,用超声法提取多糖选择水为溶剂,以多糖提取率为评价指标,最优提取工艺为准确称取10.0 g药材超声提取,纯水200 mL、提取温度60 ℃、提取时间90 min、提取次数4次。各因素对提取率的影响程度依次是提取次数>溶剂用量>提取时间>提取温度。
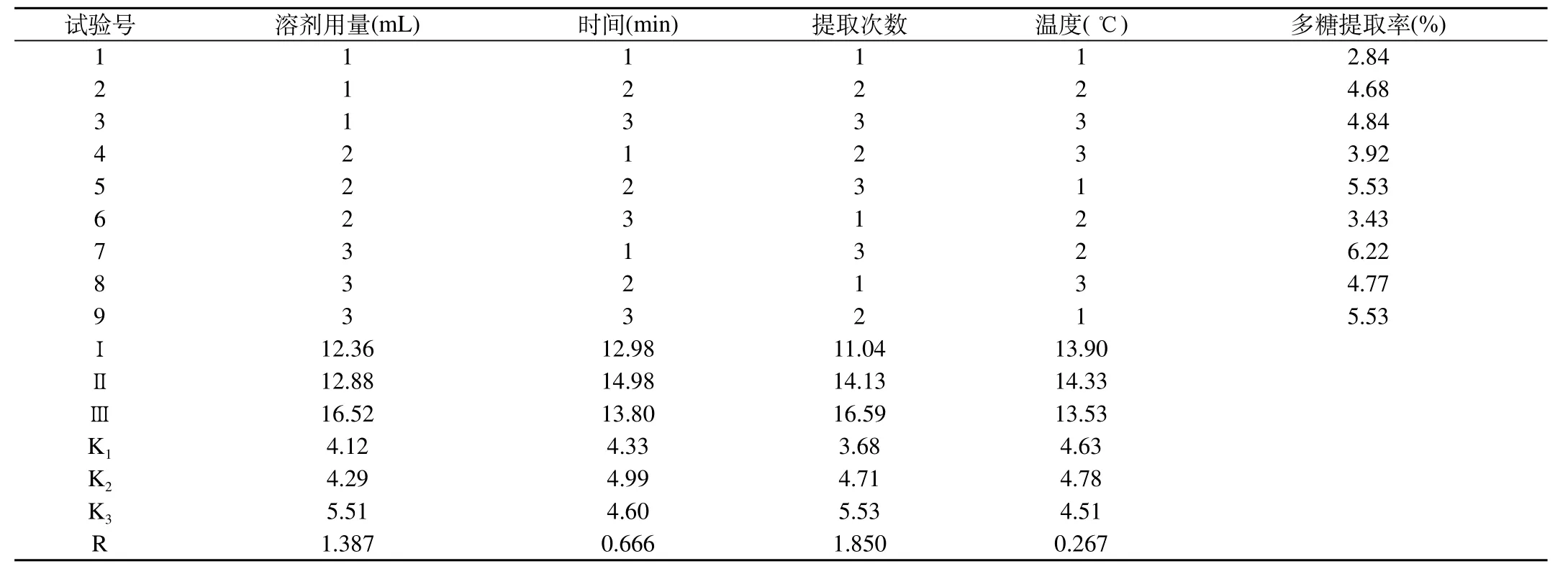
表3 正交试验设计及极差分析结果

图8 提取时间对多糖提取率的影响

表2 L9(34) 正交试验因素水平表

表4 正交试验方差分析
2.9 验证实验:对比单一因素和正交实验考察结果,分别按优化后的工艺条件,重复3批验证实验,实验结果表明,正交实验给出的最优提取工艺对细柱五加多糖的平均提取率为6.54%,结果表明优化得到提取工艺稳定且多糖提取量最大。
3 结论与讨论
根据实验结果,确定细柱五加多糖的最佳提取、纯化方法为:将材料洗净、烘干,粉碎,过三号筛,加入乙醚浸泡12 h,挥干乙醚,残渣加95%的乙醇回流2 h,残渣挥干溶剂,保存备用。称取10.0 g处理过药材,加入200 mL纯水,超声提取,提取温度60 ℃、提取时间90 min、提取次数4 次。合并滤液,浓缩至料液比1∶1,加入乙醇使其醇含量为80%,静置24 h。离心弃上清液,沉淀依次用无水乙醇、丙酮、无水乙醚洗涤至无色,再加水复溶,按1∶1的比例用水复溶,置锥形瓶中,加入其体积1/4的sevag试剂[三氯甲烷∶正丁醇=4∶1(v∶v)的混合溶液]剧烈震摇15 min,4000 r/min离心10 min,取上清液再加入相当于其体积 1/4的sevag试剂,重复以上操作直到无白色絮状物产生为止。浓缩,真空冷冻干燥,即得。
有学者对细柱五加多糖做了细胞毒性与体外免疫活性实验,实验结果提示细柱五加茎多糖能刺激巨噬细胞释放NO,具有一定的体外免疫活性[14]。且在对其同属红毛五加多糖的研究中发现其对免疫系统的影响,能抑制S180肿瘤生长,表明其具有抗肿瘤作用[15]。所以对细柱五加多糖进行深入研究,必将促进现代医学对人体自卫机制的研究。
[1] 中华人民共和国国家药典委员会.中国药典[S]一部.北京:中国医药科技出版社,2010:61.
[2] 吴宝成,韦敏,吕晔,等.细柱五加研究进展[J].安徽农业科学,2014,42(22):7391-7394.
[3] 张晶,刘芳芳,陈彦池,等.刺五加化学成分及药理学研究进展[J].中国野生植物资源,2008,27(2):6-10.
[4] 赵纪峰,王海军,苏晶,等.中药多糖的提取分离工艺研究[J].重庆中草药研究,2007(1):29-32.
[5] 郑必胜,唐芳勇.何首乌多糖的研究进展[J].农产品加工,2008(2):29-32.
[6] 李义,陈星,李红霞,等.马兰水溶性粗多糖提取工艺的研究[J].农业工程学报,2006,22(1): 161-163.
[7] 朱晓宦,吴向阳,仰榴青,等.马齿觅粗多糖的提取及清除羟自由基活性作用[J].江苏大学学报:医学版,2007,17(1): 57-60.
[8] Trommer H,Neubertr HH.The examination of polysaccharides as potential antioxidative compounds for topicaladministration using a lipid model system[J].Int J Pharm,2005,298(1): 153-163.
[9] 刘娟,邓泽元,于化泓.决明子水溶性多糖的抗氧化作用[J].食品科学,2006,27(5): 61-63.
[10] 罗丽萍,高荫榆,洪雪娥,等.薯蔓黄酮和多糖体内抗氧化作用研究[J].食品科学,2005,26(8): 408-410.
[11] 丁保金,金丽琴,吕建新.多糖生物活性研究进展[J].中国药学杂志,2004,39(8): 561-564.
[12] 翼伸.怎样研究植物多糖[J].生命的化学,1999,19(6): 296-297.
[13] 郑晶泉.抗氧化剂抗氧化实验研究进展[J].国外医学:卫生学分册,2000,27(1): 37-38.
[14] 谢霞,李芝,黄玮,等.超细柱五加茎多糖闪式提取工艺优化及其免疫活性研究[J].中草药,2013,44(20):2859- 2863.
[15] 高月来,沈烈行.五加皮成分和药理作用研究进展[[J].山东中医药大学学报,2000,24(5): 392-393.

