使用FVB/N和C57BL/6品系小鼠制备TFAM敲低转基因小鼠的比较
秦 瑶,赵鸿彦,张文航,王冬梅
(遵义医学院附属医院 心内科,贵州 遵义 563099)
基础医学研究
使用FVB/N和C57BL/6品系小鼠制备TFAM敲低转基因小鼠的比较
秦 瑶,赵鸿彦,张文航,王冬梅
(遵义医学院附属医院 心内科,贵州 遵义 563099)
目的 比较TFAM敲低对不同品系小鼠的影响。方法 通过慢病毒显微注射的方法分别制备FVB/N和C57BL/6品系的TFAM敲低转基因小鼠;统计比较两种品系小鼠的制备和繁殖情况;使用定量PCR方法检测比较两种品系小鼠中TFAM的敲低情况。结果 使用PCR方法可鉴定转基因阳性小鼠,此小鼠耳朵皮肤组织可观察到绿色荧光;两种品系转基因小鼠具有相似的TFAM敲低水平;TFAM敲低能够子代遗传;C57BL/6敲低小鼠的繁殖能力显著弱于FVB/N小鼠。结论 成功制备了FVB/N和C57BL/6品系的TFAM敲低转基因小鼠,TFAM敲低对于两种品系的小鼠具有明显不同的影响。
线粒体;线粒体转录因子A;转基因小鼠
线粒体是细胞内主要的能量代谢细胞器,对于维持细胞的正常功能具有重要的作用。近年来发现大量的疾病都与线粒体功能的紊乱有关[1-3]。心脏是一个高能量代谢的器官,线粒体功能的缺陷,对心脏的影响尤其严重,心衰,心律失常,心力衰竭等临床表现均与线粒体异常有关[4-5]。深入了解线粒体功能对线粒体相关疾病的研究具有重要的意义。
线粒体转录因子A(TFAM)是一个重要的线粒体相关蛋白,对于维持线粒体正常功能有着重要作用。通过组织特异性敲除TFAM能够得到线粒体DNA(mtDNA)异常,以及线粒体功能缺陷的小鼠[6]。通过RNA干扰技术能够获得多组织TFAM下调的转基因小鼠,这种小鼠的心脏细胞线粒体功能受损[7]。这些基因敲除及敲低的小鼠为在整体水平上研究线粒体相关疾病提供了很好的模型。
由于不同的疾病有着不同的最适合的小鼠品系模型,因此本研究中我们使用两种不同的小鼠品系制备了TFAM敲低的转基因动物,发现同样的条件下,TFAM的敲低对于不同品系的小鼠的生存繁殖会产生显著不同的影响,本研究为在不同品系小鼠中研究基因功能提供了重要的参考意义。
1 材料与方法
1.1 细胞株 293FT细胞购于life technology公司。
1.2 实验动物 FVB/N和C57BL/6小鼠购于第三军医大学实验动物中心。
1.3 实验方法
1.3.1 细胞培养 293FT细胞使用DMEM培养基,添加10%胎牛血清,青链霉素,置于37℃,5% CO2培养箱中培养。
1.3.2 TFAM敲低慢病毒制备 TFAM敲低病毒载体pLentis-Ubi-GFP-miRTFAM以及病毒制备方法见前文献描述[7]。TFAM的干扰序列通过XhoI和EcoRI酶切位点连接到载体pLentis-Ubi-GFP-miR30中,获得TFAM干扰病毒载体pLentis-Ubi-GFP-miRTFAM。通过磷酸钙转染法将包装质粒和病毒载体同时转染293FT细胞,收集上清病毒液,50 000g超速离心后用适量HBSS重悬,得到浓缩病毒液用于胚胎转染。
1.3.3 TFAM敲低转基因小鼠制备 通过将TFAM敲低病毒注射到小鼠胚胎透明带下的方法制备转基因小鼠,具体操作见文献描述[8]。将浓缩的病毒液注射到收集的小鼠胚胎透明带下,然后将注射后活性状态正常的胚胎移植到假孕母鼠的输卵管膨大部,待小鼠出生后,鉴定制备成功的转基因小鼠,用于后继繁殖。
1.3.4 转基因小鼠PCR鉴定 剪取小鼠尾端约0.5cm组织,使用Takara公司DNAiso reagent提取基因组,以此基因组为模板进行PCR反应,反应产物通过琼脂糖凝胶电泳确定PCR条带。所用引物为:WPRE F:TGACTGGTATTCTTAACTATGTTGCTCC; WPRE R:AGGGAGATCCGACTCGTCTGA。
1.3.5 转基因小鼠荧光鉴定 在小鼠耳朵外侧剪
取一小块组织,用镊子小心从中间分为腹侧和背侧,将分开的样本置于载玻片上,用正置荧光显微镜观察样本荧光。
1.3.6 TFAM定量PCR检测 剪取一小块小鼠耳朵组织,使用Takara公司RNAiso提取总RNA,Takara公司PrimeScriptTMRT reagent Kit with gDNA Eraser反转录获得cDNA,使用此cDNA为模板,Takara公司SYBR®Premix DimerEraserTM试剂进行定量PCR反应。所用仪器为Agilent Stratagene MX3000P定量PCR仪。所用引物为TFAM qF:CAAAGGATGATTCGGCTCAG; TFAM qR:AAGCTGAATATATGCCTGCTTTTC; Act qF:CTAAGGCCAACCGTGAAAAG ;Act qR:ACCAGAGGCATACAGGGACA。
1.3.7 数据分析 所有数据使用GraphPad Prism 5软件进行分析和作图。P<0.05有统计学差意义。
2 结果
2.1 FVB/N和C57BL/6小鼠制备TFAM敲低转基因小鼠统计 使用显微注射的方法制备FVB/N和C57BL/6品系的TFAM敲低小鼠,获得的首建鼠(F0)可以使用PCR的方法检测病毒成功整合的阳性小鼠(见图1);通过剪取耳朵组织进行荧光显微镜观察能够鉴定转基因成功表达的阳性小鼠(见图2)。FVB/N小鼠出生率为6.2%(16/260),C57BL/6小鼠出生率为8.3%(26/313),而出生小鼠的转基因阳性率FVB/N(56.3%)远高于C57BL/6(11.5%)(见表1)。提示FVB/N小鼠对TFAM敲低有更好的耐受。
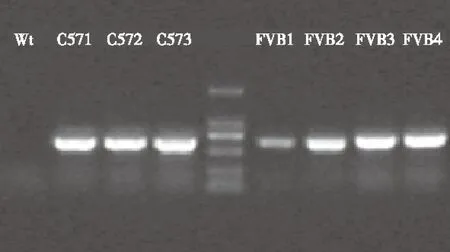
WT:野生型小鼠;C57 1,C57 2,C57 3:3只C57BL/6阳性小鼠;FVB 1,FVB 2,FVB 3,FVB 4:4只FVB/N阳性小鼠;Marker: Takara DL2000 DNA ladder。
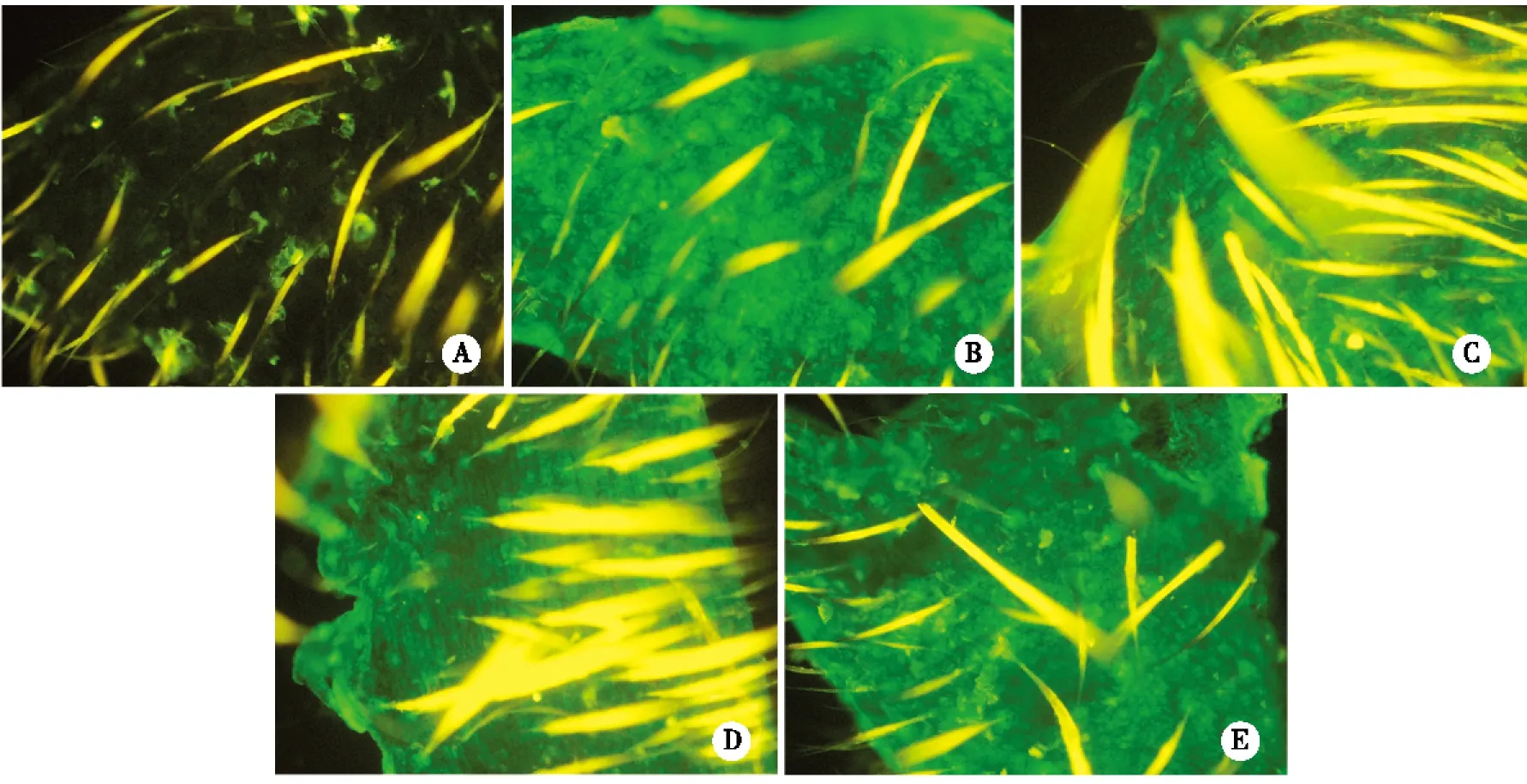
A:野生型小鼠;B: C57BL/6阳性小鼠1;C:C57BL/6阳性小鼠2;D:FVB/N阳性小鼠1;E:FVB/N阳性小鼠2。
表1 胚胎操作和小鼠制备情况

FVB/NC57BL/6胚胎小鼠胚胎小鼠采集注射移植出生转基因采集注射移植出生转基因352288260169386354313263
采集:采集的胚胎数;注射:注射病毒的胚胎数;移植:移植到假孕母鼠的胚胎数;出生:假孕母鼠生产的小鼠数;转基因:鉴定的转基因阳性小鼠数。
2.2 转基因小鼠繁殖情况统计 鉴定的转基因小鼠与野生型小鼠杂交进行繁殖。F1代小鼠存活率(FVB/N 84.4% vs C57BL/6 39.4%)和存活小鼠阳性率(FVB/N 85.2% vs C57BL/6 30.8%),F2代小鼠存活率(FVB/N 85.7% vs C57BL/643.2%)和存活小鼠阳性率(FVB/N 73.3% vs C57BL/6 43.8%),FVB/N小鼠均显著高于C57BL/6小鼠(见表2)。提示TFAM敲低对小鼠繁殖有持续性影响。
表2 转基因小鼠繁殖情况

FVB/NC57BL/6F1F2F1F2出生存活阳性出生存活阳性出生存活阳性出生存活阳性3227233530223313437167
出生:生产出的小鼠数;存活:3周后仍存活的小鼠数;阳性:鉴定为转基因阳性的小鼠数。
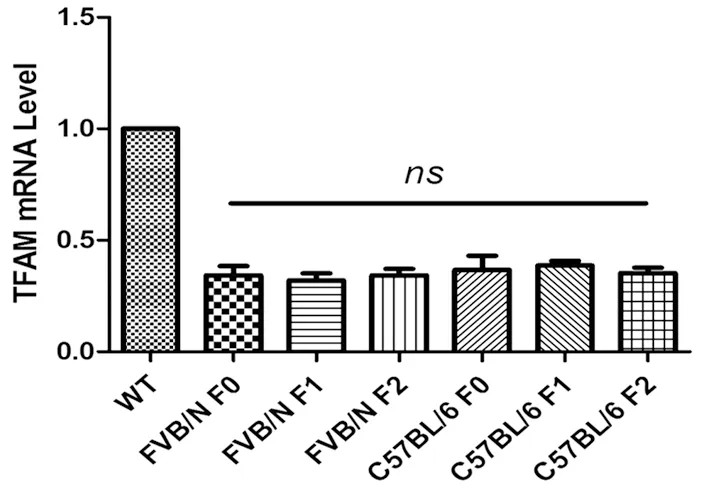
图3 转基因小鼠中TFAM表达水平分析
2.3 转基因小鼠TFAM表达分析 使用定量PCR检测转基因小鼠TFAM基因转录情况。两种品系小鼠中TFAM均被有效的敲低,此表型在子代小鼠中能够得到稳定遗传。FVB/N和C57BL/6小鼠中TFAM的敲低水平差异没有统计学意义(见图3)。
3 讨论
通过敲除或敲低TFAM基因获得的线粒体缺陷的小鼠,是研究线粒体相关疾病的一种重要模式动物。TFAM完全敲除对小鼠有致死性,其胚胎无法正常发育完全,从而限制了这一模型的使用[9]。前期我们用RNA干扰方法制备了TFAM敲低的小鼠,这种小鼠中线粒体功能同样受到损伤,并且TFAM敲低的胚胎能够正常发育。但是相比于野生型小鼠,TFAM敲低的C57BL/6小鼠繁殖能力明显低下。在本研究中我们同时制备了TFAM敲低的FVB/N小鼠,发现TFAM的敲低对FVB/N小鼠的繁殖能力并未产生明显的影响。比较两种小鼠的TFAM基因表达情况发现其TFAM敲低水平一致,说明这种变化并非是由TFAM的敲低所引起的,更可能是由于不同品系小鼠之间的基因差别导致的。对于人类来说,不同的人种或不同的人群对于某些疾病的易感性有显著的差别,这种差别有可能是核苷酸多态性或者表观遗传学多样性所导致的。在小鼠中这一情况也同样存在,例如实验性自身免疫性脑脊髓炎(EAE)在不同品系小鼠中诱导反应并不一致,通常使用C57BL/6小鼠能够较好的诱导[10];3-型鼠肝炎病毒(MHV-3)感染对C57BL/6具有致死性,而A/J小鼠却能抵抗这种病毒感染[11]。我们的实验也提示了FVB/N小鼠对于TFAM的缺陷的耐受性显著强于C57BL/6小鼠,可能是这种小鼠存在一定的线粒体缺陷的补偿机制。总的来说,尽管同一物种不同种群之间基因组序列仅有微小的差别,其对于外在因素的反应却有巨大差异。因此对于疾病的动物水平研究,充分考虑这一因素对于后继的转化医学研究将有重要的意义。
对于线粒体相关疾病的研究来说,其基因多态性对于疾病的进程会产生一定的影响[12]。我们的实验同样反映出了不同品系小鼠基因差别导致的对线粒体缺陷的不同反应。由于线粒体缺陷可能导致各种不同组织的疾病,而不同疾病在不同品系小鼠上具有不同的易感性,因此研究线粒体相关疾病可能会用到各种不同的小鼠品系上的疾病模型。在这种情况下,考虑到线粒体缺陷对小鼠繁殖能力的影响,如果用C57BL/6则可能因为繁殖力太弱而无法顺利的进行研究。因此可以选择既能诱导此疾病,又能在线粒体缺陷下正常繁殖的品系来制备转基因小鼠,从而获得足够的种群来进行相关的研究。因此本研究对于线粒体缺陷疾病模型的建立同样具有引导性的意义。
[1] Jin H,May M,Tranebjaerg L,et al. A novel X-linked gene,DDP,shows mutations in families with deafness(DFN-1) ,dystonia,mental deficiency and blindness[J]. Nat Genet,1996,14(2): 177-180.
[2] Hudson G,Deschauer M,Busse K,et al. Sensory ataxic neuropathy due to a novel C10Orf2 mutation with probable germline mosaicism[J].Neurology,2005,64(2): 371-373.
[3] Kemp J P,Smith P M,Pyle A,et al. Nuclear factors involved in mitochondrial translation cause a subgroup of combined respiratory chain deficiency[J].Brain,2011,134(Pt 1): 183-195.
[4] Lemieux H, Semsroth S, Antretter H, et al. Mitochondrial respiratory control and early defects of oxidative phosphorylation in the failing human heart[J]. Int J Biochem Cell Biol,2011,43(12):1729-1738.
[5] Karamanlidis G, Bautista-Hernandez V, Fynn-Thompson F, et al. Impaired mitochondrial biogenesis precedes heart failure in right ventricular hypertrophy in congenital heart disease[J]. Circ Heart Fail,2011,4(6):707-713.
[6] Tavi P, Hansson A, Zhang S J, et al. Abnormal Ca2+release and catecholamine-induced arrhythmias in mitochondrial cardiomyopathy[J]. Hum Mol Genet,2005,14(8): 1069-1076.
[7] 秦瑶, 赵鸿彦, 张文航, 等. 线粒体转录因子A敲低转基因小鼠的研制[J]. 中国生物工程杂志, 2014, 34(7): 44-48.
[8] Singer O, Tiscornia G, Ikawa M, et al. Rapid generation of knockdown transgenic mice by silencing lentiviral vectors[J]. Nat Protoc, 2006,1(1):286-292.
[9] Larsson N G, Wang J, Wilhelmsson H, et al. Mitochondrial transcription factor A is necessary for mtDNA maintenance and embryogenesis in mice[J]. Nat Genet,1998,18(3):231-236.
[10] Terry R L, Ifergan I, Miller S D. Experimental Autoimmune Encephalomyelitis in Mice[J]. Methods Mol Biol. 2014 Jul 9. [Epub ahead of print].
[11] Lucchiari M A, Martin J P, Modolell M, et al. Acquired immunity of A/J mice to mouse hepatitis virus 3 infection: dependence on interferon-gamma synthesis and macrophage sensitivity to interferon-gamma[J]. J Gen Virol, 1991,72(6):1317-1322.
[12] 谌宏运,张信江,黄世敬. 线粒体基因多态性与AIDS进程的相关研究[J]. 遵义医学院学报,2012,35(1):85-87.
[收稿2014-09-23;修回2014-11-07]
(编辑:谭秀荣)
Comparison of preparing TFAM knockdown transgenic mice using FVB/N and C57BL/6 mouse strains
QinYao,ZhaoHongyan,ZhangWenhang,WangDongmei
(Department of Cardiology,The Affiliated Hospital of Zunyi Medical University ,Zunyi Guizhou 563099,China)
Objective Compare the influence of transcription factor A, mitochondrial (TFAM) knockdown (down-regulating gene expression by RNA interference) in different mouse lines.Methods TFAM knockdown mice of the FVB/N and C57BL/6 strain were prepared by lentivirus microinjection; The production and reproduction of these transgenic mice were compared; The knockdown levels of TFAM in the transgenic mice were measured by qPCR.Results Green fluorescence can be observed in skin tissues of ears from transgenic mice identified by PCR. There were comparable TFAM knockdown levels between these two strains. TFAM knockdown was germinal transmissible. The reproductive potential of the C57BL/6 strain was much weaker than the FVB/N strain.Conclusion TFAM knockdown mice were successfully produced in both FVB/N and C57BL/6 stains. TFAM knockdown has various effects on these two mouse strains.
mitochondria; mitochondrial transcription factor A; transgenic mice
贵州省省长基金临床应用课题专项(NO:黔省专合字[2012]180)。
R54
A
1000-2715(2015)01-0045-04

