肉鸡白念珠菌病常用实验诊断方法比较研究
刘建钗,柳焕章,刘彦威,王慧真,张永英
肉鸡白念珠菌病常用实验诊断方法比较研究
刘建钗,柳焕章,刘彦威,王慧真,张永英
目的 探究肉鸡白色念珠菌病简便快速诊断方法。方法 对50例来自不同鸡场的临床疑似样本分别采用KOH镜检法、改良KOH镜检法、分离纯化与形态观察法、TTC显色培养法、组织切片法和巢式PCR法进行试验。结果 上述方法的样本检测阳性率分别为62.0%(31/50)、78.0%(39/50)、82.0%(41/50)、82.0%(41/50)、86%(43/50)和88.0%(44/50),耗时分别为1~2 h、1~2 h、7~8 d、6~7 d、8~10 d和7~8 h。结论 通过比较各种常用方法的优缺点,建议采用巢式PCR法与改良KOH镜检法相结合作为肉鸡白念珠菌病简便快速诊断的优选方案,其特异性强,敏感度高,耗时少,并兼顾病原侵染状态的直观性。
肉鸡;白念珠菌;诊断方法;巢式PCR
白念珠菌(Candidaalbicans)是经常导致人和动物感染的重要条件致病真菌[1-2]。白念珠菌病在肉鸡中也普遍发生,致使病鸡生长缓慢,生产能力下降,或引起死亡,给养鸡业带来较大经济损失[3-4],同时也给从业人员和消费者带来安全隐患。据报道,白念珠菌不仅是270余种念珠菌中毒力最强的一种[5-6],而且还可引起免疫抑制,一旦机体被感染,容易引起继发与混合感染[7],所以对白念珠菌病应尽早诊断和及时治疗。由于白念珠菌感染的临床表现特异性不强,又具有病原表型多样性和条件致病性特点,致使早期感染的临床诊断相当困难,往往延误或错误治疗。因此,建立一种简便、快速、可靠的肉鸡白念珠菌病诊断方法,无论对养鸡业的健康发展,还是在公共卫生方面都具有重要意义[8]。本研究的目的就是寻找肉鸡白念珠菌病适宜的诊断方法,为该病的及时防治和进一步的研究提供技术支持,也为其它动物白念珠菌病的诊断提供参考。
1 材料与方法
1.1 样本采集与处理
1.1.1 采样鸡场的肉鸡品种 罗斯308(Ross 308)。
1.1.2 疑似病例参照指标 肉鸡白念珠菌病是一种消化道真菌性传染病。临床主要表现为食量减少,饮水增加,发育不良,形体瘦小;嗉囊胀大,触感松软,内容物或口水气味酸臭;严重病例呼吸急促,下痢,粪便呈灰白色,脱水衰竭而死亡。主要病理特征是在口腔、咽喉、食道、嗦囊和腺胃等消化道黏膜上形成乳白色斑片并导致黏膜发炎、溃疡或鳞屑状病变。其中典型的剖检病变是嗉囊内表面有豆腐渣样物呈假膜覆盖[9],是本病与传染性腺胃炎、鸡肾型传染性支气管炎等具消化道症状疾病的主要区别。
1.1.3 病料采集与处理 从河北省石家庄地区某肉鸡养殖小区的5个鸡场各选取白念珠菌病疑似病鸡10只,每只采取嗉囊内表面附着内容物1 g左右,放入1.5 mL灭菌EP管中备用(共50份);同时用灭菌剪刀剪取内容物取样处的嗉囊小块组织(1 cm×1 cm)各1份(共50份),放入4%甲醛固定液中固定24 h待用。
1.2 主要试剂 基因组DNA提取试剂盒为Solarbio公司产品;PCR试剂盒、DNA Marker为北京全式金生物技术有限公司产品;真菌鉴定通用引物与白念珠菌特异引物由北京三博远志生物技术有限公司合成。
PDA庆大霉素培养基(Ⅰ)、玉米粉吐温琼脂培养基(Ⅱ)、TTC(氯化三苯四氮唑)-沙氏琼脂培养基(Ⅲ)为自制。
试验对照菌株:白念珠菌(Candidaalbicans)、热带念珠菌(Candidatropicalis)和光滑念珠菌(Candidaglabrata)菌种为本单位分离保藏。
1.3 样本镜检 ① KOH法:参考刘彦威等方法[10],以看到特征性菌丝和孢子者为阳性结果,连续两次检查均未看到特征性菌丝或孢子者为阴性结果。样本检测的敏感程度可用阳性率表示,计算方法:样本检测阳性率=(阳性样本数 / 检测样本总数)×100%。② 改良KOH法:取少许内容物样本置载玻片上,加改良复方KOH溶液(KOH 15 g加入30 mL蒸馏水中溶解后,依次加入DMSO 40 mL,甘油20 mL,加入蒸馏水至1 000 mL混匀)1~2滴,自然干燥或加热干燥后,火焰固定,滴一滴结晶紫染色30 s左右,水洗,加盖玻片镜检。阳性与阴性结果判断参照KOH法。
1.4 病原分离纯化与形态观察 将每个内容物样本取0.3 g分别置于1.5 mL灭菌EP管中,加入0.7 mL灭菌蒸馏水,封盖,瞬时振荡,用无菌棉签沾取悬液于Ⅰ号培养基平板涂划接种,于37 ℃恒温培养36~48 h;用接种环挑取疑似菌落于Ⅰ号培养基平板划线分离,于37 ℃恒温培养36~48 h;将疑似单菌落取菌体革兰氏染色镜检,将革兰氏阳性反应且为酵母状细胞的相应菌落取菌体分别接种于Ⅱ号培养基的平板和无菌载片,于37 ℃恒温、保湿培养3~4 d,观察平板菌落特征并直接镜检载片培养物形态特征。将同时看到菌丝状菌落、菌丝(芽管)、厚垣孢子形态者记录为阳性结果。
1.5 TTC显色培养 参考欧阳珂珮等方法[1],用接种环挑取从各样本分离纯化的疑似单菌落的菌体接种于Ⅲ号培养基平板的划定区域,在同一平板的相邻区域分别接种热带念珠菌和光滑念珠菌作对照,于37 ℃恒温培养2~3 d,观察显色结果。以出现乳白色至淡粉色菌落(菌苔)者为阳性结果,其他颜色为阴性结果。
1.6 组织切片制作与观察 将疑似白念珠菌感染的病鸡嗉囊组织样本从甲醛固定液中取出,经修块、脱水、透明、浸蜡包埋、切片和 Cott-Gomori 六胺银染色,观察组织病理和病原形态,显微照相。以组织中出现特征性菌丝和孢子形态者为阳性结果。
1.7 DNA的提取与巢式PCR 将每个内容物样本取0.2 g放在研钵中,加适量液氮研磨至浆状备用;阳性对照用白念珠菌培养物,阴性对照用未患病鸡嗉囊内容物,特异性对照用光滑念珠菌和热带念珠菌培养物。试样与对照的DNA提取方法按Solarbio试剂盒说明进行。
第1轮PCR采用真菌rDNA内转录间区(ITS)序列通用引物(ITS1 5′-TCC GTA GGT GAA CCT GCG G-3′)和(ITS4 5′-TCC TCC GCT TAT TGA TAT GC-3′)对样本和对照DNA提取物进行扩增,目的片段大小为660 bp。PCR反应体系为:Mix 25 μL,引物1.0 μL,模板 DNA 4.0 μL,加ddH2O补足50 μL。PCR反应条件为:94 ℃ 3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 50 s,共35个循环;72 ℃ 10 min;于4 ℃终止反应。
第2轮(巢式)PCR采用白念珠菌特异性引物[11](CALB1 5′- TTT ATC AAC TTG TCA CAC CAG A -3′)和(CALB2 5′-ATC CCG CCT TAC CAC TAC CG -3′),目的片段大小为273 bp。反应体系为50 μL:将第1轮PCR产物1∶6稀释作为DNA 模板,引物用CALB1和CALB2,其他与第1轮相同。反应条件:退火温度为58 ℃,其余条件与第1轮PCR相同,共40循环。取5 μL巢式PCR产物在10 g/L琼脂糖凝胶进行常规电泳,照相并记录结果。
2 结 果
2.1 样本镜检 ①KOH法:在显微镜下观察,视野中背景较杂乱,阳性病料中可见菌丝和孢子形态,但不够清晰(图1A);②改良KOH法:视野背景较为清晰,可清楚观察到分隔菌丝及厚壁孢子(图1B)。样本检测阳性结果、阴性结果、阳性率与时间消耗见表1。
2.2 分离纯化与形态观察 将各样本在Ⅰ号培养基分离纯化得到的疑似纯菌落,进一步用Ⅱ号培养基平板和载片培养,4 d后观察发现在41份样本分离出的单菌落中都出现了阳性结果。阳性分离株在Ⅰ号培养基上培养48 h后的菌落形态如图2A;在Ⅱ号培养基上培养4 d后的菌苔如图2B箭头所示;阳性分离菌株丝状菌落涂片革兰氏染色后的形态如图3A;载片培养物直接镜检形态如图3B-C。
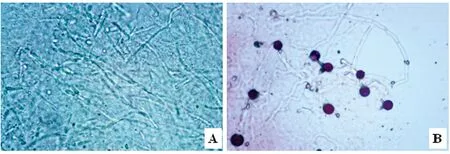
A:KOH法处理嗉囊内容物的显微镜观察,示丝状菌体与孢子(400×);B:改良KOH法,示菌丝和厚壁孢子(400×)
A: Microscopic examination of sample from crop by KOH method, showing mycelia and spores(400×); B: By modified KOH method, showing mycelia and chlamydospores(400×)
图1 KOH法和改良 KOH法处理嗉囊内容物的显微镜观察(400×)
Fig.1 Microscopic examination of sample from crop by KOH method and by modified KOH method(400×)
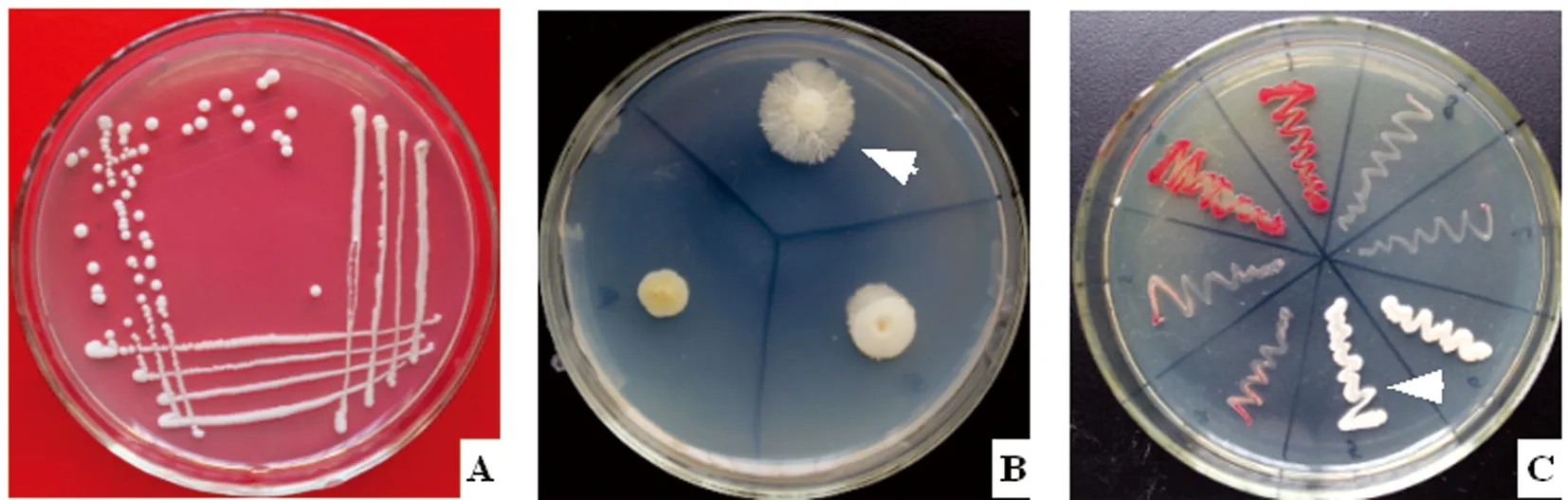
A:阳性分离菌株普通菌落;B:菌丝状菌落;C:TTC显色培养,白色菌苔为阳性
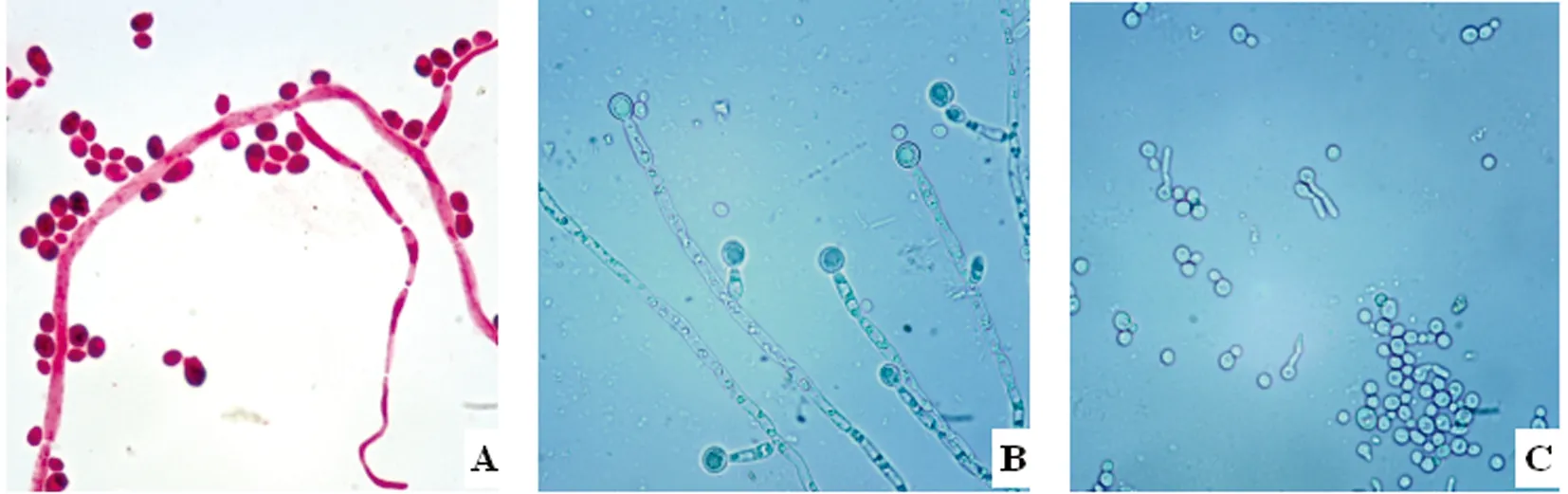
A:阳性分离菌株酵母状细胞与菌丝(400×);B:菌丝与厚壁孢子(400×);C:芽孢子及其芽管(400×)
A: Yeast-like cells and mycelia of positive isolates (400×); B: Mycelia and chlamydospores (400×); C: Blastospores and germ tubes (400×)
图3 阳性分离菌株显微形态
Fig.3 Micromorphology of the positive isolates
2.3 TTC显色培养 在Ⅲ号培养基平板上白念珠菌菌苔呈乳白色(如图2C箭头所示),热带念珠菌为深红色或紫色,光滑念珠菌或其他酵母菌为红色或生长势很弱。
2.4 组织切片 将疑似病鸡嗉囊组织切片镜检,阳性样本可见嗉囊的黏膜复层扁平上皮明显增厚,并发生角质化和上皮细胞脱落现象,大量菌丝穿过粘膜上皮深达黏膜下的腺体中(图4A-B)。
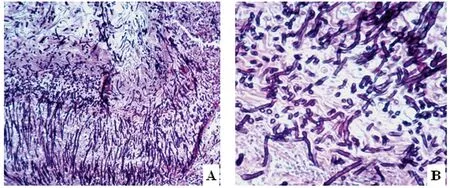
A:病鸡嗉囊病理组织切片镜检,示大量白念珠菌菌丝(100×);B:示病变组织中的大量菌丝(400×)
A:Histopathologic slide of chicken crop, showing great deal ofCandidaalbicansmycelia (100×); B: Showing great deal of mycelia in lesion tissue (400×)
图4 病鸡嗉囊病理组织切片镜检
Fig.4 Microscopy of histopathologic slide with the sick chicken crop
2.5 巢式PCR 以第1轮PCR产物为模板,通过第2轮(巢式)PCR,从每个样本扩增产物中取5 μL进行电泳,阳性对照与阳性样本均出现273 bp的目的条带;阴性对照与特异性对照均未见明显条带出现(图5)。
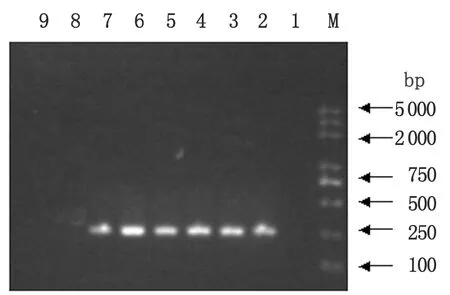
M: DL2000 DNA Marker; 1: Negative control; 2: Positive control; 3-7: Specimens; 8:Candidaglabrata; 9:Candidatropicalis.
图5 样品巢式PCR产物电泳结果
Fig.5 Electrophoresis results of nested PCR of specimens
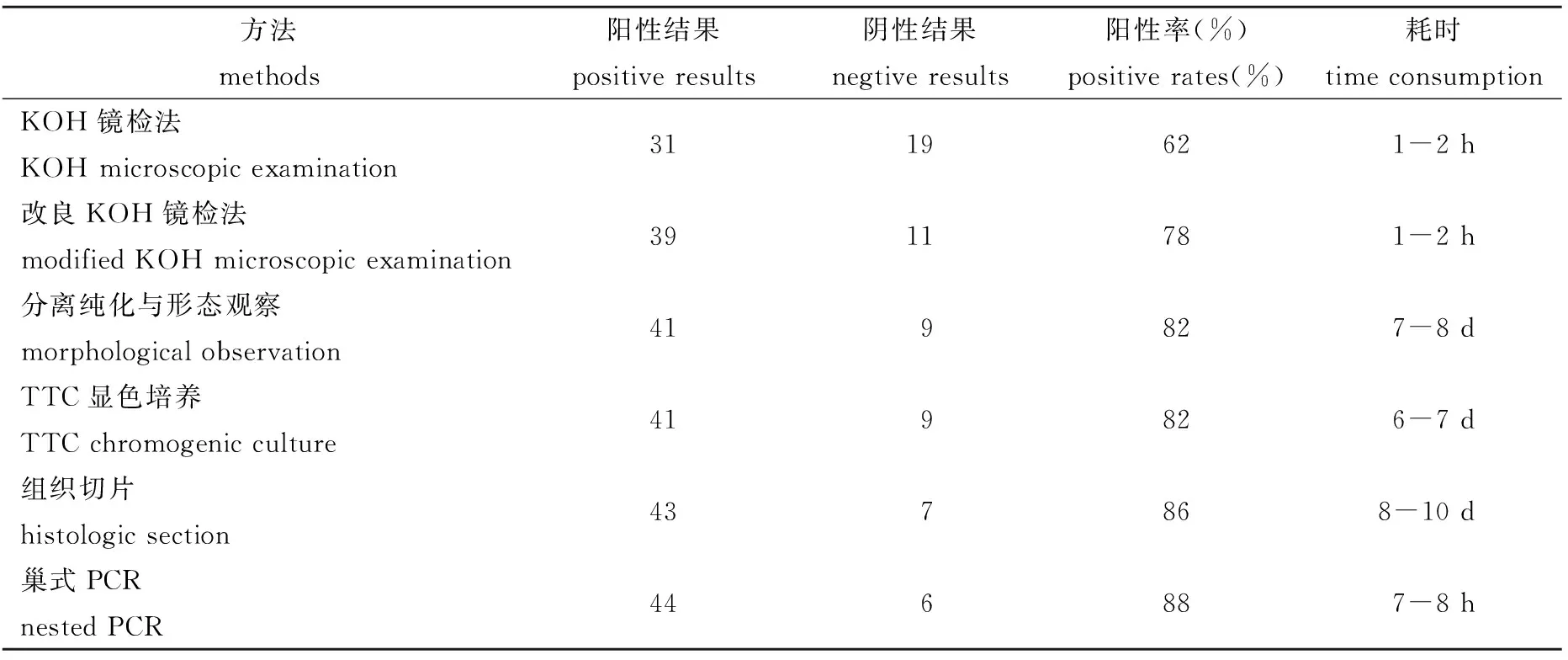
表1 肉鸡白念珠菌病不同检测方法的比较
3 讨 论
将含有真菌病原体的病料直接涂片镜检来检测真菌病的方法简便、快速,可为临床诊断真菌感染提供早期依据。该法常用KOH试剂为载浮液,有关KOH法检测病料中真菌病原体的报道主要集中于皮肤真菌感染的病例[10,12],对动物消化道内容物真菌病原物检查鲜见报道。本试验用KOH法检查疑似白念珠菌病病鸡的消化道内容物,结果其阳性率为62.0%;为提高镜检的阳性率,我们同时采用改良KOH法做平行试验,使镜检阳性率提高到78.0%。其原因可能是在改良KOH法中,增加了载浮液甘油和KOH浓度,并新添了二甲基亚砜,增强样本的溶解和背景的透明度,使视野更清楚,菌丝和孢子较易观察到,从而使阳性率明显提高。此类方法由于受到特异性和敏感性的限制,只能初步判断真菌感染,而不能确定病原真菌的种类和性质。
由于白念珠菌双相性和表型多样的特点,其形态和培养特征往往被用于病原检测的重要依据。孢子相和菌丝相的相互转变是白念珠菌的重要特性,而且菌丝形式更易附着、破坏和侵入宿主组织,因而具有更强的致病力[5,13]。医学上检测必须同时观察到孢子和菌丝(芽管)才有诊断意义[14]。本试验将从各样本分离的疑似菌株通过在不同条件下培养,观察其菌落、菌苔、酵母状细胞、丝状菌体、厚壁孢子、芽孢子与芽管等形态特征,得到检测样本的阳性率为82%。该法比样本镜检法的特异性好,敏感度高,但过程繁琐、耗时长,阳性率结果会受到取样、分离、纯化过程和培养条件等影响,仍存在一定假阴性结果。
显色培养法是在培养基中加入特定显色物质,利用不同培养物的生理与代谢差异使菌落或基质产生特征性颜色从而鉴别菌种的方法。本试验采用TTC显色培养基对分离纯化的疑似菌株进行检测,结果阳性率为82%,与形态观察法相同,说明两者的敏感度相似。由于此法仍需要前期的菌株分离纯化和后期的显色培养过程,同样存在耗时长和假阴性的问题。与形态观察法相比,此法相对简便,且具有较好的特异性,在临床诊断中有一定应用价值。
组织切片法可以直接观察到组织的病理变化和侵入组织的病原特征,因此被学界视为病原真菌侵染状态的“金标准”。组织切片法具有侵染的直观性和特异性较好的优点,但对设备和技术条件要求相对较高、操作步骤多、耗时长,而且样本检测阳性率会受到取样时间、部位及操作过程的影响,也存在假阴性的问题。本研究中的样本检测阳性率为86%,次于巢式PCR法(88%),但耗时最长(8~10 d)。
目前国内外学者已将多种分子生物学方法引入念珠菌病原鉴定和临床诊断[15-16]。其中,采用rDNA区以及rRNA小亚基相应序列分析,特别是转录间隔区序列分析被认为是进行真菌种间分类及种内分型的最可靠方法之一[17]。这些分子生物学的方法是基于样本中有较丰富的DNA含量。临床样本中病原真菌DNA丰度一般较低,难以用PCR方法一次性准确检测病原物的存在。鉴于此,本试验采用巢式PCR方法,用真菌通用引物对病料样品中痕量DNA进行第1轮扩增,以其扩增产物为模板,用白念珠菌特异引物进行第2轮扩增(ITS序列中的特异片段),从而提高了样本检测的敏感性和特异性。巢式PCR法在本试验的各种检测方法中阳性率最高(88%),且耗时较短,这与Emma等的结论基本一致[18]。
综上所述,在肉鸡白念珠菌病的诊断中,建议采用巢式PCR法与改良镜检法结合,既保证诊断的特异性和敏感性,又可兼顾病原侵染状态的直观性和诊断效率。在不具备上述诊断条件或对诊断时间要求不紧迫的情况下,可采用病原特异性显色培养或特征性形态观察与临床、剖检症状相结合的方法;组织病理检验可作为上述方法的补充或确定白色念珠菌感染状态的依据。
本次试验仅研究比较了肉鸡白念珠菌病的6种诊断方法,样本数量较少,在样本处理和检测中对其它病原和非病原微生物的干扰问题考虑不足,因而研究结果尤其阳性率结果可能受到一定影响,这些问题有待于后续研究改进。
[1]Ouyang KP, Liu SF, Xiao JW, et al. Research progress on the detection method ofCandidaalbicans[J]. Sci Technol Food Indust,2012, 33(8): 420-427. DOI: 10.13386/j.issn1002-0306.2012.08.106 (in Chinese) 欧阳珂珮,刘生峰,肖进文,等.白色念珠菌检测方法的研究[J].食品工业科技,2012, 33(8):420-427.DOI: 10.13386/j.issn1002-0306.2012.08.106
[2]Tan PL, Wang ZJ, Zhao JF. Resistance ofCandidaalbicansisolates against fluconazole and the resistance correlation with CAP1 gene[J]. Chin J Zoonoses, 2015, 31(4): 325-329. DOI: 10.3969/j.issn1002-2694.2015.04.007 (in Chinese) 谈潘莉,汪浙炯,赵金方.白假丝酵母菌临床菌株对氟康唑耐药性及其与CAP1基因相关性研究[J].中国人兽共患病学报,2015, 31(4):325-329.DOI: 10.3969/j.issn1002-2694.2015.04.007
[3]Gu FX, Wang QW, Feng F, et al. ITS sequence identification and isolation of theCandidaalbicansfrom stomatitis pheasant[J]. J Econom Anim, 2010, 14(3): 179-182. (in Chinese) 古飞霞,王庆伟,冯飞,等.雉鸡口角炎白色念珠菌病的诊断及病原ITS序列测定[J].经济动物学报, 2010, 14(3):179-182.
[4]Lan JX, Chen GC, Shao CL, et al. Investigation ofCandidaalbicansinfection in pigeons in Zhongshan area of Guangdong[J]. Guangdong J Anim Vet Sci, 2013, 38(3): 18-20. (in Chinese) 蓝建勋,陈桂婵,邵翠莲,等.广东中山地区养鸽场的白色念珠菌感染状况调查[J].广东畜牧兽医科技, 2013, 38(3):18-20.
[5]Zhao MQ, Shen HY, Pan W, et al. New situation and control measures of candidiasis epidemiology[J]. Sci Technical Infor Husb Vet, 2011(5): 1-4. (in Chinese) 赵明秋,沈海燕,潘文,等.念珠菌病的流行病学新动态及防控措施[J].畜牧兽医科技信息, 2011(5):1-4.
[6]Wang HF, Lu HJ, He WQ, et al. Progress on typing methods ofCandidaalbicansin molecular biological technique[J]. Progr Vet Med,2006, 27(11): 4-7. (in Chinese) 王惠芳,陆慧君,贺文琦,等.白色念珠菌分子生物学分型方法研究进展[J].动物医学进展,2006, 27(11):4-7.
[7]Oeser C, Vergnano S, Naidoo R, et al. Neonatal invasive fungal infection in England 2004-2010[J]. Clin Microbiol Infect, 2014, 20(9): 936-941. DOI: 10.1111/1469-0691.12578
[8]Li JF, Han XH, Duan XH. Research on the detection method of Candida albicans in food[J]. Sci Technol Engineer,2014,14(31): 172-175. (in Chinese) 李俊峰,韩晓红,段效辉.食品中白色念珠菌的检测方法研究[J].科学技术与工程, 2014, 14(31):172-175.
[9]Zu QC, Jin ZJ, Zhang QD. Diagnosis and treatment of candidiasis albicans in broiler chicken[J]. Chin J Vet Sci Technol, 2000, 30(12): 50. (in Chinese) 祖全成,靳兆江.张庆德.肉用仔鸡白色念珠菌病的诊治[J].中国兽医科技,2000, 30(12):50.
[10]Liu YW, Liu N, Zhang YY, et al. Establishment of a method for rapid diagnosis ofTrichophytonmentagrophytesinfection in rabbits[J]. Chin Vet Sci, 2013, 43(11): 1184-1189. (in Chinese) 刘彦威,刘娜,张永英,等.家兔须癣毛癣菌感染快速诊断方法的建立[J],中国兽医科学, 2013, 43(11):1184-1189.
[11]Min-Chih H, Kuo-Wei C, Hsiu-Jung L, et al. Species identification of medically important fungi by use of real-time LightCycler PCR[J]. J Med Microbiol, 2003, 52: 1071-1076. DOI: 10.1099 /jmm.0.05302-0
[12]Liu SQ, Xu YY, Yan Y, et al. Study of nail plate fungi microscopic examination techniques in onychomycosis[J]. Chin J Dermatovenereol, 2009, 23(5): 316-317. (in Chinese) 刘寿全,徐媛媛,阎岩,等.甲真菌病甲板真菌镜检方法的探讨[J].中国皮肤性病学杂志, 2009, 23(5):316-317.
[13]Jin Y, Zhang H, Qiao JJ. Induction of hyphal form ofCandidaalbicansinvitroby two culture media[J]. Chin J Dermatol, 2005, 38(8): 501-502. (in Chinese) 金艳,张宏,乔建军.两种培养基体外诱导白念珠菌菌丝相形成的比较[J].中华皮肤科杂志, 2005, 38(8):501-502.
[14]Shih-Chin C, Leo ABJ, Bart-Jan K, et al. Interplay betweenCandidaalbicansand the mammalian innate host defense[J]. Infect Immun, 2012, 80(4): 1304-1313. DOI: 10.1128 / IAI.06146-11
[15]Younes M, Corine H, Jean-Marc DB, et al. Rapid detection ofCandidaalbicansin clinical blood samples by using a TaqMan-based PCR assay[J]. J Clin Microbil, 2003, 41(7): 3293-3298. DOI: 10.1128/JCM.41.7.3293-3298.2003
[16]Metwally L, Hogg G, Coyle PV, et al. Rapid differentiation between fluconazole-sensitive and -resistant species ofCandidadirectly from positive blood-culture bottles by real-time PCR[J]. J Med Microbiol, 2007, 56: 964-970. DOI: 10.1099/jmm.0.47149-0
[17]Graser Y, Scott J, Summerbell R, et al. The new species concept in dermatophytes-a polyphasic approach[J]. Mycopathologia, 2008, 166(5): 239-256. DOI: 10.1007/s11046-008-9099-y
[18]Emma EMJ, Nora MC, Sarah C, et al. Rapid detection and identification ofCandida,aspergillus, andFusariumspecies in ocular samples using nested PCR[J]. J Clin Microbiol, 2000, 38(8): 2902-2908.
Comparison research on commonly experimental diagnostic methods of candidiasis albicans in broiler chicken
LIU Jian-chai,LIU Huan-zhang,LIU Yan-wei,WANG Hui-zhen,ZHANG Yong-ying
(EngineeringResearchCenterofHebeiProvinceofPoultryDisease,CollegeofAgriculture,HebeiUniversityofEngineering,Handan056021,China)
In order to study handy and quick diagnosis of candidiasis albicans of broiler chicken, assays using 50 clinical suspected samples from several chicken farms were performed by methods of KOH microscopic examination, modified KOH microscopic examination, morphological observation, TTC chromogenic culture, histologic section technique, and nested PCR technique. The positive rates of detected samples by methods above were 62.0%(31/50), 78.0%(39/50), 82.0%(41/50), 82.0%(41/50), 86%(43/50) and 88.0%(44/50), and the time drains were 1-2 hours(h), 1-2 h, 7-8 d, 6-7 d, 8-10 d and 7-8 h, respectively. By comparison of merits and demerits between different methods, a proposal of combining the nested PCR test with the modified microscopic examination is presented as a preferred embodiment for handy and quick diagnosis of candidiasis albicans in broiler chicken, which has advantages including high specificity and sensitivity, less time consumption and taking account of visualizability of the invasive pathogen.
broiler chicken;Candidaalbicans; diagnosis methods; nested PCR
Liu Yan-wei, Email: liuyw.edu@126.com
10.3969/j.issn.1002-2694.2015.12.013
河北省自然科学基金资助项目(No.C2015402157)
刘彦威,Email:liuyw.edu@126.com
河北工程大学农学院动物医学系,邯郸 056021
R378.99;S854.4
A
1002-2694(2015)12-1151-06
2015-05-20;
2015-09-03
Supported by the Natural Science Foundation of Hebei Province in China (No. C2015402157)

