基于响应面法优化一株海洋绿藻胞内多糖提取工艺
付婷婷,马 宁,蒙健宗,张云开*
(广西大学 生命科学与技术学院,广西 南宁 530004)
多糖由于其特殊结构而具有多种不同于单糖的生化特性,如增稠、乳化、保水、抗氧化、抗肿瘤、抗菌等[1-3],被广泛应用于纺织、化妆品、保健品、医药等行业中[4-6]。目前,多糖大多是从高等植物、细菌、真菌、动物和大型藻类中提取的,而对生长速度快、光合效率高、适应性强的海洋微藻中的多糖浸提工艺和条件优化的研究较为少见[7-8]。据报道,海洋微藻多糖成膜性能良好,具有一定保湿性,可作为功能性物质添加于食品、化妆品中[9-10]。在免疫学研究方面,海洋微藻多糖能促进淋巴细胞的增殖与分化、刺激巨噬细胞的吞噬、促进细胞因子、抗体的产生[11]。
早期,提取多糖采用提取效率极低的水提醇沉法,后发展了酸或碱提法,而酶法、超声波和微波辅助法,虽提取效果好,但成本高、能耗大。多数糖类物质含有较多的极性基团,使其易溶于稀酸、稀碱和水,但是酸性环境会使多糖中的糖苷键发生断裂[12-13],因此选择热碱浸提法提取微藻多糖。
在工艺优化方面,响应面法具有试验周期短、回归方程精度高,可以研究多种因素间交互作用等优点[14-16],被广泛应用于微生物培养条件的优化。因此,采用属于响应面法的Box-Behnken试验,结合Plackett-Burman试验和最陡爬坡试验,对一株自主筛选的富含胞内多糖的海洋绿藻,进行胞内多糖热碱浸提工艺的优化,确定最佳工艺条件,为进一步开发利用该海洋绿藻胞内多糖提供理论依据。
1 材料与方法
1.1 材料与试剂
小球藻(Chlorella vulgaris)命名为BH95:自广西合浦红树林海水中分离纯化。
TAP(Tris-acetate-phosphate)海水培养基:NH4Cl 0.375g/L,MgSO4·7H2O0.1g/L,CaCl2·2H2O0.05g/L,K2HPO40.108g/L,KH2PO40.054g/L,Tris2.42g/L,冰醋酸1.0mL,微量元素[17]1.0mL,灭菌海水盐度34.47‰定容至1L,自然pH。
体积分数为95%乙醇、葡萄糖、苯酚、浓硫酸、氢氧化钠(NaOH)及其他试剂均为国产分析纯。
1.2 仪器与设备
PL303电子天平:梅特勒-托利多国际股份有限公司;HV-110高压灭菌锅:日本Hirayama公司;LRH-250A生化培养箱:韶关市泰宏医疗器械有限公司;GL-21M高速冷冻离心机:湖南湘仪离心机仪器有限公司;FD-3/4冷冻干燥机:北京博医康实验仪器有限公司;HH-S4数显恒温水浴锅:金坛市医疗仪器厂;Uvmini-1240紫外可见分光光度计:日本岛津公司。
1.3 方法
1.3.1 小球藻的培养
将分离纯化的单藻克隆,接种于含100 mL培养基的250 mL三角瓶中培养5 d,再以1∶10的接种量(V/V)转接于含1 000 mL培养基的3 000 mL三角瓶中扩大培养。培养条件:生化培养箱温度(25±2)℃,光照强度4 000 lx,每天光照21 h,黑暗3 h,人工摇动3次。
扩大培养10 d至稳定期后,离心收集藻细胞,冷冻干燥,保存备用。
1.3.2 小球藻多糖提取
采用热碱浸提法提取小球藻多糖。称取一定质量的干燥藻粉,与1.50%的NaOH溶液按料液比1∶20(g∶mL)混合,80℃水浴2.00 h;5 000 r/min离心15 min,取上清液加入体积分数为95%的乙醇,醇沉比1∶3(V/V),4℃静置过夜;5 000 r/min离心15 min,弃去上清液,待沉淀干燥后复溶于蒸馏水中,制成小球藻粗多糖溶液。
1.3.3 葡萄糖标准曲线的绘制及样品多糖的测定
多糖含量采用苯酚-硫酸法[18-19]进行测定,葡萄糖标准曲线绘制:准确称取100 mg于105℃干燥至质量恒定的葡萄糖,溶解并用蒸馏水定容至1 000 mL,配制质量浓度为0.1 mg/mL葡萄糖标准溶液,分别取0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL溶液于干燥试管中,以蒸馏水补齐至1.0 mL,然后加入1.0 mL 6%的苯酚和5.0 mL浓硫酸进行显色反应,摇匀冷却,室温静置20 min,以1.0 mL的蒸馏水作为空白对照,于波长490 nm处测定其吸光度值。以葡萄糖标准曲线回归方程,计算样品中多糖质量浓度。多糖提取率计算公式如下:
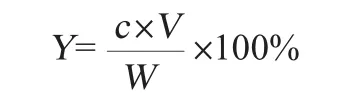
式中:Y表示胞内多糖提取率,%;c表示由标准曲线得出的多糖质量浓度,μg/mL;V表示提取定容后的总体积,mL;W表示干藻粉质量,mg。
1.3.4 单因素试验
以多糖提取率(Y)为响应值,分别研究提取时间(1.00 h、2.00 h、3.00 h、4.00 h、5.00 h、6.00 h、)、NaOH 质 量 分 数(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g∶mL))、提取温度(50 ℃、60 ℃、70℃、80℃、90℃、100℃)、乙醇体积分数(55%、65%、75%、85%、95%、100%)、醇沉比(1∶1、1∶2、1∶3、1∶4、1∶5、1∶6(V/V))对海洋绿藻胞内多糖提取率的影响。
1.3.5 Plackett-Burman试验设计
根据单因素试验,对提取时间(A)、NaOH质量分数(B)、料液比(C)、提取温度(D)、乙醇体积分数(E)、醇沉比(F)6个因素进行Plackett-Burman试验设计[20],以多糖提取率(Y)为响应值,通过Design-Expert.V8.0.6软件对试验结果进行主效应分析,试验设计因素与水平见表1。
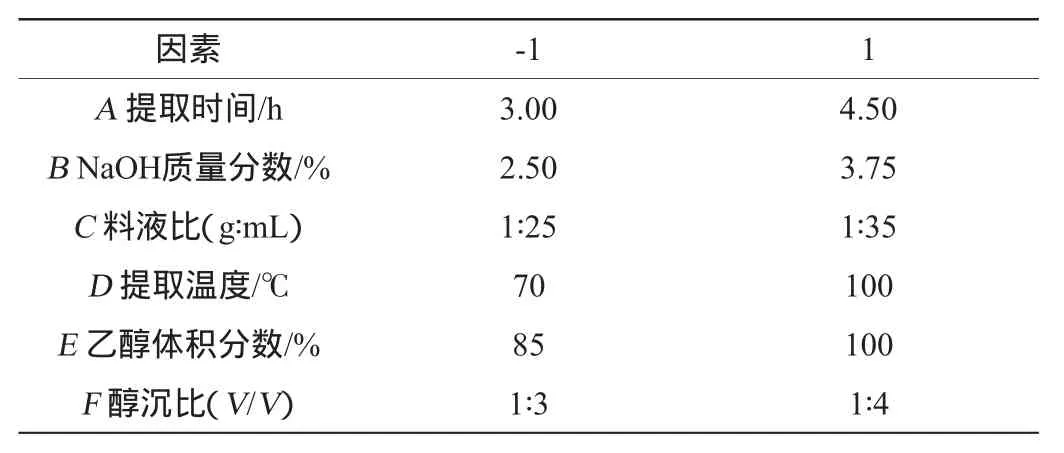
表1 Plackett-Burman试验因素与水平Table 1 Factors and levels of Plackett-Burman experiments
1.3.6 最陡爬坡试验设计[21]
根据Plackett-Burman试验结果设计最陡爬坡试验,各显著影响因素效应的大小设定步长及变化方向,以最快速逼近最佳区域。因素的取值根据各因素效应的正负和大小确定,正效应的因素均取较高值,负效应的因素均取较低值。找出多糖提取率最高的条件,即为响应面分析的中心点。
1.3.7 响应面法优化试验
根据最陡爬坡试验结果,以最陡爬坡试验中多糖提取率最大组作为试验中心点,各因素分别取高水平(+1)、中心点(0)、低水平(-1)3个水平。采用Box-Behnken中心组合设计原理设计响应面试验,试验因素与水平见表2。

表2 响应面试验因素与水平Table 2 Factors and levels of response surface experiments
2 结果与分析
2.1 葡萄糖标准曲线的绘制
以葡萄糖标准溶液质量浓度(X)为横坐标,吸光度值(Y)为纵坐标绘制葡萄糖标准曲线,结果见图1。
由图1可知,葡萄糖标准曲线线性回归方程为:Y=0.006 74X-0.021 35;相关系数R2=0.997 91,结果表明葡萄糖质量浓度和吸光度值呈良好的线性关系。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 BH95胞内多糖提取工艺单因素试验结果
分别研究提取时间、NaOH质量分数、料液比、提取温度、乙醇体积分数、醇沉比等6个因素对BH95胞内多糖提取率的影响,各影响因素试验结果如图2所示。
由图2A和2D可知,提取时间和提取温度对多糖提取率的影响趋势相同,随时间的延长、温度的提高,提取率均表现为先上升后下降,分别在3 h、70℃时达到最大,因此,多糖提取时间选择3 h,提取温度选择70℃。图2B、2F中,在一定NaOH质量分数和醇沉比范围内,多糖提取率均以相对稳定的速率增加,当NaOH质量分数超过2.5%,由于碱浓度过高,多糖降解,提取率有所下降;而醇沉比达到1∶3(V/V)时,提取率开始趋于平缓,综上分析,选择NaOH质量分数2.5%,醇沉比1∶3(V/V)。图2C中,随着碱液加入体积的增大,提取率不断增大,当料液比达到1∶25(g∶mL)后,多糖提取率有一定范围波动。考虑到综合利用和节约成本,故料液比选择1∶25(g∶mL)。由图2E可知,当乙醇体积分数在55%~75%范围内变化时,多糖提取率极低,且没有明显变化;乙醇体积分数为75%时,多糖提取率突然增加,在乙醇体积分数为95%时达到最大,后趋于稳定,故选择乙醇体积分数为95%。

图2 提取时间(A)、NaOH质量分数(B)、料液比(C)、提取温度(D)、乙醇体积分数(E)和醇沉比(F)对多糖提取率的影响Fig.2 Effects of extraction time(A),NaOH concentration(B),solid-liquid ratio(C),extraction temperature(D),ethanol concentration(E)and extraction solution to ethanol ratio(F)on polysaccharide extraction yield
2.3 Plackett-Burman试验设计及结果
依据单因素试验结果,每个因素设置高(+1)、低(-1)两个水平,进行Plackett-Burman试验。Plackett-Burman试验设计及响应值结果见表3,各因素显著性及方差分析结果见表4。
将表3试验结果进行方差分析,结果见表4。PB试验模型显著(P<0.05)。由效应值可知,提取时间、提取温度、乙醇体积分数、醇沉比表现为正效应,NaOH质量分数、料液比表现为负效应。分析贡献值和P值可得,A、B、D、E4个因素贡献值较大且P<0.05,其对多糖提取率贡献大小依次为B>D>A>E,即NaOH质量分数>提取温度>提取时间>乙醇体积分数。选择前3个为主效应因素进行下一步试验。

表3 Plackett-Burman试验设计与结果Table 3 Design and results of Plackett-Burman experiments
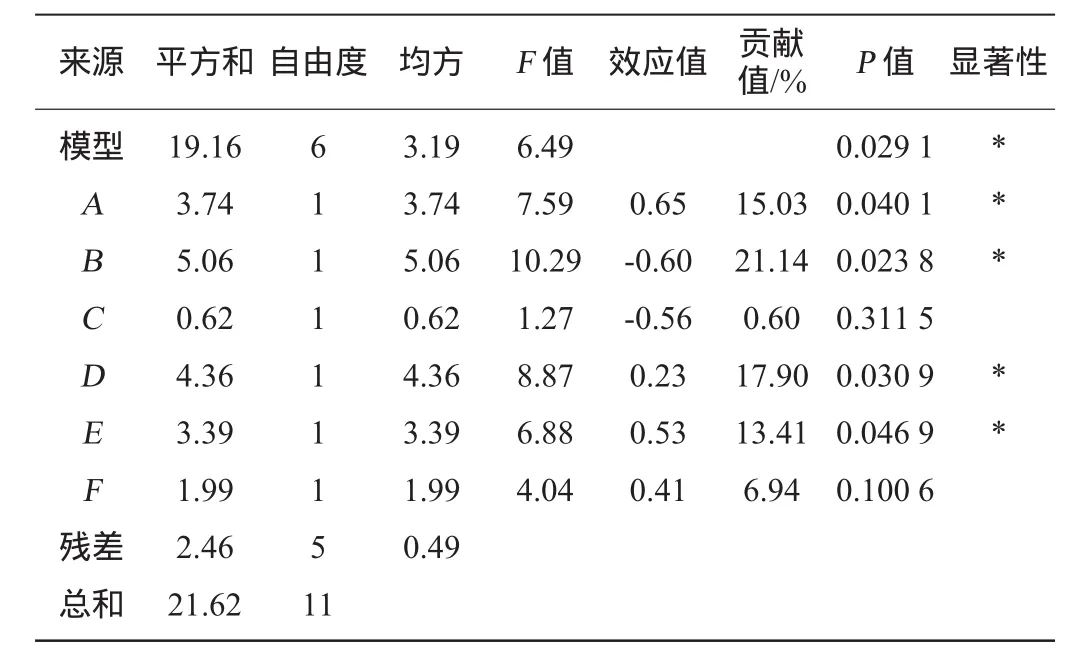
表4 Plackett-Burman试验方差分析Table 4 Variance analysis of Plackett-Burman experiments
2.4 最陡爬坡试验设计及结果
根据Plackett-Burman试验结果,以主效应因素效应值方向为爬坡方向,固定其他因素料液比1∶25(g∶mL)、乙醇体积分数95%、醇沉比1∶3(V/V),进行最陡爬坡试验。试验设计及结果见表5。
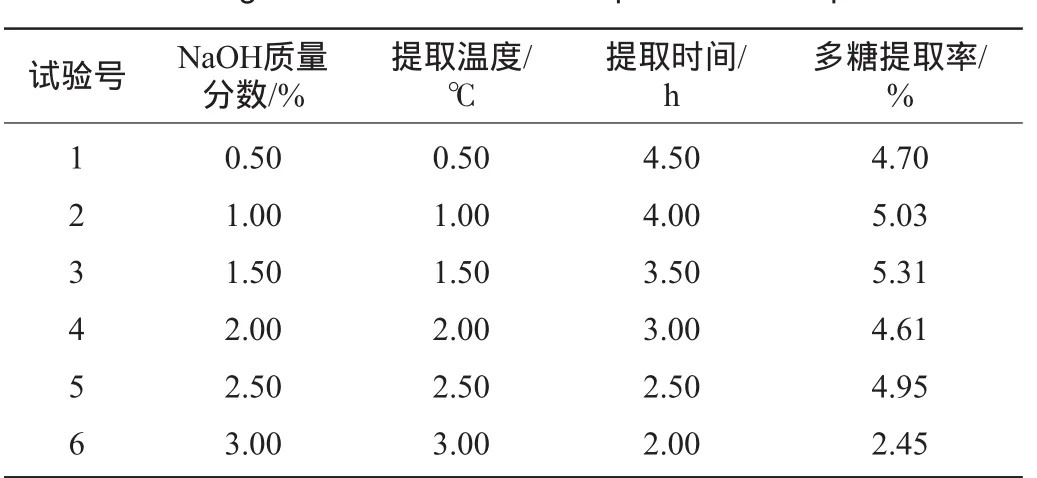
表5 最陡爬坡试验设计与结果Table 5 Design and results of the steepest ascent experiments
由表5可知,第3组的多糖提取率最高,为5.31%。因此选择第三组的水平为响应面的中心点,即NaOH质量分数1.5%、提取温度70℃、提取时间3.5 h。
2.5 响应面试验结果与分析
2.5.1 小球藻BH95胞内多糖提取率响应面试验设计及结果
根据最陡爬坡试验确定了重要影响因素的取值区间。采用Box-Benhnken中心组合设计原理设计3因素3水平响应面优化试验,试验设计与结果见表6,回归模型方差分析见表7。
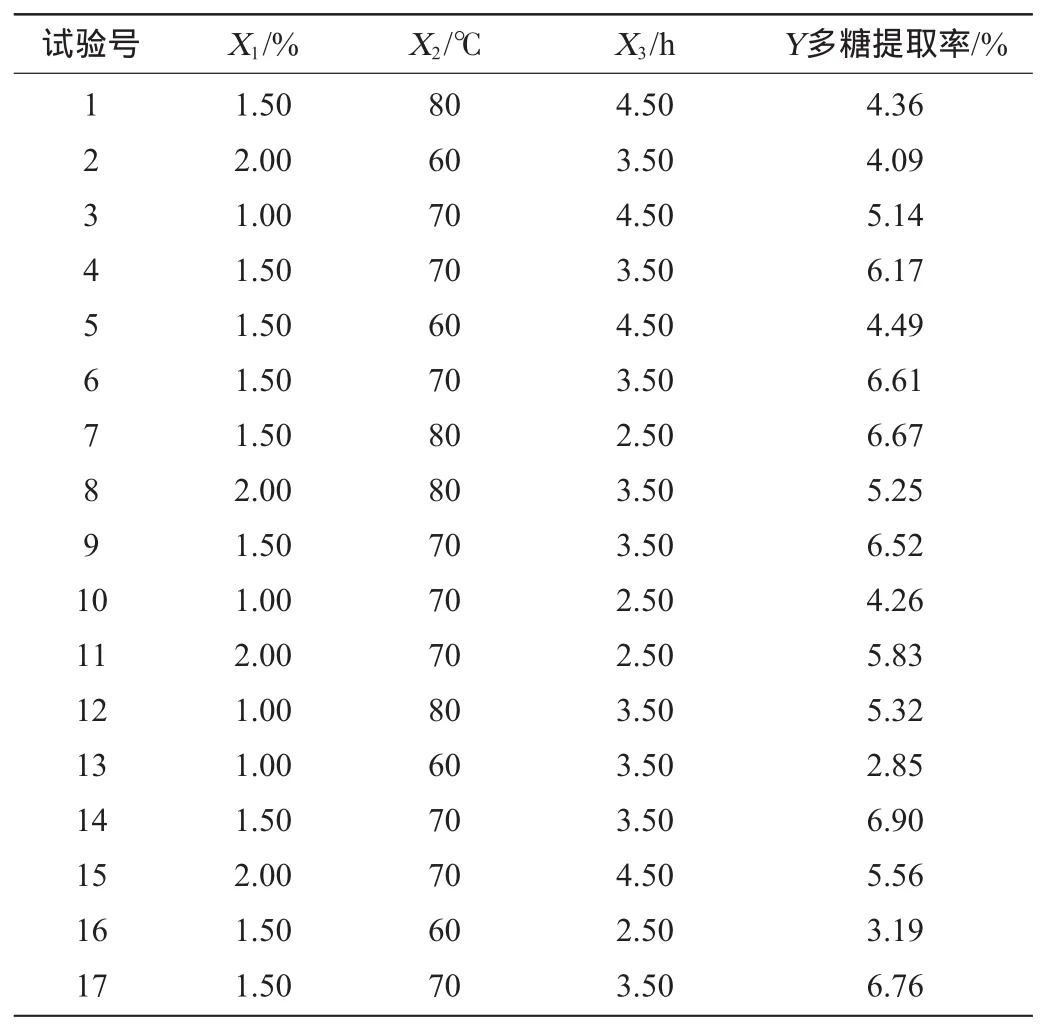
表6 Box-Behnken试验设计与结果Table 6 Design and results of Box-Behnken experiments
根据表6试验结果,运用软件Design-Expert.V8.0.6对响应值进行多元回归拟合并进行方差分析,得到小球藻BH95胞内多糖提取工艺参数回归方程为:
Y=6.59+0.40X1+0.87X2-0.05X3-0.33X1X2-0.29X1X3-0.91X2X3-0.85X12-1.37X22-0.55X32
由表7可知,该模型的决定系数R2=0.971 4>0.9,变异系数(coefficient of variation,CV)为6.10%<10%,信噪比RSN=15.380>4.0,说明该方程相关性良好、可靠性较高、试验稳定性好、试验操作可信。模型极显著(P<0.01),说明模型充分拟合试验数据,失拟项P值为0.281 3>0.05,不显著,表明试验的误差较小,未知因素对试验干扰少。综上所述,该模型能较好地对小球藻BH95胞内多糖提取工艺参数进行分析和预测。
回归模型中,因素X2、X12、X22及交互项X2X3影响极显著(P<0.01),X1、X32项影响显著(P<0.05),从F值可以看出,所选因素对多糖提取率的影响强弱次序为X2>X1>X3,即提取温度>NaOH质量分数>提取时间。

表7 回归方程方差分析Table 7 Variance analysis of regression equation
2.5.2 响应面交互作用分析
根据回归模型绘制响应曲面图,以确定NaOH质量分数、提取温度、提取时间3个因素对多糖提取率的影响,响应曲面图及等高线见图3。
三维响应曲面图可以表示响应值与试验因素的每个水平之间的函数关系,同时可从直观角度获取试验设计中的最优工艺参数[22]。由图3可知,NaOH质量分数、提取温度、提取时间两两交互作用对多糖提取率的影响均呈抛物面型关系,且响应面均存在一个极大值点。其中提取时间与提取温度之间的交互作用最为显著。
2.5.3 最佳提取工艺条件的预测与验证
经响应面法优化,软件Design-Expert.V8.0.6分析得出小球藻BH95胞内多糖提取最佳工艺条件为NaOH质量分数1.61%、提取温度74.5℃、提取时间3.02 h,此时多糖提取率预测值为6.85%。
为检验模型的可靠性,采用上述工艺条件进行验证试验,同时考虑到实际操作的可行性,将工艺条件修改为NaOH质量分数1.60%、提取温度75℃、提取时间3.00 h,进行3次平行试验,得到胞内多糖提取率为6.81%,实测值与预测值的相对误差为0.58%。试验结果与理论预测值接近,表明建立的数学模型对预测小球藻BH95胞内多糖提取条件准确可靠,具有一定实用价值。
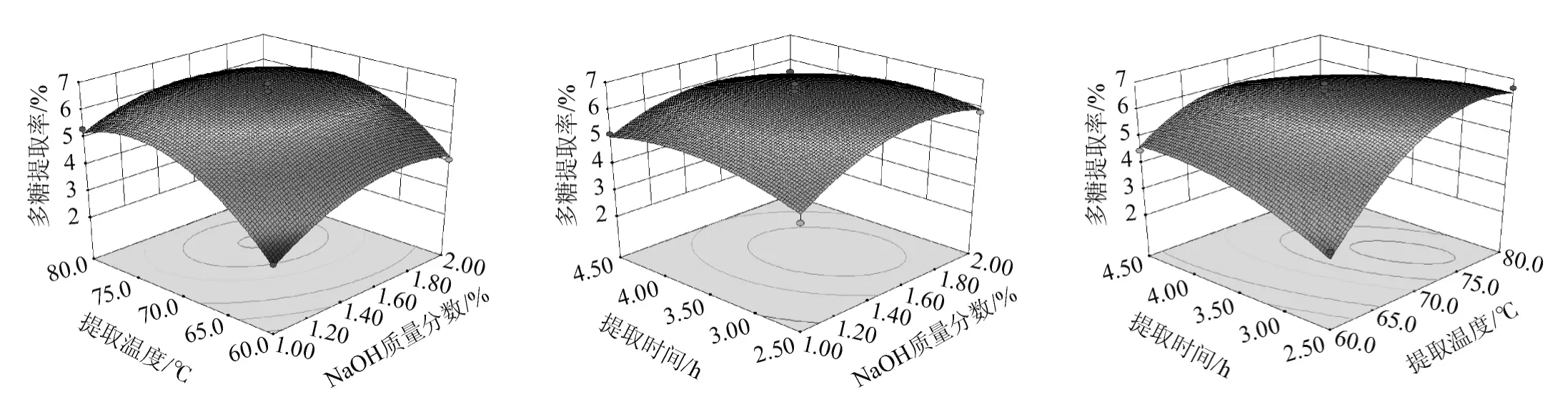
图3 NaOH质量分数、提取温度与提取时间交互作用对多糖提取率影响的响应面和等高线Fig.3 Response surface plots and contour line of effects of interaction between NaOH concentration,extraction temperature and extraction time on polysaccharide extraction yield
3 结论
根据单因素试验、Plackett-Burman试验和最陡爬坡试验,筛选出了对多糖提取率影响显著的因素:即NaOH浓度、提取温度、提取时间,并确定最佳值区域。采用响应面优化试验,通过Box-Behnken中心组合设计,建立了多糖提取率与各因素之间的数学模型,从而确定了BH95胞内多糖提取的最佳工艺参数为NaOH质量分数1.60%、提取温度75 ℃、提取时间3.00 h、料液比1∶25(g∶mL)、乙醇体积分数95%、醇沉比1∶3(V/V)。此工艺条件下,BH95胞内多糖提取率达到6.81%。因此,将响应面法应用于小球藻胞内多糖提取工艺优化是可行的,同时为小球藻多糖及小球藻生物质资源的应用开发提供了一定理论参考。
[1]BALAVIGNESWARAN C K,SUJIN JEBA KUMAR T,MOSES PACKIARAJ R,et al.Anti-oxidant activity of polysaccharides extracted fromIsocrysis galbanausing RSM optimized conditions[J].Int J Biol Macromol,2013,60:100-108.
[2]陈德力,刘平怀,时 杰,等.微藻多糖及其应用[J].现代化工,2009,29(2):224-226.
[3]NAJDENSKI H M,GIGOVA L G,ILIEV I I,et al.Antibacterial and antifungal activities of selected microalgae and cyanobacteria[J].Int J Food Sci Technol,2013,48(7):1533-1540.
[4]SINGH S,KATE B N,BANERJEE U C.Bioactive compounds from cyanobacteria and microalgae:An overview[J].Crit Rev Biotechnol,2005,25(3):73-95.
[5]陈 玮,刘启顺,李曙光,等.微藻多糖生物活性研究进展[J].中国海洋药物杂志,2012,31(3):55-60.
[6]BOROWITZKA M A.High-value products from microalgae-their development and commercialization[J].J Appl Phycol,2013,25(3):743-756.
[7]RAPOSO M,DE MORAIS R,BERNARDO DE MORAIS A.Bioactivity and applications of sulphated polysaccharides from marine microalgae[J].Marine Drugs,2013,11(1):233-252.
[8]孙利芹.紫球藻多糖的制备及其生物活性研究[D].大连:大连理工大学博士论文,2009.
[9]刘筱潇,孙颖颖,管习超.3种海洋微藻多糖提取工艺的研究[J].海洋通报,2010,29(5):524-539.
[10]汪桂林.原始小球藻分段培养条件优化及高附加值产物提取工艺研究[D].武汉:华中科技大学硕士论文,2013.
[11]周 妍,王 凌,孙利芹,等.5种海洋微藻多糖体外免疫调节活性的筛选[J].海洋通报,2010,29(2):194-198.
[12]刘四光.自养小球藻(Chlorella autotrophica)多糖提取、纯化、化学结构及抗菌活性研究[D].厦门:厦门大学博士论文,2007.
[13]BAFANA A.Characterization and optimization of production of exopolysaccharidefromChlamydomonasreinhardtii[J].Carbohyd polym,2013,95(2):746-752.
[14]王海平,黄和升,郭 雷.响应面法优化樱桃果酒发酵条件[J].中国酿造,2011,30(9):75-79.
[15]SABEEHA S,MICHAEL D A,JANETTE K.Between a rock and a hard place:Trace element nutrition inChlamydomonas[J].BBA-Mol Cell Res,2006,1763(7):578-594.
[16]潘卫仓.响应面法优化航天紫花苜蓿中叶蛋白的提取工艺[J].中国酿造,2015,34(1):80-84.
[17]SABEEHA S,MERCHANT MDA,JANETTE KROPAT.Between a rock and a hard place:Trace element nutrition inChlamydomonas[J].BBA-Mol Cell Res,2006,1763(7):578-594.
[18]贺莹莹,徐小琳,王思雨,等.响应面法优化碱提斜生栅藻多糖的提取工艺[J].石河子大学学报:自然科学版,2013,31(3):371-376.
[19]赵小霞.小球藻多糖的制备及芦苇生物活性成分的研究[D].大连:大连海洋大学硕士论文,2014.
[20]郑朋朋,李 珊,戚丽蓉,等.山楂多糖的提取及其抗氧化性作用[J].中国酿造,2015,34(6):107-113.
[21]康远军,杨 华,李 欣,等.基于响应面法的鲁氏酵母培养基优化[J].中国酿造,2015,34(4):25-29.
[22]AURORE VILLAYA C L,DIANE RORIZB,HICHAM EL ALAOUIB,et al.Optimisation of culture parameters for exopolysaccharides production by the microalgaRhodella violacea[J].Bioresource technol,2013,146:732-735.

