ABL酪氨酸激酶及突变体蛋白ABLT315I的分离纯化及活性鉴定
刘素晓,王幼平,崔琳,刘卫红,沈思,邢作英
(河南中医学院第一附属医院 中心实验室,河南 郑州 450000)
ABL酪氨酸激酶及突变体蛋白ABLT315I的分离纯化及活性鉴定
刘素晓,王幼平Δ,崔琳,刘卫红,沈思,邢作英
(河南中医学院第一附属医院 中心实验室,河南 郑州 450000)
目的 建立一种简单、稳定、高效分离纯化ABL酪氨酸激酶及其突变体ABLT315I的方法。方法abl及其定点突变基因插入pET-28a载体后,与pGEX6P-1-ptp-1b共同转化入大肠杆菌BL21感受态细胞中进行培养,加入异丙基硫代-β-D半乳糖苷(IPTG)诱导ABL酪氨酸激酶及其突变体的表达,亲和层析和凝胶过滤层析纯化蛋白,SDS-PAGE 分析蛋白纯度与相对分子量,BCA法测定蛋白浓度,ATP/NADH偶联法测定蛋白激酶活性。结果 SDS-PAGE显示ABL及ABLT315I蛋白具有很高的纯度,并且其浓度分别达到28 mg/L(LB菌液)和20 mg/L(LB菌液)。2种目的蛋白在体外均测得了很好的酪氨酸激酶活性。结论 本研究成功建立了一种稳定、简单高效的ABL蛋白及其突变体的分离纯化方法,为后续蛋白进行高通量药物筛选和结构分析建立良好的基础。
慢性粒细胞白血病;ABL蛋白;酪氨酸激酶;药物筛选
慢性粒细胞白血病(chronic myelogenous leukemia,CML)是一种起源于骨髓造血干细胞的血液系统恶性克隆疾病,约占成人白血病的20%左右。研究发现,大约有95%的CML患者中会出现Ph染色体。这个染色体的形成,是由于患者9号染色体上的abl(Abelson leukemia virus)基因与22号染色体上的bcr(breakpoint cluster region)基因相互易位形成融合基因bcr-abl,从而使abl原癌基因被激活[1]。ABL蛋白具有酪氨酸激酶的活性,但是在正常细胞中,其激酶活性是被严格调控的,而该融合过程可使ABL蛋白产生持续的酪氨酸激酶活性[2]。BCR-ABL融合蛋白在细胞信号转导以及转化过程中通过不断磷酸化和活化下游底物,促使各阶段粒细胞无限增殖和迁移,最终导致细胞生长失控,引发白血病[3-5]。
ABL蛋白是由几个结构域共同组成的一个非受体型酪氨酸激酶,它包括N端结构域(NCap)、SH2结构域、SH3结构域、一段连接序列和C末端的激酶结构域,其中正是这段激酶结构域使得ABL蛋白具有酪氨酸激酶的活性[6-7],因此,研究者们大都把目光集中在激酶结构域进行探讨,以期能够靶向治疗慢性粒细胞白血病。
当前研究中较常用的ABL蛋白活性形式的表达方法是在昆虫细胞或者其它真核细胞中进行[8],尽管昆虫细胞培养能够提供大量蛋白,但它需要的时间成本和物力成本都较高,尤其是3~4周后容易产生突变体蛋白,所以稳定性较差,重复性不好。本实验选择人源的c-ABL 1a酪氨酸激酶的64位~135位氨基酸序列作为靶点(能够表达激酶结构域),采用酪氨酸激酶和蛋白磷酸酶(PTP-1B)共表达的方法在原核系统中快速产出、表达和纯化ABL酪氨酸激酶及其突变体蛋ABLT315I。
1 材料与方法
1.1 材料和仪器 基因abl购自上海捷瑞基因合成有限公司;引物和激酶底物由上海生工生物技术有限公司合成;载体pET-28a和和大肠杆菌感受态细胞均购于北京全式金生物技术有限公司,ptp-1b-pGEX-6p-1质粒为实验室所保存。Scientz-IID超声波细胞破碎机购自宁波新芝生物科技股份有限公司;Superdex 200凝胶过滤层析柱购自GE公司;酶标仪购自Thermo fisher scientific。
1.2 目的基因的分子克隆及重组体的构建 选取abl基因的190位~1545位核苷酸序列作为目的基因,设计引物并由上海生工生物公司合成,进行PCR。上游引物序列:5′-GCGCATATGAACCTTTTCGTTGCACTGTATG-3′(Nde I酶切位点下划线标识)下游引物序列:3′-CGGAATTCTCAGACGCC-TTGTTTCCCCAG-5′(EcoR I酶切位点下划线标识)。扩增产物经琼脂糖凝胶电泳检测后进行胶回收。将回收产物和pET-28a载体分别进行Nde I和EcoR I双酶切后再连接,连接产物转化入E.coliDH5α细胞中进行培养,筛选阳性克隆提取重组质粒。将质粒送往北京奥科测序公司进行测序。
ABL蛋白的315位氨基酸T(苏氨酸)突变为I(异亮氨酸),T的密码子为ACU/ACC/ACA/ACG,I的密码子为AUA/AUC/AUU,即相对应的核酸为944位核苷酸c突变为t,即下列引物中加粗、加下划线的位点。采用部分重叠引物设计的原理设计突变引物。以abl-pET 28a质粒为模板,进行PCR。上游引物为:5′-GCCCCCGTTCTATATCATCATTGAGTTCATGAC-3′;下游引物为:3′-GTGGGCCCTCGGGGGCAAGATATAGTAGTA-5′。用DMT酶消化PCR产物,将DMT消化产物加入到DMT感受态细胞中进行转化,转化产物涂布于SOC平板中(含100 mg/L卡那霉素),37 ℃培养过夜。次日,筛选阳性克隆,提取质粒,并送往北京奥科测序公司进行测序。通过blast序列比对软件,将测序结果和基因库中的基因序列比对,观察突变位点是否正确。
1.3 重组质粒的转化 分别将质粒pET28a-abl与pGEX6P-1-ptp-1b共同转化进入E.coliBL21(DE3)感受态细胞中,将细胞涂布于含有50 μg/mL的卡那霉素和50 μg/mL的氨苄青霉素两种抗性的LB平板上,于37 ℃温箱中进行培养。
1.4 目的蛋白的表达与纯化 取共转化后LB平板上的阳性克隆接种于5 mL含有上述双抗的LB液体培养基中于37 ℃,180 r/min培养过夜。培养后的菌液接种于400 mL含有上述双抗的LB液体培养基中于37 ℃进行扩大培养,待菌液OD值达到0.4~0.6时,加入0.4 mM的IPTG于16 ℃诱导12 h,使目的蛋白得以大量表达。收集菌液进行离心(5000 r/min,30 min),弃上清,将沉淀用蛋白缓冲液[10 mM咪唑,25 mMTris(pH8.0),300 mM Nacl,20%甘油]进行重悬,超声破碎细胞(4 ℃,功率为400 w,30 min),悬液于4 ℃,15000 r/min离心30 min,收集上清液加入Ni2+亲和柱中进行结合,结合了目的蛋白的亲和柱用含有30 mM咪唑浓度的缓冲液冲洗,除去杂蛋白,接着用含有200 mM咪唑浓度的缓冲液将目的蛋白洗脱下来,通过Superdex 200凝胶过滤层析柱进一步纯化蛋白。收集纯化后的蛋白,通过10%的SDS-PAGE聚丙烯凝胶电泳检测蛋白纯度与相对分子量,然后采用BCA法测定蛋白浓度。该方法采用BSA标准蛋白进行浓度梯度稀释,根据标准蛋白液浓度与光吸收值之间的关系绘制标准曲线,根据标准曲线可以求出待测蛋白的浓度。
1.5 蛋白活性的测定 本实验采用ATP/NADH偶联的原理[9]测定蛋白激酶的活性:在ATP存在的情况下,酪氨酸多肽底物被ABL激酶磷酸化,同时,ATP转变为ADP;ADP和PEP在PK的催化作用下,生成ATP和丙酮酸;丙酮酸和NADH在LDH的作用下,生成L-乳酸和NAD+。其中NADH被消耗减少。本实验即是通过测定NADH在340 nm处的吸收值的变化,来间接测定激酶的活性。
用连续动力学法检测激酶的活性,酶活反应体系所需的缓冲液:20 mM Tris(pH8.0),50 mM NaCl,10 mM MgCl2,2 mM DTT。反应体系体积为100 μL,体系中各组分浓度为:180nM蛋白激酶,0.3 mM ATP,0.5 mM底物(底物肽段序列为:EAIYAAPFAKKK),15 U/mL PK,15 U/mL LDH,0.5 mM NADH,2 mM PEP。体系中最后加入ATP起始反应。于酶标仪上340 nm波长处测定动力学反应曲线,每隔20s测1次OD值。
2 结果
2.1 PCR及基因测序结果 如图1所示,经过PCR后获得了大量的目的基因(条带位置约1356 bp)。并且经测序,用blast序列比对软件将测序结果与Genebank(NM_005157.5)中190~1545位核苷酸序列比对,abl基因与190~1545位基因序列完全一致(图1a),而突变型基因中只有944位核苷酸为t(图中为第755位核苷酸),与原序列(c)不一致(图1b),正是本实验所需突变序列。

图1 abl基因(a)和ablc944t突变基因(b)PCR及BLAST序列分析结果Fig.1 PCR and BLAST of abl gene(a) and ablc944t (b)mutant geneM: Gene marker; abl/ablc944t: target gene
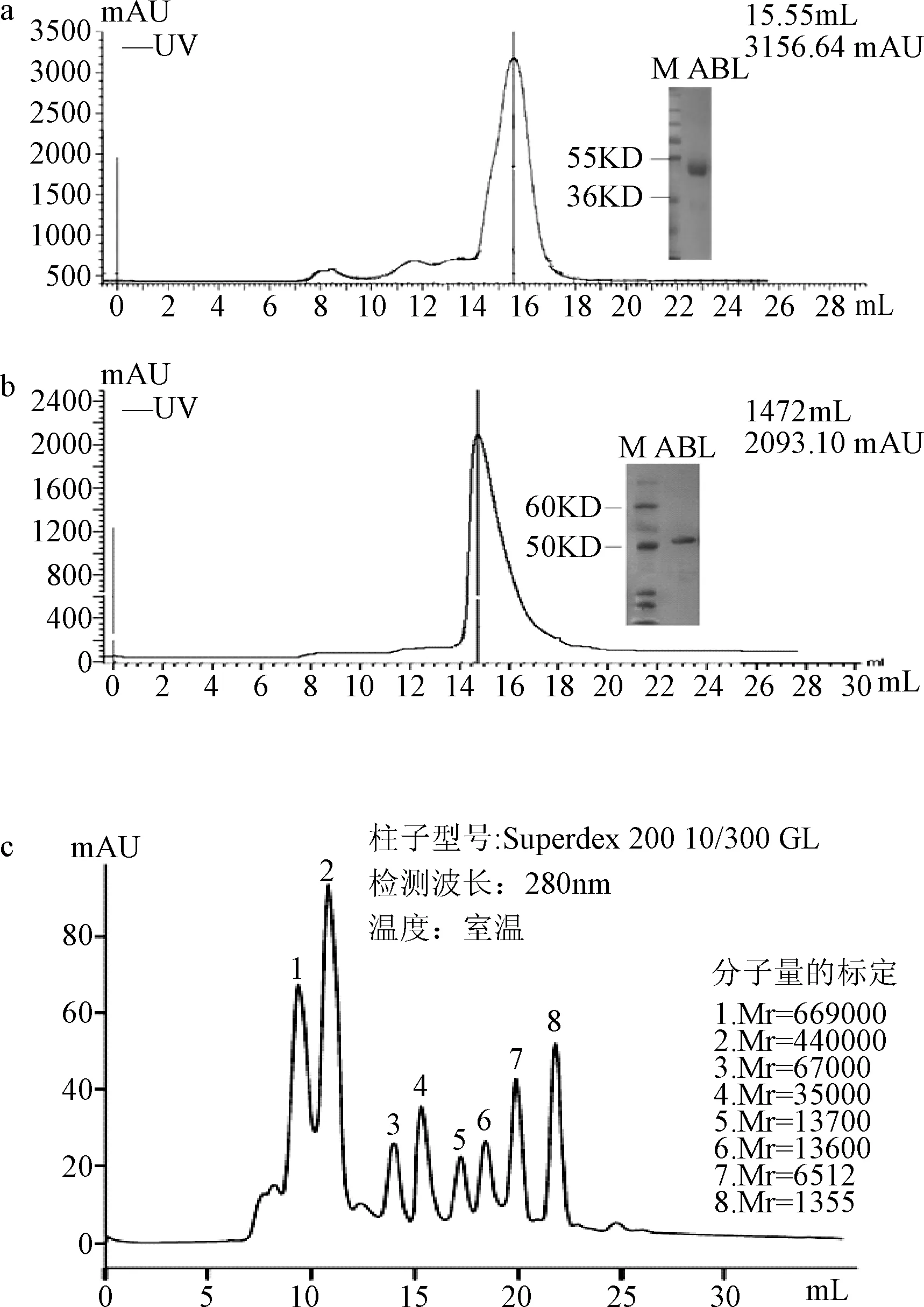
图2 ABL(a)及ABLT315I(b)凝胶过滤层析及Western blot分析;c:Superdex200层析柱标准样品图Fig.2 Gel filtration chromatography and Western blot of ABL(a) and ABLT315I(b);c: standard picture of Superdex200 chromatographic columnM:Protein marker;ABL/ABLT315I:Purified target protein
2.2 目的蛋白的纯化及分析 图2所示是ABL蛋白及ABLT315I突变体蛋白经Superdex200凝胶过滤层析柱时的紫外吸收值(UV=280 nm),从图中可以看出,蛋白大约在14 mL开始出现峰值,根据superdex200层析柱的标准峰图(2c),在14 mL左右出现的蛋白,其分子量应该介于35000 Da和67000 Da之间,结合蛋白的分子量为51 kD,出峰位置与蛋白分子量相一致。收集图中出峰位置的蛋白,经BCA法测定蛋白浓度,2者的浓度分别为28 mg/L菌液和20 mg/L菌液。再经SDS-PAGE分析,可以看到,胶片上除目的蛋白外,无明显非目的蛋白条带。
2.3 ABL蛋白激酶活性的测定 通过图3可以看出,在上述酶活体系中,不加蛋白只加底物的情况下,NADH光吸收值没有发生明显变化;当加入蛋白而不加底物时,蛋白由于发生自磷酸化作用,NADH光吸收值有一定的下降;当ABL蛋白或ABLT315I蛋白和底物都加入到体系后,NADH光吸收值明显下降;说明本实验通过原核表达系统获得的蛋白具有较好的酪氨酸激酶活性。

图3 ABL(a)及ABLT315I(b)蛋白的酶活测定曲线Fig.3 The curve of ABL(a) and ABLT315I(b) tyrosine kinase activity
3 讨论
ABL酪氨酸蛋白激酶作为细胞信号转导过程中一个重要的因子,其与BCR融合形成的BCR-ABL融合蛋白在CML的发病机制中起着至关重要的作用,以它作为靶点来进行研究,使靶向治疗CML显得非常有意义。
患者体内ABL蛋白发生的一些突变使得CML的治疗变得有些困难。目前已开发出一些基于ABL蛋白的抑制剂,包括伊马替尼(imatinib),尼洛替尼(nilotinib),博舒替尼(bosutinib)等,均对ABL蛋白有很好的抑制作用,但由于蛋白一些位点的突变,使得部分患者产生耐受现象[10-12]。普纳替尼(ponatinib)既对野生型BCR-ABL的活性有效,也能抑制T315I突变体的活性[13],但存在严重的血栓和血管堵塞等危及生命的副作用。目前临床上仍然没有一个靶向性强,安全性高,且对所有蛋白突变体有效的药物。
ABL蛋白的突变主要发生在几个氨基酸位点,如Y253H,E255V、E255K,F359V,T315I,其中T315I突变是最经常发生的[14-15],而且是目前的药物最难克服的突变。因此本实验选择野生型和T315I突变型蛋白作为靶点进行有关研究。
本实验在没有进行蛋白共表达之前,采用原核表达系统对ABL蛋白进行表达,结果发现,ABL酪氨酸蛋白激酶得到了大量表达(大约100 mg/L菌液),但这些蛋白都是以包涵体的形式存在的。接着采用变性、复性的方法重新对包涵体进行溶解、纯化,但是结果表明,最后得到的蛋白都是无活性的,不利于后期酶活体系的优化及药物的筛选。这种蛋白的低产出率可能是由于在原核表达系统中ABL蛋白激酶产生不可控的活性,导致其产生毒性。
为了增加有活性、可溶性蛋白的产物,本研究选择ABL蛋白激酶与蛋白磷酸酶共表达的方法。之所以选择PTP-1B磷酸酶,是因为该酶是一种特异性的酪氨酸磷酸酶,能够在体内抑制ABL蛋白的自磷酸化作用,并且增加蛋白的可溶性[16]。本实验选择能够表达ABL蛋白激酶结构域的63~135位氨基酸序列进行研究,更能客观地测定激酶的活性。在原核细胞中共表达后,通过蛋白纯化,获得了浓度和纯度均比较高的蛋白。可以用于后续对蛋白进行晶体结构的研究。
通过表达和纯化后得到的蛋白是没有发生磷酸化的激酶,在ATP存在的情况下,蛋白激酶可以迅速发生自磷酸化和磷酸化底物。对激酶活性进行测定时,本研究采用ATP/NADH偶联的方法间接测定蛋白的酪氨酸激酶活性。因为该方法已经比较成熟,被很多研究者使用。这种方法属于动力学法检测酶的活力。通过测定,ABL蛋白以及ABLT315I突变体蛋白在酶活体系中均表现出较好的活性,说明通过该方法获得的蛋白具有很好的酪氨酸激酶活性。
总之,本研究中选择蛋白共表达的方法,在原核表达系统中获得大量可溶性的ABL蛋白及ABLT315I突变体蛋白,并且蛋白的纯度和活性均较好。相对于昆虫细胞培养和其他原核表达系统的培养、纯化方法,此方法成本低,重复性好,接下来,需要研究的是进一步优化整个酶活体系,更利于进行对抑制剂的筛选工作。并且需要从晶体方面对蛋白和抑制剂的结构进行阐释,使分子靶向治疗CML的机理更加明确。
[1] Goldman JM.Chronic myeloid leukemia:a historical perspective[J].Semin Hematol,2010,47(4):302-311.
[2] Colicelli J.ABL tyrosine kinases:evolution of function,regulation,and specificity[J].Sci Signal,2010,3(139):re6.
[3] Hehlmann R,Hochhaus A,Baccarani M,et al.Chronic myeloid leukaemia[J].Lancet,2007,370(9584):342-350.
[4] Wong S,Witte ON.The BCR-ABL story:bench to bedside and back[J].Annu Rev Immunol,2004,22:247-306.
[5] Greuber EK,Smith-Pearson P,Wang J,et al.Role of ABL family kinases in cancer:from leukaemia to solid tumours[J].Nat Rev Cancer,2013,13(8):559-571.
[6] Dolker N,Gorna MW,Sutto L,et al.The SH2 Domain Regulates c-Abl Kinase Activation by a Cyclin-Like Mechanism and Remodulation of the Hinge Motion[J].PLOS Computational Biology,2014,10(10):e1003863.
[7] Gonfloni S.Defying c-Abl signaling circuits through small allosteric compounds[J].Frontiers in Genetics,2014,5:392.
[8] Aleem SU,Craddock BP,Miller WT.Constitutive Activity in an Ancestral Form of Abl Tyrosine Kinase[J].PLOS ONE,2015,10(6):e0131062.
[9] Lacob RE,Zhang J,Gray NS,et al.Allosteric Interactions between the Myristate-and ATP-Site of the Abl kinase[J].PLOS ONE,2011,6(1):e15929.
[10] An X,Tiwari AK,Sun Y,et al.BCR-ABL tyrosine kinase inhibitors in the treatment of Philadelphia chromosome positive chronic myeloid leukemia:a review[J].Leukemia research,2010,34(10):1255-1268.
[11] Fava C,Rege-Cambrin G,Saglio G.The choice of first-line chronic myelogenous leukemia treatment[J].Ann Hematol,2015,94(Suppl 2):S123-S131.
[12] Golemovic M,Verstovsek S,Giles F,et al.AMN107,a novel aminopyrimidine inhibitor of Bcr-Abl,has in vitro activity against imatinib-resistant chronic myeloid leukemia[J].Clin Cancer Res,2005,11(13):4941-4947.
[13] O′hare T,Shakespeare W C,Zhu X,et al.AP24534,a pan-BCR-ABL inhibitor for chronic myeloid leukemia,potently inhibits the T315I mutant and overcomes mutation-based resistance [J].Cancer cell,2009,16 (5):401-412.
[14] Hantschel O,Superti-Furga G.Regulation of the c-Abl and Bcr-Abl tyrosine kinases[J].Nat Rev Mol Cell Biol,2004,5:33-44.
[15] Xianming D,Sang ML,Jianming Z,et al.Broad spectrum alkynyl inhibitors of T315I Bcr-Abl[J].Bioorg Med Chem Lett,2010,20(4):4196-4200.
[16] Chen S,Dumitrescu TP,Smithgall TE,et al.Abl N-terminal cap stabilization of SH3 domain dynamics[J].Biochemistry,2008,47(21):5795-5803.
(编校:谭玲)
Isolation, purification and activity identification of ABL tyrosine kinase and ABLT315Imutant
LIU Su-xiao, WANG You-pingΔ, CUI Lin, LIU Wei-hong, SHEN Si, XING Zuo-ying
(Central Lab, The First Affiliated Hospital of Henan University of TCM, Zhengzhou 450000, China)
ObjectiveTo establish a simple, stableand effective method for the isolation and purification of ABL tyrosine kinase and its mutant ABLT315I.MethodspET-28a vector was inserted inablgene or its site directed mutagenesis.Then Escherichia coli BL21 competent cells were co-transformed with pGEX6P-1-ptp-1b and pET28a-abl/pET28a-ablc944t.The transformed BL21 cells were incubated, and then were stimulated with Isopropyl-β-D-thiogala-ctopyranoside (IPTG) to express ABL tyrosine kinase and its mutant.The ABL tyrosine kinase and its mutant was purified by affinity chromatography and gel filtration chromatography.SDS-PAGE was used to detect the purity and relative molecular weight of ABL tyrosine kinase and its mutant.BCA method was used to determine the concentration of ABL tyrosine kinase and its mutant.Finally, kinase activity of target protein was examined by ATP/NADH coupling method.ResultsSDS-PAGE showed the high purity of ABL tyrosine kinase and its mutant.The concentration of ABL and ABLT315Iprotein was reached 28mg/L of LB and 20mg/L of LB, respectively.Both of the target protein was measured to have good tyrosine kinase activity in vitro.ConclusionA simple, stable and effective method for the isolation and purification of ABL tyrosine kinase and its mutant was found successfully in the study, which laying good foundation for High Throughput Drug Screening and structure analysis of protein subsequently.
chronic myelogenous leukemia; ABL protein; tyrosine kinase; drug screening
刘素晓,女,硕士,研究方向:药理学、分子生物学,E-mail::xiaosuliuami@163.com;王幼平,通讯作者,男,博士,教授,硕士生导师,研究方向:高血压病的防治,E-mail::wangyp8@163.com。
Q819
A
1005-1678(2015)08-0019-04

