大黄素体外对小鼠免疫细胞的影响及其溶血作用
田一含,乔瑞红,谢鲲鹏,谢明杰
(辽宁师范大学 生命科学学院,辽宁省生物技术与分子药物研发重点实验室,辽宁 大连 116081)
大黄素体外对小鼠免疫细胞的影响及其溶血作用
田一含,乔瑞红,谢鲲鹏,谢明杰Δ
(辽宁师范大学 生命科学学院,辽宁省生物技术与分子药物研发重点实验室,辽宁 大连 116081)
目的 探讨大黄素对小鼠免疫功能的影响及其溶血毒性。方法 制备并体外培养小鼠特异性免疫细胞T、B淋巴细胞及非特异性免疫细胞巨噬细胞、NK细胞,采用浓度为5、10、15、20 μM的大黄素分别处理各免疫细胞,另设DMSO为对照组,采用中性红法和MTT法检测大黄素对免疫细胞功能的影响。采用浓度为20、40、60、80 μM的大黄素进行体外溶血实验,以生理盐水为空白对照组,以无菌蒸馏水为阳性对照组,观察大黄素的溶血毒性。结果 与对照组比较,5、10、15、20 μM组对T、B淋巴细胞增殖的影响差异均不具有统计学意义(F=0.009,P=1.000;F=0.003,P=1.000),各剂量组提高巨噬细胞吞噬能力且呈浓度依赖性(F=665.525,P=0.000),提高巨噬细胞增殖率且呈浓度依赖性(F=134.812,P=0.000),提高NK细胞活性且呈浓度依赖性(F=200.190,P=0.000)。溶血实验结果显示,大黄素在20~80 μM浓度范围内,溶血率测定结果均小于5%。结论 大黄素能显著促进小鼠非特异性免疫细胞的活性,在大黄素发挥有效活性的浓度范围内,对红细胞无溶血毒性。
大黄素;特异性免疫细胞;非特异性免疫细胞;体外;溶血毒性
免疫功能是人体及其重要的自卫功能,能抵御各种疾病的发生和发展,因此获得具有提高机体自身免疫系统的药物,是最终治愈疾病的有效方法[1]。长期以来,中药以其较好的生物活性,较低的毒副作用和具有提高机体免疫活性等作用,成为各国学者获取有效药物的主要来源[2]。已有研究表明,革皮氏海参皂苷、藏药绿萝花水提物、樟芝多糖、茵陈蒿等中药提取物都可以提高机体免疫活性[3-6]。大黄素(emodin,EM)主要来源于蓼科植物虎杖和掌叶大黄的根茎和根中[7-8]。近年来的研究发现,大黄素具有广泛的药理学功效,包括抗肿瘤、抗氧化、抗炎和抑菌等活性[9]。本实验室前期对大黄素的抗肿瘤作用和抑菌作用进行了深入的研究,抗肿瘤实验结果显示,大黄素可通过干预ERα-MAPK/Akt-cyclin D1/Bcl-2信号转导途径来抑制乳腺癌细胞的增殖[10]。抑菌实验结果显示,大黄素对金黄色葡萄球菌的抑制作用主要是通过对其细胞膜通透性的破坏、菌体内蛋白质的合成及代谢关键酶活性的抑制等多种途径来实现[11]。但目前关于大黄素对免疫的调节作用研究较少,因此,本文对大黄素体外对小鼠免疫细胞的影响及其溶血作用进行了研究,旨在为研究大黄素的药理作用提供理论依据。
1 材料与方法
1.1 材料
细胞:K562细胞由中国医学科学院基础研究所细胞中心提供;
动物:雄性的ICR小鼠(SPF级)1只,5周龄,体质量20 g,由大连医科大学提供,合格证号:SCXK Liao 2008-0002;
试剂:大黄素(纯度≥98%)购于中国食品药品检定研究院;新生牛血清购于Gibco公司;DMSO、四甲基偶氮唑盐(MTT)、RPMI-1640购于Sigma公司;PBS缓冲液、红细胞裂解液、中性红、D-Hank’s液、BSA购于上海生工生物工程有限公司;尼龙毛柱购于伊普瑞斯科技有限公司。人的新鲜血液由大连市红十字血液中心提供。
仪器:Multican Ascent酶标仪型(Thermo公司);UV1102型紫外分光光度计(上海天美科技仪器有限公司)。
1.2 方法
1.2.1 大黄素对小鼠T、B淋巴细胞增殖的影响:① 小鼠T、B淋巴细胞分离:小鼠T、B淋巴细胞分离参照高巍等[12]的尼龙毛柱法:脱颈处死小鼠,取出脾脏,研磨,离心,去上清,加入红细胞裂解液室温静置5 min。用培养液调整细胞密度为5×108个/mL,将脾细胞悬液上柱,待细胞全部滴入柱内,孵育1 h,培养液(30 mL)洗柱,流出的细胞为T淋巴细胞,柱内细胞为B淋巴细胞,分别收集,离心,含15%新生牛血清的RPMI-1640培养液重悬,备用;
② 大黄素处理小鼠T、B淋巴细胞:用含15%新生牛血清的RPMI-1640培养液调整T、B淋巴细胞密度为2×106个/mL,以每孔200 μL接种到96孔板中待细胞贴壁后,采用终浓度为5、10、15、20 μM的大黄素处理,以1‰ DMSO为对照组。于37 ℃,5% CO2培养箱中培养48 h后,每孔加入20 μL MTT,孵育4 h,弃上清,每孔加入150 μL DMSO,酶标仪测定495 nm 下的吸光度值,每组设置3个复孔。按照下列公式计算:相对增殖率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.2.2 大黄素对小鼠腹腔巨噬细胞吞噬能力及增殖的影响:① 制备小鼠巨噬细胞:小鼠巨噬细胞的制备参照荣岳光[13]的实验方法:脱颈处死小鼠,于75%乙醇中浸泡5~10 min,注射5~8 mL D-Hank’s 液,将腹腔液吸到离心管中,1000 r/min离心3 min,弃上清,加红细胞裂解液重悬,静置3~5 min,离心,弃上清,收集细胞,15%新生牛血清RPMI-1640 培养液培养24 h,得到贴壁细胞为腹腔巨噬细胞;
② 大黄素处理小鼠巨噬细胞:调整腹腔巨噬细胞密度为 2×106个/mL。分组及处理方法同1.2.1项下②,培养48 h后,加入200 μL 0.09%的中性红溶液孵育3 h,用PBS冲净未被吞噬的中性红,各孔加入200 μL细胞裂解液,室温过夜培养,酶标仪测定495 nm下的吸光度值,每组设置3个复孔。按照下列公式计算:相对细胞吞噬率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
③ 同1.2.1项下②的方法及公式,测定巨噬细胞的相对增殖率。
1.2.3 大黄素对小鼠NK细胞活性的影响:① 制备小鼠NK细胞:制备小鼠NK细胞(脾细胞);无菌取小鼠脾脏,剪碎、研磨、离心、洗涤后悬于含5%BSA的15%新生牛血清RPMI-1640 培养液。
② 大黄素处理小鼠NK细胞:调整效应细胞(NK细胞)密度为5×106个/mL和靶细胞(K562细胞)密度为1×105个/mL。设NK细胞组、K562细胞组及混合组(NK细胞+K562细胞),NK细胞组、K562细胞组取相应细胞100 μL接种到96孔板中,加培养液100 μL,混合组取NK细胞、K562细胞各100 μL(50:1),接种到96孔板中。大黄素浓度及处理方法同1.2.1项下②,培养48 h后,MTT法检测细胞活性的方法同1.2.1项下②。按照下列公式计算NK细胞活性(%)=[1-(A混合组-ANK细胞)/AK562细胞]×100%。
1.2.4 大黄素体外溶血实验:①制备人红细胞:取10 mL人的新鲜血液,1000 r/min离心10 min,弃去上清液。沉淀的红细胞再用生理盐水洗3次,将所得红细胞用生理盐水配成2.0%的混悬液备用;②大黄素处理红细胞:分别用20、40、60、80 μM大黄素处理配制好的红细胞悬液,均匀混合后,放入37 ℃恒温水浴孵育60 min,后1800 r/min离心10 min。取出离心管用肉眼观察,如果细胞全部沉淀在管底,上清液为无色透明,表明未发生溶血现象,记为“-”。反之,管底只有少量或无细胞残留,上清液为红色,则表明发生了溶血现象,记为“+”。取上清,用紫外分光光度计测定波长540 nm下的A值,溶血率<5%,可认为未引起体外红细胞明显溶血。以生理盐水为空白对照组,以无菌蒸馏水为阳性对照组,每组设3个平行复孔。按照下列公式计算溶血率:溶血率(%)=(A实验组-A生理盐水组)/(A蒸馏水组-A生理盐水组)×100%。
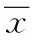
2 结果
2.1 大黄素对T淋巴细胞和B淋巴细胞增殖的影响 用0、5、10、15、20 μM浓度的大黄素处理小鼠脾脏T淋巴细胞和B淋巴细胞后,各实验组吸光度值如下:T淋巴细胞为(1.89±0.044)、(1.894±0.044)、(1.895±0.043)、(1.896±0.044)、(1.896±0.043)(F=0.009,P=1.000),B淋巴细胞为(1.737±0.042)、(1.739±0.042)、(1.739±0.043)、(1.74±0.043)及(1.741±0.043)。大黄素对T淋巴细胞和B淋巴细胞增殖无显著影响。小鼠脾脏T淋巴细胞和B淋巴细胞用5、10、15、20 μM浓度的大黄素处理后,与对照组相比,B淋巴细胞增殖率分别提高了(0.10±0.01)%、(0.11±0.02)%、(0.18±0.03)%和(0.21±0.09)%,T淋巴细胞增殖率分别提高了(0.23±0.03)%、(0.25±0.06)%、(0.31±0.02)%和(0.32±0.04)%。见图1。
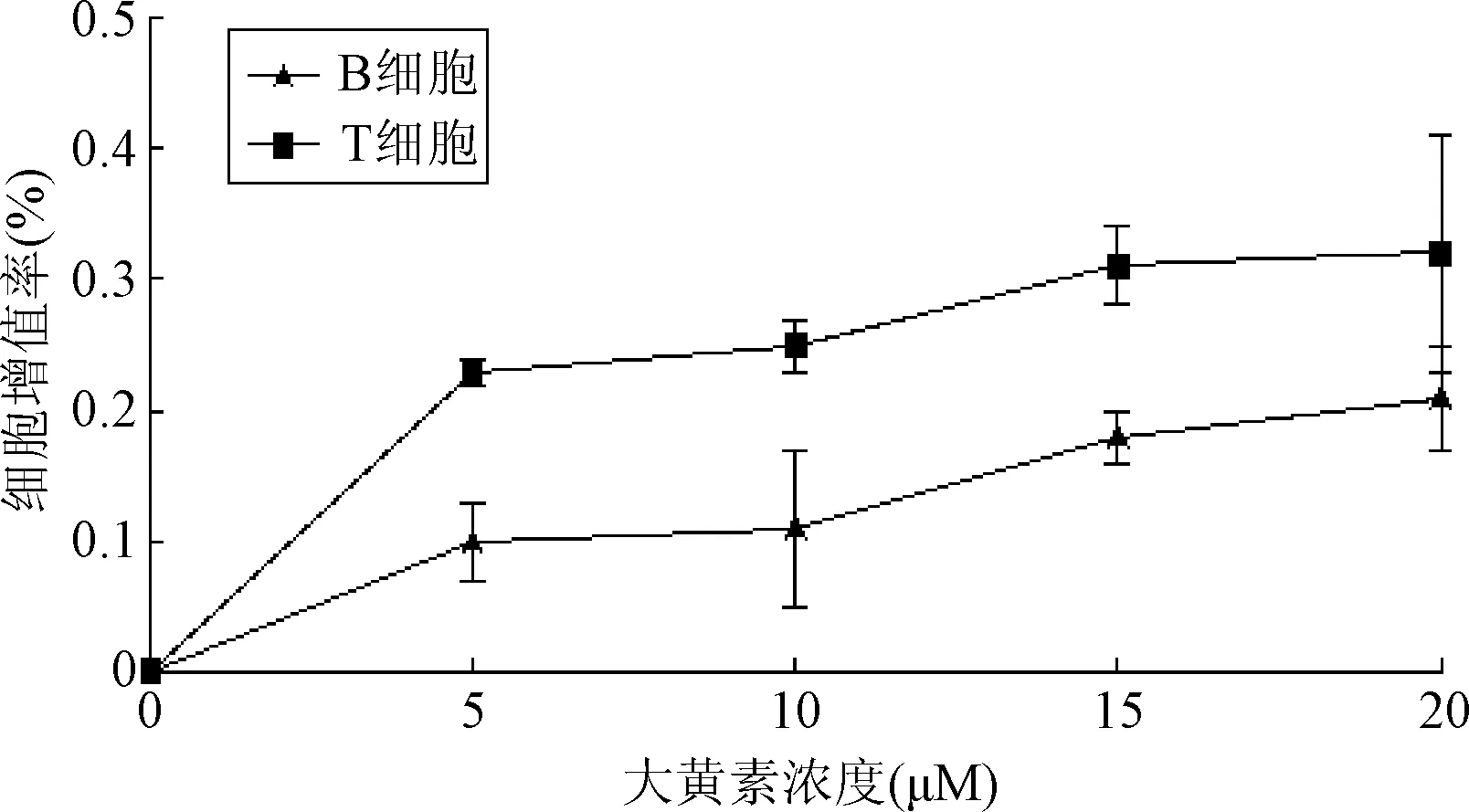
图1 大黄素对T、B淋巴细胞增殖的影响(n=3)Fig.1 The effect of emodin on proliferation of T,B lymphocyte(n=3)
2.2 大黄素对小鼠腹腔巨噬细胞吞噬能力的影响 腹腔巨噬细胞用5、10、15、20 μM浓度的大黄素处理后,与对照组相比,吞噬能力分别提高了(56.38±4.53)%、(87.03±4.12)%、(139.46±2.87)%和(188.35±3.92)%。4个不同剂量组对巨噬细胞吞噬能力的影响差异具有统计学意义(F=665.525,P=0.000),且呈浓度依赖性。见图2。

图2 大黄素对巨噬细胞吞噬能力的影响(n=3)*P<0.05,与5 μM组比较;#P<0.05,与10 μM组比较;△P<0.05,与15 μM组比较Fig.2 The effect of emodin on phagocytosis of macrophages(n=3)*P<0.05,compared with 5 μM group;#P<0.05,compared with 10 μM group;△P<0.05,compared with 15 μM group
2.3 大黄素对巨噬细胞增殖的影响 腹腔巨噬细胞用5、10、15、20 μM浓度的大黄素处理后,与对照组相比,增殖率提高了(4.82±0.37)%、(7.96±0.29)%、(13.63±0.93)%和(19.46±1.62)%。4个不同剂量组对巨噬细胞增殖率的影响差异具有统计学意义(F=134.812,P=0.000),且呈浓度依赖性。见图3。
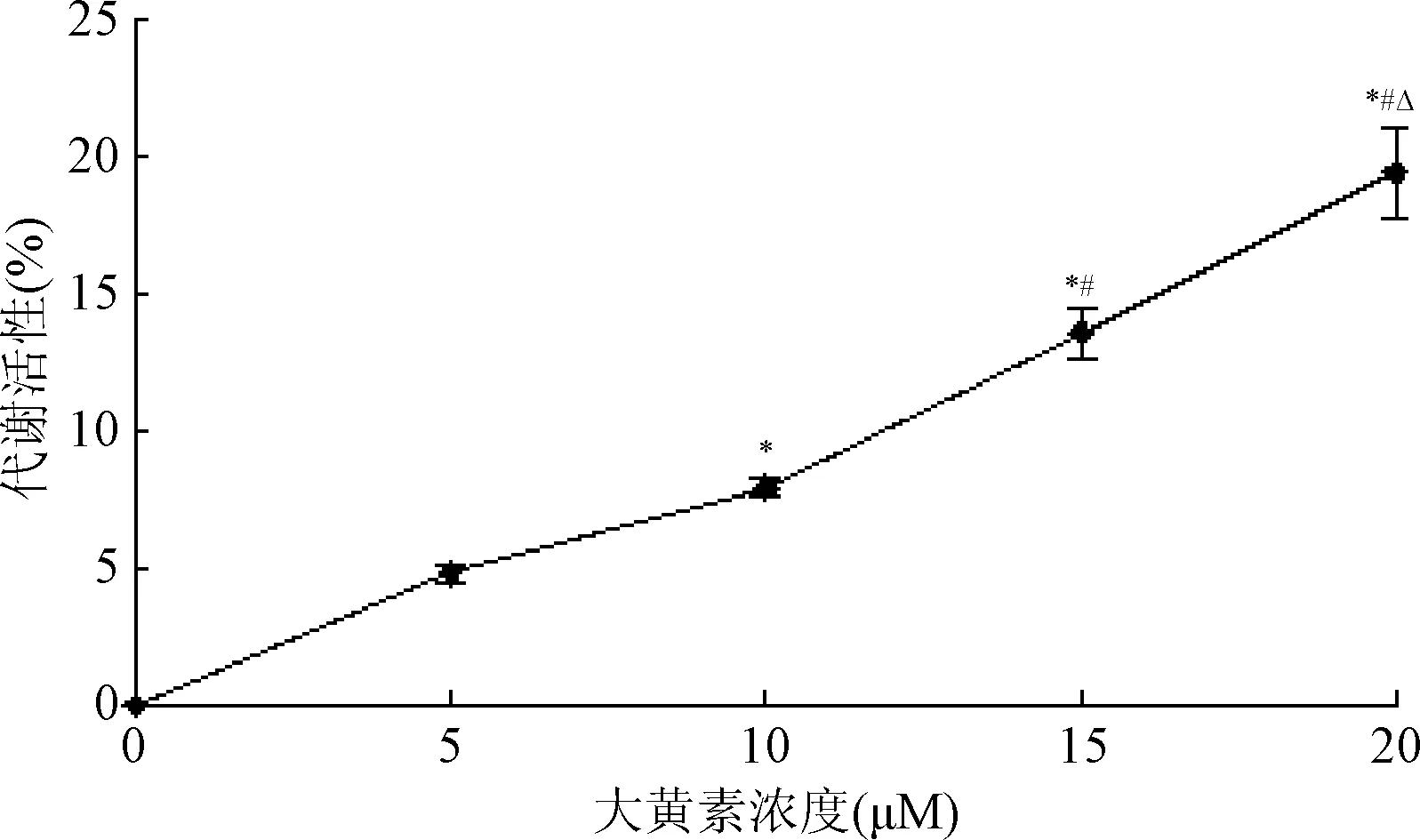
图3 大黄素对巨噬细胞代谢活性的影响(n=3)*P<0.05,与5 μM组比较;#P<0.05,与10 μM组比较;△P<0.05,与15 μM组比较Fig.3 The effect of emodin on energy metabolism of macrophages(n=3)*P<0.05,compared with 5 μM group;#P<0.05,compared with 10 μM group;△P<0.05,compared with 15 μM group
2.4 大黄素对NK细胞活性的影响 5、10、15、20 μM的大黄素作用NK细胞后,NK细胞的活性分别提高了(4.35±0.43)%、(6.59±0.92)%、(12.86±0.98)%和(21.73±1.28)%。4个不同剂量组对NK细胞活性的影响差异具有统计学意义(F=200.190,P=0.000),且呈浓度依赖性。见图4。

图4 大黄素对小鼠NK细胞活性的影响(n=3)*P<0.05,与5 μM组比较;#P<0.05,与10 μM组比较;△P<0.05,与15 μM组比较Fig.4 Effect of emodin on proliferation of NK cell in mice(n=3)*P<0.05,compared with 5 μM group;#P<0.05,compared with 10 μM group;△P<0.05,compared with 15 μM group
2.5 大黄素的体外溶血实验 溶血实验结果显示,大黄素在20~80 μM浓度范围内,通过肉眼观察无溶血现象。因为溶血率测定结果均小于5%,说明大黄素不能引起体外红细胞溶血。见表1。
表1 大黄素体外溶血实验结果±s,n=3)Tab.1 The hemolytic results of emodin in ±s,n=3)
3 讨论
寻找生物活性高,不良反应小,且能提高机体免疫力等功效的天然药物是当今医学研究的热点,机体的免疫功能对保证机体维持内环境的平衡稳定和疾病的治愈发挥着重要作用[2]。大黄素具有多种生理活性,是临床上应用十分广泛的药物之一,大黄素对机体免疫细胞的调节作用,对其今后的进一步应用具有重要的影响。机体免疫包括特异性免疫与非特异性免疫,其中非特异性免疫细胞主要为巨噬细胞和NK细胞。特异性免疫细胞主要为B淋巴细胞和T淋巴细胞。巨噬细胞是机体内具有吞噬功能的一类细胞的总称,已有的研究表明,巨噬细胞可释放TNF-α、ROS等肿瘤杀伤分子,在调节机体免疫、吞噬和杀伤肿瘤细胞过程中发挥着重要的作用[13-14]。NK能识别并攻击与正常细胞不同的任何膜表面发生变化的细胞,如肿瘤细胞、病毒感染细胞、较大的病原体和同种异体移植的器官、组织等[15]。本研究结果显示,大黄素可明显提高腹腔巨噬细胞的吞噬能力、代谢活力及NK细胞的活性,呈剂量依赖性,对机体的非特异性免疫具有促进作用。但大黄素对T淋巴细胞和B淋巴细胞的作用不明显。
溶血实验是研究药物毒性必须兼顾的实验,因为有些药物可使机体产生溶血现象和凝聚现象,引起血液循环功能障碍,导致机体不良反应。本文的溶血实验结果显示,在药物发挥有效作用的4倍浓度范围内,溶血率均小于5%。
由于大黄素对机体免疫系统具有显著的促进作用,使其在未来的应用中具有巨大的潜力和不可替代的优势,但关于大黄素提高机体免疫功能的作用机制还需进一步研究。
[1] 杨青,陈东生.免疫调节药在肿瘤患者住院治疗中的应用分析[J].医药导报,2007,26(11):1372-1374.
[2] 薛那,沈国顺,赵福,等.中药免疫调节作用研究进展[J].中国畜牧兽医,2008,35(5):84-86.
[3] 王静凤,傅佳,王玉明,等.革皮氏海参皂苷对小鼠免疫功能的调节作用[J].中国海洋大学学报,2010,40(2):28-32.
[4] 杨荣,刘群,康莲莲,等.藏药绿萝花水提物对小鼠免疫功能的影响[J].西南民族大学学报,2015,41(3):305-309.
[5] 张迅捷,陈绍军,陈冠敏.樟芝多糖对小鼠免疫功能影响的研究[J].福建师范大学学报,2011,27(5):79-84.
[6] Jiang SL,Hu XD,Liu P.Immunomodulation and liver protection of Yinchenhao decoction against concanavalin A-induced chronic liver injury in mice[J].J Integr Med,2015,13(4):262-268.
[7] 杜文彬,张洪.大黄中大黄素的提取条件优化[J].时珍国医国药,2008,19(11):2757-2758.
[8] 刘莉,季金苟,唐南南,等.虎杖中大黄素的分离纯化工艺研究[J].中成药,2013,35(9):2034-2037.
[9] Tong HF,Lin SZ,Yang X,et al.Empirical study on effect of emodin on acute rejection after orthotopic liver transplantation in rats[J].China J Trad Chin Med Pharmacy,2009,24(1):49-52.
[10] Sui JQ,Xie KP,Zou W,et al.Emodininhibits breast cancer cell proliferation through the ERα-MAPK/Akt -cyclin D1/Bcl-2 signaling pathway[J].Asian Pac J Cancer Prev,2014,15:(15):6247-6251.
[11] 周磊,云宝仪,汪业菊,等.大黄素对金黄色葡萄球菌的抑菌作用机制[J].中国生物化学与分子生物学报,2011,27(12):1156-1160.
[12] 高巍,秦爱建,金文杰,等.鸡T淋巴细胞和B淋巴细胞分离纯化方法的建立[J].中国兽医科学,2007,37(9):807-810.
[13] 荣岳光.苜草素对小鼠巨噬细胞NO、IL-6、TNF-α分泌的影响及其机理研究[D].北京:中国农业科学院,2007.
[14] 王晓东,曾摇英,宋兵.银杏内酯B对小鼠腹膜巨噬细胞体外增殖、吞噬及产生NO和ROS的影响[J].细胞与分子免疫学杂志,2012,28(1):4-7.
[15] 田志刚,陈永艳.NK细胞的发育、分化与识别机制[J].中国免疫学杂志,2009,25(1):31-34.
(编校:王俨俨)
Effect of emodin on mice immune cells and its hemolysis in vitro
TIAN Yi-han, QIAO Rui-hong, XIE Kun-peng, XIE Ming-jieΔ
(College of Life Science, Liaoning Normal University, Key Laboratory of Biotechnology and Drug of Liaoning Province, Dalian 116081, China)
ObjectiveTo investigate effect of emodin on mice immune function and its hemolysis toxicity.MethodsThe mouse specific immune cells of T, B lymphocytes and nonspecific immune cell of macrophages and NK cells were prepared and incubated in vitro.The different immune cells were treated by emodin with different concentrations of 5,10,15 and 20 μM, and DMSO as control group.The effect of emodin on immune cells function was detected by neutral red assay and MTT assay.The hemolysis test in vitro was conducted by emodin with different concentrations of 20, 40, 60 and 80 μM, physiological saline as blank control group and sterile distilled water as positive control group, then the hemolysis toxicity of emodin was observed.ResultsThere were no significant difference of T and B lymphocyte proliferation among control group, 5, 10, 15 and 20 μM group(F=0.009,P=1.000;F=0.003,P=1.000), the phagocytic ability of macrophages enhanced in each dose group and was concentration dependent(F=665.525,P=0.000), the proliferation rate of macrophages enhanced and was concentration dependent(F=134.812,P=0.000), the activity of NK cells enhanced and was concentration dependent(F=200.190,P=0.000).Hemolysis test results showed the hemolysis rate was less than 5% in the range of 20 to 80 μM emodin.ConclusionEmodin could significantly promote the nonspecific immune cells activity.Within the concentration of experiment, emodin has no hemolysis toxicity.
emodin; specific immune cells; nonspecific immune cell; in vitro; hemolysis toxicity
辽宁省教育厅科学研究一般项目(L2013412);大连市科技计划项目(2013E13SF108)
田一含,女,本科,研究方向:微生物生化,E-mail:2324241060@qq.com;谢明杰,通讯作者,女,博士,教授,研究方向:微生物生化,E-mail: xmj1222@sina.com。
Q935
A
1005-1678(2015)09-0034-04

