利用絮凝进行微藻采收的研究进展
万春,张晓月,赵心清,白凤武
利用絮凝进行微藻采收的研究进展
万春,张晓月,赵心清,白凤武
大连理工大学生命科学与技术学院,辽宁大连 116024

万春, 张晓月, 赵心清, 等. 利用絮凝进行微藻采收的研究进展. 生物工程学报, 2015, 31(2): 161–171.Wan C, Zhang XY, Zhao XQ,et al. Harvesting microalgae via flocculation: a review. Chin J Biotech, 2015, 31(2): 161–171.
微藻可生产不饱和脂肪酸及色素等多种高附加值产品,同时也可用来生产可再生清洁能源如生物柴油等,具有良好的应用前景。但是,目前微藻细胞的采收成本高居不下,已成为限制微藻生物技术大规模应用的重要因素之一。与其他方法相比,絮凝采收成本低、操作简便,是很有应用前景的采收方法。本文综述了国内外利用化学絮凝、物理絮凝及生物絮凝等方法对不同微藻细胞进行采收的研究,重点对生物絮凝方法进行了总结。利用微生物絮凝剂及微藻细胞的自絮凝进行微藻生物量的回收,是微藻采收技术中环境友好、低成本和行之有效的新方法之一。
微藻,絮凝,采收,生物絮凝,微藻自絮凝
微藻是地球上最早的重要生产者,其个体微小 (几微米至几十微米)、种类繁多、生存能力强,在地球上分布广泛。微藻可通过高效的光合作用吸收CO2,将光能转换为有机碳化合物并释放氧气,在降低温室效应方面具有重要的应用价值。微藻能产生多种多不饱和脂肪酸如omega-3脂肪酸、EPA、DHA等[1],同时也能在体内积累叶绿素或者类胡萝卜素等化妆品颜色添加剂[2]。另外,微藻可在生活及工业废水中生长,不仅可有效去除废水中的有毒重金属离子,而且积累的生物量可用作高附值产品如多不饱和脂肪酸和色素等生产原料[3]。此外,化石燃料日益枯竭及其使用引起的温室效应等环境问题的凸显,利用微藻生产新型清洁能源是国内外研究者普遍关注的重要技术之一[4-6]。微藻藻体可用于发酵生产清洁燃料,如甲烷,氢气等[7];而且藻体本身也可作畜牧水产养殖的饲料和饵料。然而,虽然微藻有着很高的综合利用价值和广阔的应用前景,但是影响其工业化应用的最大问题是生产成本过高,特别是采收环节,占整个微藻生物量成本的20%–30%甚至更高[8]。对于光合自养培养的微藻,培养液中的藻密度普遍较低(约1 g/L左右)[9],导致含水量较大(99%以上)。无论是获得藻细胞本身作为饵料和营养品,还是提取微藻胞内的高价值产品,都必须将藻细胞与培养基分开,因此都需要利用采收技术获得藻细胞。除螺旋藻个体大可用筛网采收外,其他微藻因藻密度低、藻细胞稳定悬浮于培养液等特点致使微藻采收困难。因此,提高微藻细胞采收效率和经济性,对微藻的工业化应用具有重要的意义,特别是在利用能源微藻生产生物能源的过程中,降低成本非常关键。
目前微藻采收的方法主要有过滤法、气浮法、离心法以及絮凝法等[10-11]。过滤和气浮法依赖于藻种特性,且过滤法涉及到滤膜堵塞与污染的问题;离心法虽然普适性强,但是从较低密度藻液中,特别是在开放培养方式中的藻液中收集微藻设备消耗大而且耗能高。同其他采收方法相比,絮凝法可用于大规模微藻采收,其藻种适用范围广,且能耗相对较低,被认为是更可靠经济的方法[8]。通过絮凝法预先浓缩藻液可显著降低整个微藻采收的能耗费用,这也使得絮凝法成为微藻采收中最具有前景的方法[12]。微藻细胞采收的絮凝技术主要包括化学絮凝、物理絮凝和生物絮凝等,本文对这些方法的最新研究进行了论述,强调了生物絮凝法,特别是细胞自絮凝在微藻采收中的应用潜力,以期对微藻低成本高效采收以及微藻的产业化有所贡献。
1 絮凝采收微藻
1.1 传统絮凝采收技术
1.1.1 化学絮凝
微藻细胞表面多带负电荷[12],因此所用絮凝剂为阳离子絮凝剂,包括金属盐类和高分子聚合物类。常用于化学絮凝的金属离子有A13+、Fe3+、Zn2+等,这些金属离子能强吸附在微藻细胞表面,电中和其表面的负电荷,消除细胞间的静电排斥,进而达到絮凝的效果。在特定pH下,金属离子可形成Al(OH)3(s)、Fe(OH)3(s)和Zn(OH)2(s) 等难溶物,将微藻细胞网络其中而实现藻细胞絮凝。另外,A13+、Fe3+等金属盐还能形成[Al(OH)3]n和[Fe(OH)3]n等聚合体,连接到两个或多个藻细胞,以吸附架桥形式聚集藻细胞,进而絮凝沉淀。高分子聚合物能通过吸附架桥作用和网捕作用高效絮凝采收微藻,包括无机絮凝剂如聚合氯化铝(PAC) 和聚丙烯酰胺(PAM) 等,有机聚合物絮凝剂如壳聚糖,多聚g-谷氨酸(g-PGA) 等。现已利用化学絮凝成功实现了栅藻、小球藻、微拟球藻、新绿藻和褐藻等微藻的采收。各种化学絮凝剂采收微藻的优缺点总结如表1所示。
由于微藻表面带有电荷,通过调节微藻培养液pH而改变微藻细胞表面之间电荷平衡,亦能达到絮凝采收微藻的目的。通过Ca(OH)2将浓度为6´107个/mL的微拟球藻培养液调节到pH 10时,微藻絮凝率达90%,且其成本仅为$7.5/t;当藻密度达到108个/mL时,采收成本能缩减到$3.5/t,然而高pH的培养液需要中和处理再做重复利用[22]。此外,将栅藻sp. (0.54 g/L) 培养液调节到pH 11.5时,10 min内微藻絮凝率高达97.4%[14];而且高pH培养液中的镁离子亦能协助絮凝采收小球藻,(0.9 g/L)、栅藻,sp. (1.1 g/L) 和三角褐指藻(2.2 g/L) 等多种藻类,其效率超过90%[23-24];但镁离子同藻细胞共沉降,会额外增加后续藻生物量中金属离子去除过程。化学絮凝研究较早、工艺成熟,但是存在的问题是操作过程中成本高,而且金属离子和高聚合物在水中残留极难降解,对环境易造成二次污染。此外,高pH培养液上清需经过处理后才能继续用于微藻培养,不适用于大规模应用。

表1 不同化学絮凝剂采收微藻比较
* - data of concentration is unavailable.
1.1.2 物理絮凝
物理絮凝主要包括电絮凝和超声絮凝。在电絮凝过程中,带负电的微藻细胞向正电极靠拢而失去其离子层,进而与周围细胞易形成聚集体,被电解产生的气体 (氧气和氢气) 带动浮至上层实现微藻富集,该方法对绿藻、蓝绿藻和硅藻(0.001–0.05 g/L) 的絮凝率能达95%,而且不需添加任何化学絮凝剂,能耗仅为 0.3 kW·h/m3[25]。而当少量Fe3+存在时,该方法对绿球藻sp. (0.6 g/L) 和小球藻(0.3 g/L) 的絮凝率接近100%,然而能耗高达1–2 kW·h/kg[26-27]。电絮凝对设备和操作技术要求较高,而且需及时更换电极;另外,金属离子仍然会残留在回收后的微藻培养液及微藻生物量里,不利于培养液的再利用以及微藻后续加工[25-27]。此外,Fe3O4磁性纳米颗粒(IONP) 可通过静电吸附作用粘附在微藻细胞表面,在磁场存在下能有效采收微藻。中科院过程所学者利用250 mg/L IONP在40 s内对椭圆小球藻(0.75 g/L) 絮凝率达95%,而且在藻液流速为100 mL/min时絮凝率仍高于90%[28],由于该方法絮凝率随着藻液体积的增大而降低,在大规模培养中的应用仍有待验证;回收或去除IONP,不仅可降低操作费用,也可避免对后续的加工造成影响。
另外,可利用超声进行絮凝采收。在超声处理微藻时,藻细胞趋于超声波节点而相互聚集沉降;该法虽电耗高(345 kW/d),但对浓度为108个/mL单胞藻的絮凝率可达90%[29]。
物理絮凝法相对于化学絮凝法没有二次污染,但是局限于操作环境,而且耗能大 (1–9 kW·h/kg),不适于大规模应用。
1.2 生物絮凝采收技术
生物絮凝是利用生物体本身或其代谢产生的粘性物质,通过网捕或键桥作用,使藻细胞相互聚集,对微藻进行采收的过程,被认为是最有希望成为规模化应用的絮凝采收技术。生物絮凝分为微生物絮凝和微藻细胞自絮凝。
1.2.1 微生物絮凝剂
微生物絮凝剂因其生物安全可降解、絮凝效率高以及无二次污染等特点,不仅在食品加工和污水处理中应用广泛[30],最近亦被用于微藻采收。微生物絮凝剂在污水处理中的作用机理主要有氢键等作用下的吸附架桥模式和两性电解质的电中和模式等[30],然而其在微藻采收中的作用机理尚不清楚,推测该过程涉及微生物絮凝剂中的羟基和羧基等引起的静电吸附作用,或该官能团结合微藻细胞而增强的架桥 作用[31]。
韩国学者从拟盘多毛孢菌sp. KCTC 8637P中分离得到絮凝剂后并将其用于采收布朗葡萄藻,取得了一定成 效[32-33]。随后该课题组又将类芽胞杆菌sp. 所产的絮凝物质(7–8 g/L) 添加到小球藻(0.062 g/L) 的培养液中,在Ca2+协助下能得到83%的絮凝率,高于传统化学絮凝剂而且受pH影响不大;另外该絮凝剂对布朗葡萄藻、栅藻和羊角月牙藻有近90%的絮凝率[34];进一步的实验结果表明,该絮凝物质是由类芽胞杆菌AM49分泌到胞外的多聚物 (~3.5 g/L),在8.5 mmol/L CaCl2和0.2 mmol/L FeCl3协助下对栅藻sp. (0.83 g/L) 絮凝率高达95%,且培养基可以重复利用[35]。龚良玉等利用一株假单胞菌sp. 的发酵液研究了该菌产絮凝剂对园甲藻和裸甲藻sp. 的絮凝去除作用,结果表明,在2 mmol/L Ca2+和4 mmol/L Mg2+协助下,对赤潮藻类絮凝率达90%,但受pH影响较大[36]。然而金属离子的添加会造成环境二次污染,而且不利于后续微藻加工。
本课题组成功从活性污泥中筛选出一株絮凝剂产生菌并鉴定为土壤芽胞杆菌,在不需要金属离子的条件下该絮凝剂(1.1 g/L) 对海洋微拟球藻(0.8 g/L)的絮凝率超过80%,而且对淡水栅藻和小球藻也有一定絮凝能力;生理生化分析表明该絮凝物质由蛋白和糖类物质组成,不同于多糖类微生物絮凝剂[31]。
生物絮凝剂的生产涉及到絮凝剂产生菌的培养以及絮凝剂的分离纯化,且生物絮凝剂产量不高而使用量大,致使生物絮凝剂成本较高;但其因生物安全可降解、避免二次污染等优点,在微藻采收中仍有良好的应用前景。
1.2.2 微生物絮凝微藻
细菌和真菌可以诱导微藻絮凝,并在污水处理中应用广泛[3]。细菌主要通过粘附作用吸附在邻近微藻细胞表面而引起藻细胞聚集,并且细菌菌丝、胞壁蛋白、细胞表面电荷以及胞外透明多聚颗粒均能促进藻细胞絮凝[37-39]。真菌主要通过菌丝引起微藻絮凝[40-41]。
微藻与细菌相互作用研究由来已久[42],早在2003年意大利Rodolfi等发现在大规模培养微拟球藻sp.的后期出现藻细胞絮凝现象,通过透射电子显微镜(TEM) 确定了该絮凝由细菌及其菌体碎片诱导[43]。中国学者从地下水中分离出隶属于假单胞菌目的新型细菌HW001,菌体与海洋微拟球藻IMET1细胞数目比为30∶1时,共培养3 d藻细胞絮凝率超过90%;此外,该细菌对扁藻和蓝藻WH8007絮凝效果明显[37]。在该研究的基础上,美国学者从被污染的HW001培养液中分离得到一株芽胞杆菌RP1137,该菌体与海洋微拟球藻IMET1数目比为1:1时,在30 s内对该藻细胞絮凝率达95%,而且受温度和盐度影响不大;但是pH适用范围较窄(pH 9–10),另外絮凝过程需要Ca2+和Mg2+协助[38]。细菌跟颗石藻共培养亦能诱导该藻细胞絮凝,Lee等将假单胞菌和芽胞杆菌等细菌同颗石藻在含有乙酸、葡萄糖和甘油(0.1 g/L) 的有机碳培养基中共培养24 h,能絮凝90%的藻细胞,由于无需金属离子协助,絮凝过程对藻细胞活性无影响,且采收后的培养液可重复利用[44]。此外,当细菌与海链藻共培养96 h后通过粘附作用可显著诱导藻细胞絮凝[39]。
霉菌菌丝形成的球状颗粒可将微藻细胞包裹其中而应用于微藻采收 (图1),另外其菌丝带正电荷,可通过电中和作用絮凝微藻[40-41]。小球藻UMN235在含有20 g/L葡萄糖和108个/L黑曲霉sp. 孢子培养基中共培养2 d后全部被囊括在菌丝球中,并且能有效去除污水中的氮和磷[40]。当小球藻(6.9´109个细胞/L) 与黑曲霉Ted S-OSU孢子(7.6´106个细胞/L) 共培养3 d后,藻细胞絮凝率超过60%;而且二者在异养培养的条件下,总脂肪酸含量显著提高且其组成适于生物柴油炼制[41]。
A
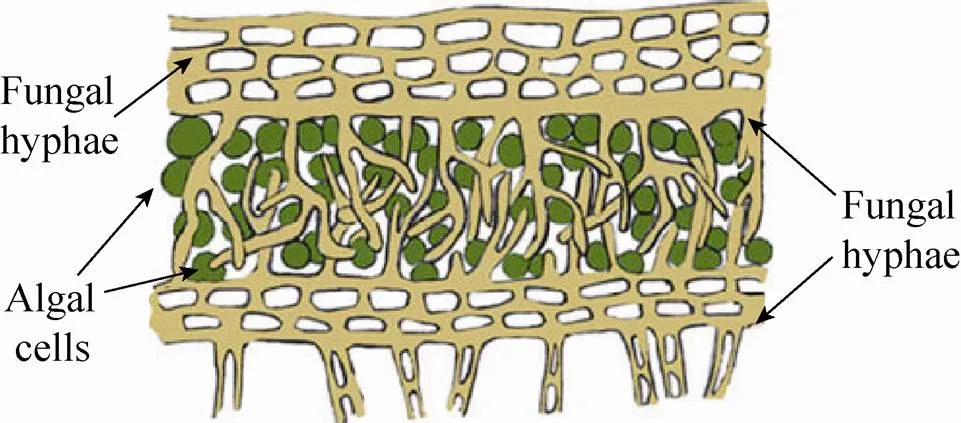
B
图1 霉菌菌丝球采收微藻
Fig. 1 Harvest microalgae via co-pellets with fungi.
(A) Insight structure of pelletization. (B) Photo of co-pellets ofsp. and
微生物菌体与微藻细胞共培养能有效诱导藻细胞絮凝,虽然该过程pH适用范围较窄,但是一些微生物特别是霉菌在聚集微藻的过程中不需要金属离子的协助,并且形成的复合微生物颗粒在污水处理中表现出了巨大的潜力。然而,该采收方案需要有机碳源供细菌或真菌生长,且这些菌体可能会影响到微藻在饲料和食品加工的安全性。另外,在培养微藻的过程中引入外源微生物不仅会同微藻生长竞争营养,而且微生物污染也对后续加工产生影响,特别是在开放低成本培养方式中通过添加有机碳源、细菌和霉菌孢子,再通过共培养方式采收微藻其成本和操作费用相对较高。此外,该方法采收的微藻种类不多,实用性和普适性仍有待研究。
1.2.3 微藻细胞自絮凝
细胞自絮凝在自然界中普遍存在,随着研究的深入,越来越多具有自絮凝性状的微生物被发现[45]。本课题组长期从事酵母絮凝分子机理的研究和应用[46],表征了自絮凝酿酒酵母SPSC01的絮凝基因[47],实现了酿酒酵母的可诱导絮凝[48],而且将自絮凝运动发酵单胞菌成功应用于高浓度乙醇发酵[49]。具有自絮凝特征的酵母和细菌细胞在停止发酵时沉积在发酵罐底部而无需额外采收,为利用自絮凝技术采收微藻提供理论了基础。
微藻细胞自絮凝是微藻培养过程中合成絮凝物质 (糖苷[50]或多糖[51-52]) 并分泌到细胞壁上,该物质能粘附邻近藻细胞进而引发的絮凝现象 (图2);且培养基营养成分 (如N/P比例) 或生长条件如温度、pH、光照强度等自然变化会影响藻细胞絮凝[53];自絮凝微藻亦能絮凝游离微藻[54]。Schenk等报道了自絮凝骨藻能絮凝采收微拟球藻[55];此外,镰形纤维藻,斜生栅藻和扁藻也被发现具有自絮凝性状[56]。在这些研究基础上,Salim课题组将这些具有絮凝特性的微藻培养液以2–5倍体积添加到游离小球藻和富油新绿藻培养液中,最高絮凝率分别能达到41%和46%[54];随后通过优化实验发现当絮凝微藻与小球藻比例为1∶4时即可诱导40%的藻细胞絮凝,扁藻与富油新绿藻比例为0.25时可获得50%的絮凝率,而且经过3 h沉降再离心的能耗同直接离心相比降低了8倍[57]。对自絮凝微藻的进一步研究发现该藻种的絮凝现象随着生物量积累而增强,无金属离子协助时静置3 h,藻细胞(~2.5 g/L) 絮凝率接近90%[58]。

图2 自絮凝微藻S. obliquus AS-6-1和C. vulgaris JSC-7的扫描电镜照片[51-52]
本课题组通过对自絮凝栅藻AS-6-1和自絮凝小球藻JSC-7研究发现,两株藻在30 min内藻细胞基本全部沉降,并且在Al3+或Fe3+的协助下对游离的栅藻和小球藻(~1 g/L) 的絮凝率接近70%;另外从自絮凝微藻中分离得到絮凝物质在0.6 mg/L时对栅藻和小球藻(~1 g/L) 的絮凝率都超过60%,低浓度的Al3+和Fe3+能协助采收微藻[51-52]。
随着微藻分子生物学研究越来越多,多种微藻的基因操作方法也日益成熟[59-60],为构建转基因絮凝微藻奠定了基础。在微藻中过表达微藻自絮凝物质的合成基因,或者其他微生物的絮凝基因等,可构建转基因絮凝微藻。在不同微藻中分别表达对应的配体和受体蛋白,混合后的藻细胞通过配体-受体识别结合而实现微藻絮凝采收[61]。同微生物絮凝剂和微生物与微藻共培养絮凝采收微藻的技术相比,自絮凝微藻因其采收效率高、操作简单、生物安全以及成本能耗低等优点,在絮凝采收技术中越来越受到关注,然而其规模化应用仍有待时日。
2 结论与展望
随着全球气候变暖以及化石燃料的日益枯竭,微藻愈来愈成为缓解这些危机以及生产新型清洁能源的重要角色。但是微藻能源生产成本过高,特别是其高居不下的采收成本严重阻碍了微藻能源产业化进程,因此,寻求经济高效的微藻采收方法是促进其产业化进程亟需解决的重要问题之一。与离心和浮选等采收方法相比,絮凝具有能耗低、设备及其维护费用低以及操作方便等特点可明显降低采收成本,并且成功实现了对绿藻门中栅藻、小球藻、衣藻等,硅藻门中海链藻以及蓝藻门中的蓝藻高效采收。虽然传统化学絮凝和物理絮凝有较好的微藻采收效率,但是前者处理中化学絮凝剂的残留对环境造成二次污染以及后者采收中能耗及设备要求高,不利于大规模经济采收。新兴生物絮凝法采收微藻具有可降解,安全高效,并且絮凝后的培养基无需预处理可直接再用于微藻培养;霉菌菌丝球与微藻形成的复合颗粒在污水处理中效果显著;特别是微藻细胞自絮凝既避免了外源微生物添加造成污染的风险,又不影响后续微藻加工,此外,构建转基因自絮凝微藻为微藻采收提供了绿色高效容易操作的方法。和其他转基因生物一样,转基因微藻的生物安全性也是比较重要的问题,需要引起重视。转基因絮凝藻比较理想的构建方法是采用微藻自身的基因序列不引入外源序列,但目前所报道的研究中转基因微藻仍然带有抗性基因进行选择[59]。未来随着转基因技术的发展,可以使用更安全的选择标记,如转基因植物中使用的糖代谢相关基因等[62]。为避免转基因微藻的生物安全性风险,可将转基因絮凝微藻在封闭反应器中培养。但用于生产生物能源的微藻的培养,为了降低成本需要使用开放培养体系,这时候应选择合适的培养区和培养方法,尽量避免微藻扩散到自然环境中。虽然微藻细胞自絮凝研究尚处于起步阶段,但是该技术不需要外源添加有毒或昂贵的絮凝物质,能显著降低采收成本,提高微藻产品工业化生产的经济性。
REFERENCES
[1] De Swaaf ME, Sijtsma L, Pronk JT. High-cell-density fed-batch cultivation of the docosahexaenoic acid producing marine alga. Biotechnol Bioeng, 2003, 81(6): 666–672.
[2] Draaisma RB, Wijffels RH, Ellen Slegers P, et al. Food commodities from microalgae. Curr Opin Biotechnol, 2012, 24(2): 169–177.
[3] Olguin EJ. Dual purpose microalgae-bacteria-based systems that treat wastewater and produce biodiesel and chemical products within a biorefinery. Biotechnol Adv, 2012, 30(5): 1031–1046.
[4] Wijffels RH, Barbosa MJ. An outlook on microalgal biofuels. Science, 2010, 329(5993): 796–799.
[5] Miao XL, Wu QY. Exploitation of biomass renewable engery sources of microalgae. Renew Energ, 2003, 3(109): 13–16 (in Chinese).
缪晓玲, 吴庆余. 微藻生物质可再生能源的开发利用. 可再生能源, 2003, 3(109): 13–16.
[6] Li YG, Tan TW, Huang YM. Some scientific issues to be resolved in the process for producing biodiese form nicromigae. Chin Basic Sci, 2009, 64(5): 64–70 (in Chinese).
李元广, 谭天伟, 黄英明. 微藻生物柴油产业化技术中的若干科学问题及其分析. 中国基础科学, 2009, 64(5): 64–70.
[7] Zhao B, Ma J, Zhao Q, et al. Efficient anaerobic digestion of whole microalgae and lipid-extracted microalgae residues for methane energy production. Bioresour Technol, 2014, 161: 423–430.
[8] Milledge JJ, Heaven S. A review of the harvesting of micro-algae for biofuel production. Rev Environ Sci Biotechnol, 2012, 12(2): 165–178.
[9] Huerlimann R, de Nys R, Heimann K. Growth, lipid content, productivity, and fatty acid composition of tropical microalgae for scale-up production. Biotechnol Bioeng, 2010, 107(2): 245–257.
[10] Zhang HY, Kuang YL, Lin Z. Research process of harvesting technologies of energy microalgae. Chem Ind Eng Prog, 2013, 32(9): 2092–2098 (in Chinese).
张海阳, 匡亚莉, 林喆. 能源微藻采收技术研究进展. 化工进展, 2013, 32(9): 2092–2098.
[11] Lin Z, Kuang YL, Guo J, et al. A review of microalgae recovery technology. Chin J Prog Eng, 2009, 9(6): 1242–1248 (in Chinese).
林喆, 匡亚莉, 郭进, 等. 微藻采收技术的进展与展望. 过程工程学报, 2009, 9(6): 1242–1248.
[12] Vandamme D, Foubert I, Muylaert K. Flocculation as a low-cost method for harvesting microalgae for bulk biomass production. Trend Biotechnol, 2013, 31(4): 233–239.
[13] Papazi A, Makridis P, Divanach P. Harvestingusing cell coagulants. J Appl Phycol, 2009, 22(3): 349–355.
[14] Chen L, Wang C, Wang W, et al. Optimal conditions of different flocculation methods for harvestingsp. cultivated in an open-pond system. Bioresour Technol, 2013, 133: 9–15.
[15] Rwehumbiza VM, Harrison R, Thomsen L. Alum-induced flocculation of preconcentrated: Residual aluminium in the biomass, FAMEs and its effects on microalgae growth upon media recycling. Chem Eng J, 2012, 200: 168–175.
[16] Chen F, Liu Z, Li D, et al. Using ammonia for algae harvesting and as nutrient in subsequent cultures. Bioresour Technol, 2012, 121: 298–303.
[17] Zhang YJ, Luo SJ, Jiang LL, et al. Effect of cationic flocculants on microalgae harvesting. Renew Energ Resour, 2010, 28(3): 35–38 (in Chinese).
张亚杰, 罗生军, 蒋礼玲, 等. 阳离子絮凝剂对小球藻浓缩收集效果的研究. 可再生能源, 2010, 28(3): 35–38.
[18] Beach ES, Eckelman MJ, Cui Z, et al. Preferential technological and life cycle environmental performance of chitosan flocculation for harvesting of the green algae. Bioresour Technol, 2012, 121: 445–449.
[19] Zheng BS, Cai MY, Guo SY, et al. Application of chitosan to the harvest of. J Salt Chem Ind, 2003, 32(1): 7–9 (in Chinese).
郑必胜, 蔡妙颜, 郭祀远, 等. 壳聚糖在小球藻采收中的应用. 海湖盐与化工, 2003, 32(1): 7–9.
[20] Vandamme D, Foubert I, Meesschaert B, et al. Flocculation of microalgae using cationic starch. J Appl Phycol, 2009, 22(4): 525–530.
[21] Zheng H, Gao Z, Yin J, et al. Harvesting of microalgae by flocculation with poly (gamma-glutamic acid). Bioresour Technol, 2012, 112: 212–220.
[22] Schlesinger A, Eisenstadt D, Bar-Gil A, et al. Inexpensive non-toxic flocculation of microalgae contradicts theories; overcoming a major hurdle to bulk algal production. Biotechnol Adv. 2012, 30(5): 1023–1030
[23] Wu Z, Zhu Y, Huang W, et al. Evaluation of flocculation induced by pH increase for harvesting microalgae and reuse of flocculated medium. Bioresour Technol, 2012, 110: 496–502.
[24] Vandamme D, Foubert I, Fraeye I, et al. Flocculation ofinduced by high pH: role of magnesium and calcium and practical implications. Bioresour Technol, 2012, 105: 114–119.
[25] Poelman E, De Pauw N, Jeurissen B. Potential of electrolytic flocculation for recovery of micro-algae. Resour Conserv Recy, 1997, 19(1): 1–10.
[26] Uduman N, Bourniquel V, Danquah MK, et al. A parametric study of electrocoagulation as a recovery process of marine microalgae for biodiesel production. Chem Eng J, 2011, 174(1): 249–257.
[27] Vandamme D, Pontes SC, Goiris K, et al. Evaluation of electro-coagulation-flocculation for harvesting marine and freshwater microalgae. Biotechnol Bioeng, 2011, 108(10): 2320–2329.
[28] Hu YR, Guo C, Xu L, et al. A magnetic separator for efficient microalgae harvesting. Bioresour Technol, 2014, 158: 388–391.
[29] Bosma R, Van Spronsen WA, Tramper J, et al. Ultrasound, a new separation technique to harvest microalgae. J Appl Phycol, 2003, 15(2/3): 143–153.
[30] Ma F, Duan SY, Kong XZ, et al. Present status and development trend of studies on microbial flocculants. China Water Wastewater, 2012, 28(2): 14–17 (in Chinese).
马放, 段姝悦, 孔祥震, 等. 微生物絮凝剂的研究现状及其发展趋势. 中国给水排水, 2012, 28(2): 14–17.
[31] Wan C, Zhao XQ, Guo SL, et al. Bioflocculant production fromW01 and its application in cost-effective harvest of marine microalgaby flocculation. Bioresour Technol, 2013, 135: 207–212.
[32] Kwon GS, Moon SH, Hong SD, et al. A novel flocculant biopolymer produced bysp. KCTC 8637P. Biotechnol Lett, 1996, 18(12): 1459–1464.
[33] Lee SL, Kim SB Kim JE, et al. Effects of harvesting method and growth stage on the flocculation of the green alga. Lett Appl Microbiol, 1998, 27(1): 14–18.
[34] Oh HM, Lee SJ, Park MH, et al. Harvesting ofusing a bioflocculant fromsp. AM49. Biotechnol Lett, 2001, 23(15): 1229–1234.
[35] Kim DG, La HJ, Ahn CY, et al. Harvest ofsp. with bioflocculant and reuse of culture medium for subsequent high-density cultures. Bioresour Technol, 2011, 102: 3163–3168.
[36] Gong LY, Liang SK, Li YB, et al. Study on HAB removed with extracellular biopolymeric focculant. Marin Environ Sci, 2009, 28(3): 247–250 (in Chinese).
龚良玉, 梁生康, 李雁宾, 等. 一株海洋假单胞菌产生物絮凝剂去除赤潮生物的实验研究. 海洋环境科学, 2009, 28(3): 247–250.
[37] Wang H, Laughinghouse HDT, Anderson MA, et al. Novel bacterial isolate from Permian groundwater, capable of aggregating potential biofuel-producing microalgaIMET1. Appl Environ Microbiol, 2012, 78(5): 1445–1453.
[38] Powell RJ, Hill RT. Rapid aggregation of biofuel-producing algae by the bacteriumsp. strain RP1137. Appl Environ Microbiol, 2013, 79(19): 6093–6101.
[39] Gardes A, Iversen MH, Grossart HP, et al. Diatom-associated bacteria are required for aggregation of. ISME J, 2011, 5(3): 436–445.
[40] Zhou W, Cheng Y, Li Y, et al. Novel fungal pelletization-assisted technology for algae harvesting and wastewater treatment. Appl Biochem Biotechnol, 2012, 167(2): 214–228.
[41] Zhang J, Hu B. A novel method to harvest microalgae via co-culture of filamentous fungi to form cell pellets. Bioresour Technol, 2012, 114: 529–535.
[42] Amin SA, Parker MS, Armbrust EV. Interactions between diatoms and bacteria. Microbiol Mol Biol R, 2012, 76(3): 667–684.
[43] Rodolfi L, Zittelli GC, Barsanti L, et al. Growth medium recycling insp. mass cultivation. Biomol Eng, 2003, 20(4): 243–248.
[44] Lee AK, Lewis DM, Ashman PJ. Microbial flocculation, a potentially low-cost harvesting technique for marine microalgae for the production of biodiesel. J Appl Phycol, 2008, 21(5): 559–567.
[45] Salehizadeh H, Shojaosadati SA. Extracellular biopolymeric flocculants: recent trends and biotechnological importance. Biotechnol Adv, 2001, 19(5): 371–385.
[46] Zhao XQ, Bai FW. Yeast flocculation: New story in fuel ethanol production. Biotechnol Adv, 2009, 27(6): 849–856.
[47] He LY. Isolation and functional analysis of flocculation genes from the flocculating yeast SPSC01 [D]. Dalian: Dalian University of Technology, 2012 (in Chinese).
贺雷雨. 絮凝酵母 SPSC01 絮凝基因的分离及功能研究[D]. 大连: 大连理工大学, 2012.
[48] Li Q, Zhao XQ, Chang AK, et al. Ethanol-induced yeast flocculation directed by the promoter ofencoding trehalose-6-phosphate synthase 1 for efficient ethanol production. Metab Eng, 2012, 14(1): 1–8.
[49] Zhao N, Bai Y, Liu CG, et al. Flocculatingis a promising host to be engineered for fuel ethanol production from lignocellulosic biomass. Biotechnol J, 2013, 9(3): 262–271.
[50] Salim S, Kosterink NR, Tchetkoua Wacka ND, et al. Mechanism behind autoflocculation of unicellular green microalgae. J Biotechnol, 2014, 174: 34–38.
[51] Guo SL, Zhao XQ, Wan C, et al. Characterization of flocculating agent from the self-flocculating microalgaAS-6-1 for efficient biomass harvest. Bioresour Technol, 2013, 145: 285–289.
[52] Alam MA, Wan C, Guo SL, et al. Characterization of the flocculating agent from the spontaneously flocculating microalgaJSC-7. J Biosci Bioeng, 2014, 118(1): 29–33.
[53] Sukenik A, Shelef G. Algal autoflocculation- verification and proposed mechanism. Biotechnol Bioeng, 1984, 26(2): 142–147.
[54] Salim S, Bosma R, Vermue MH, et al. Harvesting of microalgae by bio-flocculation. J Appl Phycol, 2011, 23(5): 849–855.
[55] Schenk PM, Thomas-Hall SR, Stephens E, et al. Second generation biofuels: High-efficiency microalgae for biodiesel production. Bioenerg Res, 2008, 1(1): 20–43.
[56] Griffiths MJ, Harrison STL. Lipid productivity as a key characteristic for choosing algal species for biodiesel production. J Appl Phycol, 2009, 21(5): 493–507.
[57] Salim S, Vermue MH, Wijffels RH. Ratio between autoflocculating and target microalgae affects the energy-efficient harvesting by bio-flocculation. Bioresour Technol, 2012, 118: 49–55.
[58] Salim S, Shi Z, Vermuë MH, et al. Effect of growth phase on harvesting characteristics, autoflocculation and lipid content offor microalgal biodiesel production. Bioresour Technol, 2013, 138: 214–221.
[59] Guo SL, Zhao XQ, Tang Y, et al. Establishment of an efficient genetic transformation system in. J Biotechnol, 2013, 163(1): 61–68.
[60] Georgianna DR, Mayfield SP. Exploiting diversity and synthetic biology for the production of algal biofuels. Nature, 2012, 488(7411): 329–335.
[61] Mendez M, Behnke C, Poon Y, et al, Induction of flocculation in photosynthetic organisms: US, 7643008. 2008-06-27.
[62] LaFayett PR, Kane PM, Phan BH, et al. Arabitol dehydrogenase as a selectable marker for rice. Plant Cell Rep, 2005, 24: 596–602.
(本文责编 郝丽芳)
Harvesting microalgae via flocculation: a review
Chun Wan, Xiaoyue Zhang, Xinqing Zhao, and Fengwu Bai
,,116024,,
Microalgae have been identified as promising candidates for biorefinery of value-added molecules. The valuable products from microalgae include polyunsaturated fatty acids and pigments, clean and sustainable energy (e.g. biodiesel). Nevertheless, high cost for microalgae biomass harvesting has restricted the industrial application of microalgae. Flocculation, compared with other microalgae harvesting methods, has distinguished itself as a promising method with low cost and easy operation. Here, we reviewed the methods of microalgae harvesting using flocculation, including chemical flocculation, physical flocculation and biological flocculation, and the progress and prospect in bio-flocculation are especially focused. Harvesting microalgae via bio-flocculation, especially using bio-flocculant and microalgal strains that is self-flocculated, is one of the eco-friendly, cost-effective and efficient microalgae harvesting methods.
microalgae, flocculation, harvest, bio-flocculation, microalgal cells self-flocculation
May 20, 2014; Accepted: September 11, 2014
Xinqing Zhao. Tel: +86-411-84706319; Fax: +86-411-84706329; E-mail: xqzhao@dlut.edu.cn
Supported by:National Basic Research Program of China (973 Program) (No. 2011CB200905), Scientific Research Program of Jiaxing, China (No. 2013AZ21009).
国家重点基础研究发展计划 (973计划) (No. 2011CB200905),嘉兴市科技研究计划(No. 2013AZ21009) 资助。

