PPENK-MIDGE-NLS基因载体的构建及其在活体大鼠的表达
陈曦,徐学敏,彭细娟,蒋玮,姚立农
-MIDGE-NLS基因载体的构建及其在活体大鼠的表达
陈曦,徐学敏,彭细娟,蒋玮,姚立农
第四军医大学唐都医院麻醉科,陕西西安 710038

陈曦, 徐学敏, 彭细娟, 等. PPENK-MIDGE-NLS基因载体的构建及其在活体大鼠的表达. 生物工程学报, 2015, 31(2): 258–268Chen X, Xu XM, Pu XJ. Construction of PPENK-MIDGE-NLS gene vector and the expression in rat. Chin J Biotech, 2015, 31(2): 258–268.
增加体内免疫细胞合成分泌内源性阿片肽,可对心肌缺血再灌注损伤产生保护作用。基因治疗是增加内源性脑啡肽(Enkephalin, ENK) 的一种有前景的研究方向,但是以往的病毒、质粒等载体受到其自身免疫原性的限制并存在基因重组、原癌基因激活、抗细菌蛋白抗体产生以及基因表达改变等诸多问题。本研究采用非病毒、非质粒的微量免疫原定义的基因表达 (Minimalistic immunological defined gene expression, MIDGE) 方法构建前脑啡肽原 (Preproenkephalin, PPENK)-MIDGE-NLS基因载体能克服病毒和质粒载体的上述缺点。用PCR技术扩增大鼠前脑啡肽原 (Preproenkephalin, PPENK) 外显基因,产物插入pEGFP-N1质粒,双酶切质粒获得包含启动子、目的基因、RNA稳定序列的线性载体,两端以不受外切酶作用的发夹样脱氧寡核苷酸序列 (Oligodesoxynucleotides, ODNs) 封闭。为保证载体的入核和表达效率,载体的一端连接了核定位序列 (Nuclear localization sequence, NLS)。流式细胞术和激光共聚焦检测其转染效率,Western blotting检测组织内前脑啡肽蛋白的表达。结果显示,-MIDGE-NLS能够转染大鼠活体细胞并表达前脑啡肽蛋白,增加载体的量能够在一定范围内提高转染效率。研究结果表明该载体可能成为预防和治疗心肌缺血再灌注损伤的新方法。
心肌缺血再灌注损伤,脑啡肽,基因载体,白细胞
心肌缺血再灌注损伤是临床常见的棘手难题。缺血预处理 (Ischemic preconditioning, IPC) 和缺血后处理(Ischemic postconditioning, IPTC) 均是心肌缺血再灌注损伤最有效的内源性保护机制[1-3]。但是,不论IPC还是IPTC,在临床应用中都受到伦理和方法的制约,而且有增加心肌损害的可能。大量研究证实阿片受体 (Opioid receptor, OR) 参与介导了IPC和IPTC效应,而且外源性阿片类药物能完全模拟IPC和IPTC的心肌保护作用,减轻心肌坏死程度、减少心律失常、改善再灌注期心肌功能[4-7]。但是,产生IPC效应的阿片类药物剂量明显大于临床常规用 量[8],中枢神经系统和呼吸系统的诸多副作用随即难以避免,该临床难题严重困扰了阿片类药物心肌保护作用的临床转化,所以有必要探索一种能在体内持续产生阿片类物质而且靶向释放于心肌缺血局部的方法,以充分利用IPC和IPTC效应减轻心肌缺血再灌注损伤,发挥其心肌保护作用。基因转染则有可能成为增加内源性阿片类物质的有效方法。
心肌缺血再灌注损伤的局部重要特征之一是粒细胞活化、心肌浸润及脱颗粒,而粒细胞系是体内除神经系统外最大的内源性阿片肽 (Endogenous opioid peptide, EOP) 来源[9],此外,各种免疫细胞如单核细胞、淋巴细胞、粒细胞和肥大细胞等都可合成分泌脑啡肽 (Enkephalin, ENK),内源性EOP无任何中枢神经系统的副作用[10]。因此免疫细胞是携带内源性阿片肽而且能靶向聚集到缺血区域的存储库和天然载体。
为促使免疫细胞持续、大量产生内源性脑啡肽,基因重组是最有力的手段。最常用的基因载体是重组病毒载体,但病毒载体具有免疫原性,而且存在与野生型病毒重组的可能性,致癌基因的激活、相对小的DNA容量也是明显不足。非病毒载体不会整合入宿主细胞内,安全性优于病毒载体,同时它不具有传染性,载体容量大。但是存在抗细菌蛋白抗体的产生、抗生素耐药性标志物引起基因表达改变、对CpG二核苷酸的免疫反应等具体问题。
非病毒、非质粒的微量免疫原定义的基因表达 (Minimalistic immunologically defined gene expression, MIDGE) 可克服上述两种基因载体的缺点[11]。MIDGE载体是包含启动子、目的基因和RNA稳定序列的线性分子,两侧是短发夹结构的寡核苷酸序列。MIDGE载体比质粒的明显优势是体积小、缺乏抗菌素耐药基因和相对低的CpG序列。为确保载体基因有效转染到细胞核,本研究中在MIDGE上附加了一个核定位序列 (Nuclear localization sequence, NLS)[12]。
本课题设想利用PPENK-MIDGE-NLS基因载体转染白细胞,增加心肌缺血局部脑啡肽及其活性产物的含量,探讨转染白细胞合成的内源性脑啡肽的心肌保护作用,是心肌缺血再灌注损伤研究领域的有力突破,将有力促进阿片肽心肌保护作用实验研究成果的临床转化。
1 材料与方法
1.1 材料
pEGFP-N1质粒由第四军医大学生化实验室提供。SD大鼠由第四军医大学实验动物中心提供。寡核苷酸序列ODNs,目的基因前脑啡肽基因,PCR引物由上海生工生物工程技术服务有限公司合成,二价交联剂Sulf-MBS购自上海生工生物工程技术有限公司。限制性内切酶Ⅰ、Ⅱ,外切酶Ⅲ购自New England Biolabs公司。T4 DNA连接酶、核酸分子量标准 (20 bp Ladder, DL10 000 marker)、PCR产物清洁试剂盒、DNA凝胶回收试剂盒均购自TaKaRa公司。蛋白分子量标准 (6 500−66 000Da),β-actin,抗PENK抗体购自Sigma公司。质粒中提试剂盒购自QIAGEN公司。琼脂糖粉为Biowest agarose。Western及IP细胞裂解液、蛋白酶抑制剂PMSF (Phenylmethanesulfonyl fluoride)、二抗购自碧云天生物技术研究所,藻红蛋白 (PE) -cy5-标记的小鼠抗大鼠CD45、小鼠抗大鼠CD3-PE、PE-标记的小鼠抗大鼠RP-1、二抗大鼠抗小鼠IgG2a+b PE购自BD Biosciences,荧光素异硫氰酸盐标记的小鼠抗大鼠CD68购自abd serotec,3E7购自Gramsch Laboratories。动物组织、外周血白细胞分离液试剂盒购自灏洋生物制品科技有限责任公司,其余试剂均为国产分析纯以上。
1.2 载体两端发夹样保护结构ODNs的合成
已知组成tRNA中存在着一些能局部互补配对的区域,这些局部双链呈茎状,中间不能配对的部分则膨出形成环或袢状结构,称为发夹结构。模拟真核生物细胞内tRNA相对稳定的发夹结构,构建载体两端稳定的ODN序列,分别在其两端加上与目的基因表达框两端的酶切位点相对应的酶切位点,能够封闭目的基因表达框两端的线性缺口,从而有效地防止体内核酸外切酶的降解,增强基因载体在体内的稳定性[13]。ODN1序列为:TAGCGCTCAGTTGGGAGAGCGCTAAT, ODN2序列为: TTAAGGCGCTCAGTTGGGAGA GCGCC。单链寡核苷酸序列通过退火形成二维发夹样结构 (图1)。
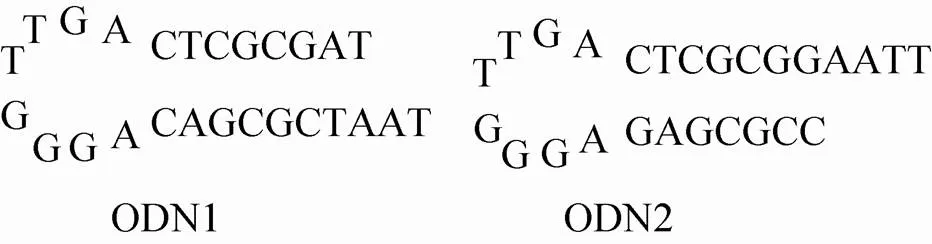
图1 ODNs序列二维结构
1.3 核定位序列的连接
核定位序列NLS (PKKKRKVEDYPC) 为一短的氨基酸序列,能与入核载体相互作用,保证了入核的效率和外源基因的表达。为了将其连接在载体上,需先以二价交联剂Sulf-MBS将其与保护结构ODN1连接,再将连接产物与目的基因表达框连接。二价交联剂通过与ODN上的氨基形成酰胺键,同时和NLS的硫形成硫醚键,从而实现了ODN1与NLS的连接,因此,需对ODN1的第十二位T进行氨基修饰。
1.4 目的基因表达框的获得
限制性内切酶Ⅰ和Ⅱ双酶切pEGFP-N1质粒,1%琼脂糖凝胶电泳,胶回收约1.6 kb左右的片段,即为含启动子、基因、RNA稳定序列的基因表达框。双酶切重组质粒pEGFP-N1-PPENK,1%琼脂糖凝胶电泳,胶回收约2.4 kb左右的片段,即为含启动子、-基因、RNA稳定序列的基因表达框。
1.5-MIDGE-NLS基因载体的构建
加入目的基因表达框及3倍摩尔质量的ODNs保护序列,在T4 DNA连接酶的作用下16 ℃过夜反应,进行连接。用Ⅲ外切酶处理消化未连接片段。PCR产物清洁试剂盒纯化MIDGE-NLS载体。
为保证载体携带基因,利用PCR扩增基因。PCR产物用31Ⅰ酶切,Ⅰ和Ⅰ消化后结扎、克隆入pEGFP-N1质粒。重复以上步骤,以获得多拷贝- MIDGE-NLS基因载体。-MIDGE-NLS基因载体的结构示意图如图2所示。
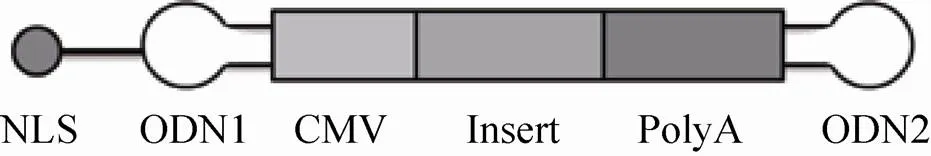
图2 PPENK-MIDGE-NLS基因载体结构示意图
1.6-MIDGE-NLS基因载体转染效果的检测
1.6.1 载体局部注射时对免疫细胞的转染效率
12只SD大鼠,随机分为两组,每组6只。在每只大鼠右后足底部注射100 μL完全弗氏佐剂诱导局部炎症,4 d后实验组大鼠注射50 μg-MIDGE-NLS基因载体,对照组注射 50 μL 0.9%生理盐水。24 h后用过量戊巴比妥钠处死大鼠,两组大鼠各取3只右后足底部皮肤及皮下组织做冰冻切片,DAPI染色后在荧光显微镜下观察绿色荧光蛋白有无表达。
实验组和对照组另外3只大鼠分别取右后足炎性组织做细胞悬液[14],藻红蛋白 (PE) -cy5-标记的小鼠抗大鼠CD45标记所有血细胞,小鼠抗大鼠CD3-PE标记T细胞。按标准制备细胞进行胞内染色[15]。PE-标记的小鼠抗大鼠RP-1孵育,荧光素异硫氰酸盐标记的小鼠抗大鼠CD68 (识别单核/巨噬细胞) 或3E7 (单克隆抗体识别阿片肽固有序列Tyr-Gly-Gly-Phe)。二抗为大鼠抗小鼠IgG2a+b PE抗体。同种非免疫血清对照。流式细胞术检测每种白细胞表达绿色荧光的百分比。
Western blotting检测PENK 蛋白表达:分别采集正常大鼠、对照组大鼠、实验组大鼠和炎症部位注射PENK抗体的实验组大鼠的炎症及相应部位的皮肤及皮下组织,DPBS中切碎、匀浆、离心,–80 ℃保存。测定时取样50 μg,变性SDS-聚丙烯酰胺凝胶电泳,半干法将蛋白转移至硝酸纤维素膜,电泳后4 ℃封闭过夜。加入1∶1 000抗-PENK多克隆抗体,杂交。封闭液漂洗后加入1∶2 000二抗。漂洗后加显色剂氯化硝基四氮唑蓝 (NBT)。图像扫描仪扫描显影条带。
1.6.2 载体静脉注射时对白细胞的转染及心肌浸润
12只SD大鼠随机分为4组,每组3只。其中3组实验组均给予尾静脉注射100 μg (500 ng/μL)-MIDGE-NLS基因载体,对照组尾静脉注射2 mL 0.9%生理盐水。注射-MIDGE-NLS后24、48、72 h采集血液标本,制备细胞悬液。按上述方法标记细胞,流式细胞术检测-MIDGE-NLS对各种细胞的转染效果。
另将15只SD大鼠随机分为5组,每组3只。4个实验组分别给予静脉注射- MIDGE-NLS基因载体50、100、200、400 μg,注射容积2 mL,对照组注射2 mL 0.9%生理盐水。24 h后采集血液标本,制备细胞悬液,按照上述方法进行标记,流式细胞术检测载体注射剂量与转染效果的关系。
将6只SD大鼠随机分为两组,实验组大鼠静脉注射基因载体200 μg (1 000 ng/μL),对照组注射2 mL 0.9%生理盐水,24 h后用1%戊巴比妥钠麻醉 (40 mg/kg),用4%多聚甲醛灌注,取心肌组织在多聚甲醛中固定4 h,30%蔗糖溶液脱水。做冰冻切片 (10 μm) 后用PE-cy5-标记的小鼠抗大鼠CD45标记白细胞,DAPI染色细胞核,在激光共聚焦下观察白细胞在心肌的浸润及脑啡肽的表达。
2 结果与分析
2.1-MIDGE-NLS基因载体
本实验成功构建了-MIDGE-NLS基因载体,图3为载体琼脂糖凝胶电泳结果,其中泳道1为DL10 000 DNA marker,泳道2为MIDGE-NLS基因载体,泳道3为连接ODNs之前目的基因表达框。MIDGE的分子量约为 1 600 bp,连接NLS后在琼脂糖中的电泳速度会变慢,因此MIDGE-NLS的电泳结果显示的分子量大于1 600 bp,构建成功的载体与基因表达框相差大概50 bp。
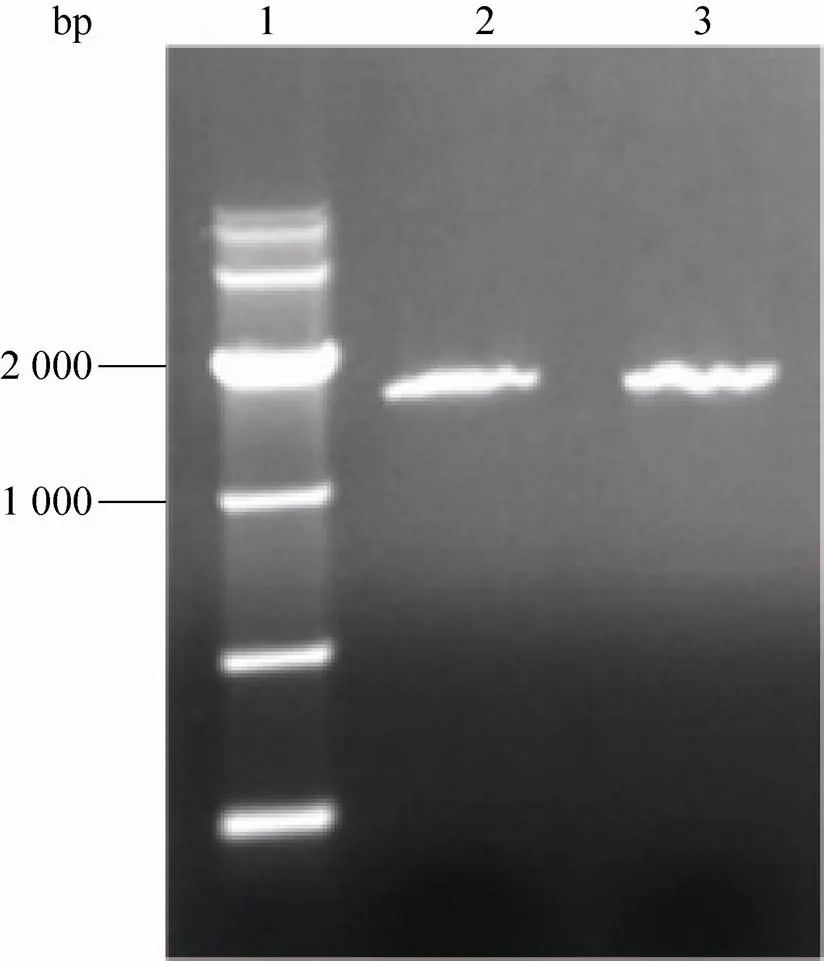
图3 MIDGE-NLS基因载体电泳检测
2.2 局部注射-MIDGE-NLS基因载体的转染效果
为了探讨局部注射-MIDGE-NLS基因载体能否转染活体细胞,我们通过诱导局部炎症增加炎症局部的白细胞的数量,炎症部位注射基因载体24 h后,激光共聚焦显微镜下我们观察到的结果如图4所示,图4C为观察到的绿色荧光蛋白表达 (绿色信号所示) 的图像,图4B为DAPI染色进行的细胞核定位,4A为后两图的融合图像。而注射生理盐水组大鼠未观察到绿色荧光蛋白的表达 (图4F),证实了载体对活体细胞的成功转染和表达。图片右下角的比例尺大小为50 μm。

图4 载体在炎症组织的表达
流式细胞术证实了炎症局部单核/巨噬细胞、T细胞、粒细胞的聚集,由各种白细胞中绿色荧光蛋白表达的细胞所占的比例可知其转染效率。由表1可知载体对各种白细胞均有转染,其中对粒细胞的转染率最高,而T细胞只有少量被转染。对照组阿片肽阳性细胞3组平均值为2.57%,说明白细胞本身就有一定量的阿片肽表达,由实验组和对照组的阿片肽阳性细胞的转染率的对比可知,-MIDGE-NLS基因载体增加了局部阿片肽的表达。
图5为Western blotting检测PENK蛋白表达的结果,图中0、1、2、3分别为正常皮肤组织、对照组炎症组织、实验组炎症组织、注射载体前先注射抗PENK抗体的实验组炎症组织中的PENK蛋白表达量。由图5可清楚地看出注射基因载体后 (2) 组织中PENK蛋白的表达量明显大于正常组织 (0) 和对照组 (1)。

表1 载体对白细胞的转染率
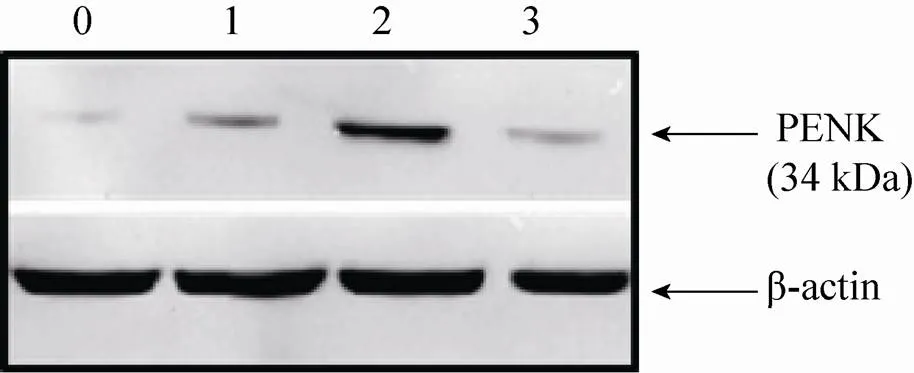
图5 皮肤及皮下组织中PENK蛋白表达的检测
2.3 静脉注射-MIDGE-NLS基因载体对白细胞的转染效果及心肌浸润
本研究的最终目的是要探讨- MIDGE-NLS基因载体是否能通过转染白细胞从而在心肌靶向产生脑啡肽,因此,静脉注射载体后能否成功转染白细胞并且在心肌组织浸润非常关键。静脉注射基因载体200 μg后24 h,心肌组织的冰冻切片中发现了转染成功的白细胞。图6为心肌组织冰冻切片在激光共聚焦下拍摄的图像。图6D为心肌组织中绿色荧光蛋白表达的图像,图6C为心肌组织中的白细胞,图6B显示细胞核DAPI染色,图6A为B、C、D的融合图像。证明转染成功的白细胞在心肌组织的存在。而对照组大鼠的心肌组织切片中的白细胞未见绿色荧光蛋白的表达。图中右下角比例尺为10 μm。
表2为由流式细胞术得到的-MIDGE-NLS基因载体对各种白细胞转染的百分率的检测结果的平均值,由图7可直观看出注射载体24 h后粒细胞、单核/巨噬细胞中绿色荧光蛋白和阿片肽的表达率随时间的延长而降低,而T细胞对绿色荧光蛋白的表达却升高。但是,粒细胞和单核/巨噬细胞仍为基因载体转染的主要细胞。表3为不同剂量载体注射后 24 h转染细胞的百分比数据表,以其平均值作图即为图8,可知在载体的注射量为50−200 μg时,载体的转染率随注射量的增加而提高,当载体注射量为400 μg时,转染率不再随剂量的增加而提高。

图6 载体在心肌组织中的表达
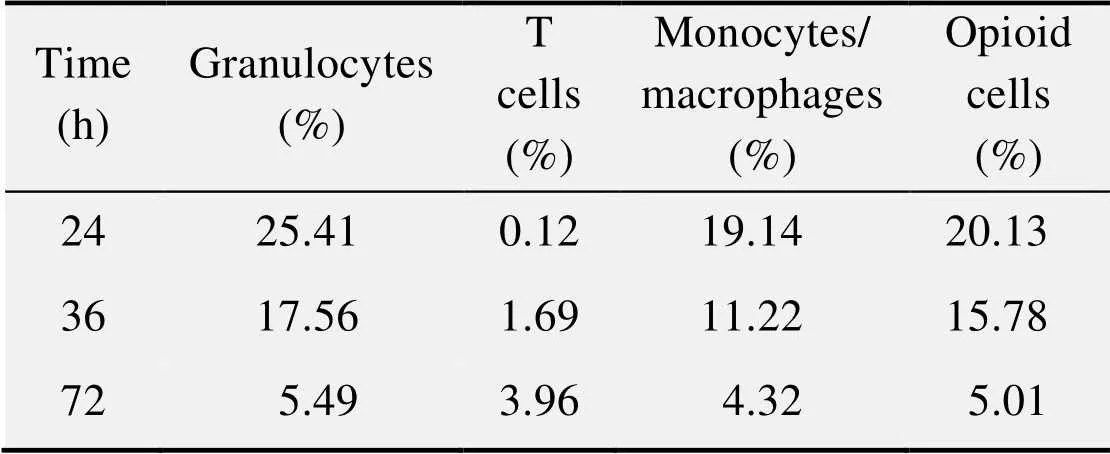
表2 载体对白细胞转染率随时间的变化

图7 载体对白细胞转染效率的观察
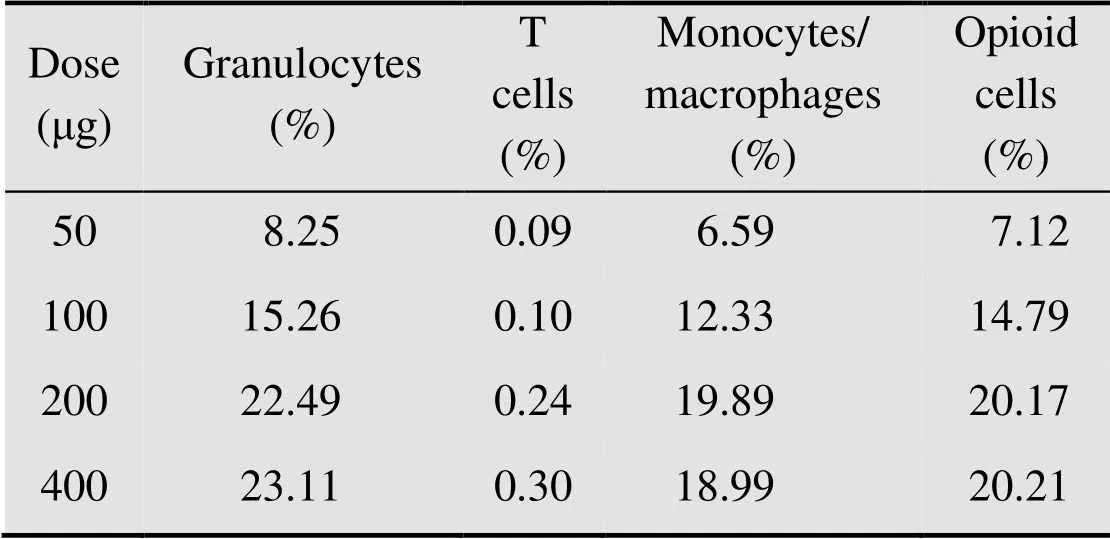
表3 载体对白细胞转染率的量效关系
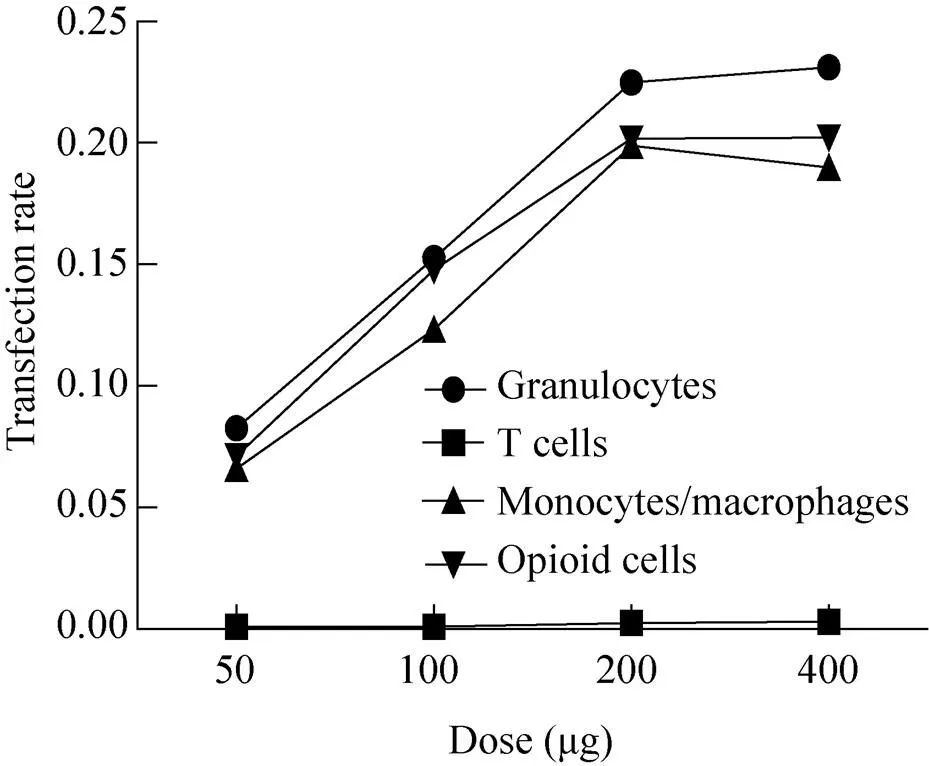
图8 载体对白细胞转染的量效关系
3 讨论
脑啡肽、强啡肽、孤啡肽对缺血性心肌和脑损伤的保护作用已得到充分证实[16-19],为促使免疫细胞持续、大量产生内源性脑啡肽,基因重组是最有力的手段。最常用的基因载体是重组病毒载体,病毒载体具有较高的转染效率,但病毒载体具有免疫原性,而且存在与野生型病毒重组的可能性,致癌基因的激活、相对小的DNA容量也是明显不足。质粒编码的也已用于动物的疼痛治疗,它虽然克服了载体基因容量的限制,但是质粒载体存在抗细菌蛋白抗体的产生、抗生素耐药性标志物引起基因表达改变、对CpG二核苷酸的免疫反应等具体问题。而这些问题的存在都阻碍了病毒与质粒载体的临床应用。因此,构建一种安全可靠、转染效率高的基因载体是基因治疗技术的关键。
非病毒、非质粒的微量免疫原定义的基因表达 (Minimalistic immunologically defined gene expression, MIDGE) 可克服上述两种基因载体的缺点[20]。MIDGE载体是包含启动子、目的基因和RNA稳定序列的线性分子,其安全性优于病毒载体,比质粒的明显优势是体积小、缺乏抗菌素耐药基因和相对低的CpG序列。由于载体为两端封闭的哑铃状线性载体,分子量较小,因此易穿过细胞核膜进入细胞核内表达,提高了表达效率,而核定位序列NLS的连接更是确保了载体转染到细胞核[21]。封闭载体两端的ODNs是模拟真核细胞内tRNA稳定C环结构合成,封闭了线性核酸的开放性末端,使其具有抗真核细胞内核酸外切酶的作用,增加了基因载体的稳定性。因此,-MIDGE-NLS基因载体为基因治疗运用于临床提供了更多的可能性。
由图4可知-MIDGE-NLS基因载体局部注射时能够成功地转染活体细胞并表达目的基因。图5的Western blotting结果也证明该基因载体能够增加局部PENK蛋白的表达量。图4A为绿色荧光蛋白表达图像与细胞核染色的融合图像,证明载体注射24 h后进入细胞核内表达目的基因。载体转染的细胞类型主要为粒细胞和单核/巨噬细胞 (表1)。图6证明载体静脉注射可以转染白细胞,并存在心肌组织中。但是与图4相比较,绿色荧光蛋白在24 h时不表达于细胞核内,而是存在胞质中,由此我们可以推测,静脉注射-MIDGE-NLS基因载体后在24 h之内成功转染白细胞,进入细胞核,表达目的基因。载体注射24 h时,绿色荧光蛋白已经分泌入胞质。
流式细胞术的结果证明,静脉注射-MIDGE-NLS基因载体对各种类型的白细胞均有转染,但是粒细胞和单核/巨噬细胞为主要靶细胞 (表2)。图7为载体对各种白细胞转染时限的变化趋势,我们可以看出随着时间的延长 (24−72 h),粒细胞、单核/巨噬细胞转染比例及阿片肽阳性细胞所占比例逐渐下降,而T细胞转染比例却呈现出轻微的上升趋势,但是基因载体对T细胞的转染作用很微弱。心肌缺血再灌注损伤时损伤部位浸润的白细胞主要为粒细胞,而-MIDGE-NLS基因载体增加粒细胞脑啡肽释放的时限约为3 d,相较于病毒和质粒载体长达2周以上的表达时间来说是比较短暂的[22]。但是,使用外源性阿片类药物时,作用仅仅维持5−10 min[23],由此来看,-MIDGE-NLS基因载体的作用时间长于外源性阿片类物质,并且能避免其呼吸系统和中枢神经系统副作用,有临床应用价值。
表3为载体注射24 h时不同剂量下各种白细胞的转染比例。图8清楚地表明,在载体剂量小于200 μg时,载体对各种白细胞的转染效率均随剂量的增加而提高,而当剂量大于200 μg时,增加载体的剂量却不能再相应地提高转染效率。这或许跟载体入核时是通过NLS与核孔的相互作用而实现有关[24]。当载体剂量达到一定数值以后,核孔与NLS的作用处于饱和状态,从而限制了载体进入细胞核的量进一步增加。
载体用绿色荧光蛋白基因标记,转染成功后能够表达绿色荧光蛋白,能够通过荧光显微镜、激光共聚焦以及流式细胞术快速的检测转染结果,使结果的检测简便、快捷,同时具备较高的重复性。
在进行载体静脉注射时,我们发现注射的药物体积直接影响大鼠的生存率,而当采用2 mL的注射体积并在10 s内注射完毕时,生存率为99.99%。已有研究证明水流动力学静脉注射非病毒载体能够增加小鼠各器官组织的载体表达,但是会引起小鼠肝脏出血性坏死,这是否是本研究中导致大鼠死亡的原因之一有待进一步探讨。本研究中我们并未做最佳注射体积和注射速度的相关探索,不排除载体的注射体积和注射速度对其转染效率存在影响。
此外,载体静脉注射时,在心肌只发现了少量的转染成功的白细胞,这是因为在正常心肌中只有少量的白细胞存在,而当心肌发生缺血再灌注损伤时,会有大量的白细胞向心肌损伤区游动、浸润,从而也会有更多的转染成功的白细胞存在于损伤区靶向释放脑啡肽,这也是我们构建-MIDGE-NLS基因载体的初衷。
基因治疗的安全性、效率问题使得开发出安全有效的基因载体成为基因治疗的关键。-MIDGE-NLS基因载体携带外源性基因少,安全性优于传统的病毒及非病毒载体。其分子量小,易于入核,从而提高了转染效率。它相对较低的CpG序列避免了免疫激活效应。通过对ODNs序列的修饰,使载体具有靶向效应,特定的转染白细胞,增加其阿片肽的表达。利用心肌缺血再灌注损伤时白细胞向缺血区游动、浸润的特点,在损伤区靶向释放内源性脑啡肽,从而保护心肌组织。本研究为心肌缺血再灌注损伤的预防和治疗探索了新的方法,同时,在以后的研究中我们可以探讨将MIDGE-NLS载体作为通用载体,通过插入不同的目的基因片段以及更改核定位序列实现对不同类型的细胞转染以期将其用于各种可能的临床治疗方向,是基因治疗一个有潜力的发展方向。
REFERENCES
[1] Bousselmi R, Lebbi MA, Ferjani M. Myocardial ischemic conditioning: Physiological aspects and clinical applications in cardiac surgery. J Saudi Heart Assoc, 2014, 26(2): 93–100.
[2] Yellon DM, Alkhulaifi AM, Pugsley WB. Preconditioning the human myocardium. Lancet, 1993, 342(8866): 276–277.
[3] Zhao ZQ, Corvera JS, Halkos ME, et al. Inhibition of myocardial injury by ischemic postconditioning during reperfusion: comparison with ischemic preconditioning. Am J Physiol Heart Circ Physiol, 2003, 285(2): H579–H588.
[4] Garlid KD, Costa AD, Quinlan CL, et al. Cardioprotective signaling to mitochondria. J Mol Cell Cardiol, 2009, 46(6): 858–866.
[5] Wong GT, Ling J, Irwin MG. Activation of central opioid receptors induces cardioprotection against ischemia-reperfusion injury. Anesth Analg, 2010, 1(1): 24–28.
[6] Maslov LN, Lishmanov YB, Oeltgen PR, et al. Activation of peripheral delta2 opioid receptors increases cardiac tolerance to ischemia/reperfusion injury involvement of protein kinase C, NO-synthase, KATP channels and the autonomic nervous system. Life Sci, 2009, 84(19/20): 657–663.
[7] Maslov LN, Lishmanov YB, Oeltgen PR, et al. Comparative analysis of the cardioprotective properties of opioid receptor agonists in a rat model of myocardial infarction. Acad Emerg Med, 2010, 17(11): 1239–1246.
[8] Kato R, Foëx P. Myocardial protection by anesthetic agents against ischemia-reperfusion injury: an update for anesthesiologists. Can J Anaesth, 2002, 49(8): 777–791.
[9] Machelska H. Targeting of opioid-producing leukocytes for pain control. Neuropeptides, 2007, 41(6): 355–363.
[10] Labuz D, Schmidt Y, Schreiter A, et al. Immune cell–derived opioids protect against neuropathic pain in mice. J Clin Invest, 2009, 119(2): 278–286.
[11] Machelska H, Schroff M, Oswald D, et al. Peripheral non-viral MIDGE vector-driven delivery of β-endorphin in inflammatory pain. Mol Pain, 2009, 5(6): 72–85.
[12] López-Fuertes L, Pérez-Jiménez E, Vila-Coro AJ, et al. DNA vaccination with linear minimalistic (MIDGE) vectors confers protection againstmajor infection in mice. Vaccine, 2002, 21(3/4): 247–257.
[13] Wang HS, Li XQ, He YW, et al. Construction and expression analysis of micro-linear vector as a new general gene therapy vector. Chin J Biotech, 2008, 24(8): 1333–1339 (in Chinese).王红胜, 李小青, 何玉文, 等. 基因治疗微链载体的构建及表达分析. 生物工程学报, 2008, 24(8): 1333–1339.
[14] Rittner HL, Labuz D, Schaefer M, et al. Pain control by CXCR2 ligands through Ca2+-regulated release of opioid peptides from polymorphonuclear cells. FASEB J, 2006, 20(14): 2627–2629.
[15] Labuz D, Berger S, Mousa SA, et al. Peripheral antinociceptive effects of exogenous and immune cellderived endomorphins in prolonged inflammatory pain. J Neurosci, 2006, 26(16): 4350–4358.
[16] Sauriyal DS, Jaggi AS, Singh N. Extending pharmacological spectrum of opioids beyond analgesia: multifunctional aspects in different pathophysiological states. Neuropeptides, 2011, 45(3): 175–188.
[17] Krepuska M, Sótonyi P, Csobay-Novák C, et al. Plasma nociceptin/orphanin FQ levels are lower in patients with chronic ischemic cadiovascular diseases-a pilot study. Requl Pept, 2011, 169(1/3): 1–5.
[18] Romano MA, Seymour EM, Berry JA, et al. Relative contribution of endogenous opioids to myocardial ischemic tolerance. J Surg Res, 2004, 118(1): 32–37.
[19] van den Brink OW, Delbridge LM, Rosenfeldt FL, et al. Endogenous cardiac opioids: enkephalins in adaptation and protection of the heart. Heart Lung Circ, 2003, 12(3): 178–187.
[20] Zheng C, Juhls C, Oswald D, et al. Effect of different nuclear localization sequences on the immune responses induced by a MIDGE vector encoding bovine herpesvirus-1 glycoprotein D. Vaccine, 2006, 24 (21): 4625–4629.
[21] Zheng C, Juhls C, Oswald D, et al. Effect of different nuclear localization sequences on the immune responses induced by a MIDGE vector encoding bovine herpesvirus-1 glycoprotein D. Vaccine, 2006, 24 (21): 4625–4629.
[22] Hao S, Wolfe D, Glorioso JC, et al. Effects of transgene-mediated endomorphin-2 in inflammatory pain. Eur J Pain, 2009, 13(4): 380–386.
[23] Labuz D, Berger S, Mousa SA, et al. Peripheral antinociceptive effects of exogenous and immune cellderived endomorphins in prolonged inflammatory pain. J Neurosci, 2006, 26(16): 4350–4358.
[24] Newmeyer DD, Forbes DJ. Nuclear import can be separated into distinct steps: nuclear pore binding and translocation. Cell, 1988, 52(5): 641–653.
(本文责编 陈宏宇)
Construction of-MIDGE-NLS gene vector and the expression in rat
Xi Chen, Xuemin Xu, Xijuan Peng, Wei Jiang, and Linong Yao
,,,’710038,,
Increasing the production and secretion of endogenous opioid peptide by immune cell can significantly induce myocardial protective effects against ischemia-reperfusion injury. Gene therapy is promising to increase endogenous enkephalin (ENK). However, classical viral and plasmid vectors for gene delivery are hampered by immunogenicity, gene recombination, oncogene activation, the production of antibacterial antibody and changes in physiological gene expression. Minimalistic immunologically defined gene expression (MIDGE) can overcome all the deficients of viral and plasmid vectors. The exon of rat’s preproenkephalin (PPENK) gene was amplified by PCR and the fragments were cloned into pEGFP-N1 plasmids. The recombined plasmids were digested with enzymes to obtain a linear vector contained promoter, preproenkephalin gene, RNA stable sequences and oligodesoxy nucleotides (ODNs) added to both ends of the gene vector to protect gene vector from exonuclease degradation. A nuclear localization sequence (NLS) was attached to an ODN to ensure the effective transport to the nucleus and transgene expression. Flow cytometry, laser confocal microscopy and Western blotting demonstrated that PPENK-MIDGE-NLS can transfect leukocyte of rat, increase the expression of proenkephalin (PENK) in tissue, and the transfection efficiency depends on gene vector’s dosage. These results indicate that PPENK-MIDGE-NLS could be an innovative method to protect and treatment of myocardial ischemia-reperfusion injury.
ischemia-reperfusion injury, enkephalin, gene vector, leukocyte
May 29, 2014; Accepted: August 27, 2014
Linong Yao. Tel/Fax: +86-29-84717327; E-mail: yaolin@fmmu.edu.cn
Supported by:National Natural Science Foundation of China (No. 81270264).
国家自然科学基金 (No. 81270264) 资助。

