絮凝基因FLO1及FLO1c高表达提高工业酿酒酵母乙酸耐受性及发酵性能
杜昭励,程艳飞,朱卉,何秀萍,张博润
絮凝基因及高表达提高工业酿酒酵母乙酸耐受性及发酵性能
杜昭励1,2,程艳飞1,朱卉1,2,何秀萍1,张博润1
1 中国科学院微生物研究所中国科学院微生物生理与代谢工程重点实验室,北京 100101 2 中国科学院大学,北京 100049

杜昭励, 程艳飞, 朱卉, 等. 絮凝基因FLO1及FLO1c高表达提高工业酿酒酵母乙酸耐受性及发酵性能. 生物工程学报, 2015, 31(2): 231–241.Du ZL, ChengYF, Zhu H, et al. Improvement of acetic acid tolerance and fermentation performance of industrial Saccharomyces cerevisiae by overexpression of flocculent gene FLO1 and FLO1c. Chin J Biotech, 2015, 31(2): 23 1–241.
乙酸是生物质乙醇发酵过程中酵母细胞面临的重要抑制剂之一,对细胞生长及发酵性能有强烈的抑制作用。增强酵母菌对乙酸胁迫的耐受性对提高乙醇产率具有重要意义。用分别带有完整絮凝基因及其重复序列单元C发生缺失的衍生基因的重组表达质粒分别转化非絮凝型工业酿酒酵母CE6,获得絮凝型重组酵母菌株6-AF1和6-AF1c。同时以空载体pYCPGA1转化CE6的菌株CE6-V为对照菌株。与CE6-V相比,絮凝酵母明显提高了对乙酸胁迫的耐受性。在0.6% (/) 乙酸胁迫下,6-AF1和6-AF1c的乙醇产率分别为对照菌株CE6-V的1.56倍和1.62倍;在1.0% (/) 乙酸胁迫下,6-AF1和6-AF1c的乙醇产率分别为对照菌株CE6-V的1.21倍和1.78倍。可见絮凝能力改造能明显提高工业酿酒酵母的乙酸胁迫耐受性及发酵性能,而且内重复序列单元C缺失具有更加明显的效果。
工业酿酒酵母,絮凝基因乙酸胁迫耐受性,发酵性能
随着资源、能源和环境问题的日益呈现,以生物质为原料通过生物转化生产能源产品及高值化学品受到高度关注[1]。作为生物技术领域非常重要的微生物之一,酵母菌在生物质高效转化方面的应用一直是相关领域关注的热 点[2-3]。在生物质原料预处理过程中产生的弱酸类、醛类和酚类等抑制物对细胞生长和代谢具有抑制作用。其中弱酸类化合物中的乙酸含量最高。乙酸由木质纤维素预处理过程中半纤维素脱乙酰作用生成,终浓度大约在1–10 g/L[4-5]。当培养基的pH值低于乙酸的解离常数(pKa 4.76) 时,分子态的乙酸可通过自由扩散或水甘油通道蛋白Fps1p以及转运蛋白Ady2p和Jen1p转运入酵母细胞内[6-7],从而导致胞内环境酸化及乙酸根阴离子的积累,严重抑制细胞的生长和代谢。因此增强酵母菌的乙酸胁迫耐受性对提高底物利用率和产物产率具有重要意义[8-9]。
酵母菌絮凝是指酵母细胞之间相互聚集形成絮状或颗粒状细胞团,并迅速沉降到发酵液底部的一种生理特性,絮凝的发生是一种无性的、钙依赖的、可逆的过程。良好的絮凝特性有利于工业发酵过程中酵母细胞和发酵液的有效分离,因此对简化生产工艺、降低生产成本、提高产品品质具有重要意义[10-13]。絮凝的发生依赖于絮凝蛋白与邻近细胞表面寡聚甘露糖链间的结合,是酿酒酵母中典型的絮凝蛋白编码基因,含有大量衔接重复序列,根据其编码氨基酸序列的一致性,这些重复序列可以划分为A、B、C和D 4个重复单元[14]。重复序列是基因内高度活跃的成分,通过驱动基因内或基因间的滑移和重组,改变基因内重复序列的数量或排列方式,从而影响絮凝蛋白的结构和功能[14-15]。分别缺失内部重复序列单元B、C、D提高了絮凝蛋白的构象稳定性,使酵母细胞絮凝特性表现出对环境酸碱变化的广泛适应性[16-17]。经乙醇胁迫、两性霉素B或过氧化氢处理后,絮凝酵母的细胞存活率是非絮凝酵母的2–100倍[18],表明絮凝也可能是细胞抵抗有害环境的一种保护机制。絮凝是否能赋予酵母菌对其他环境胁迫的耐受性,以及重复序列变化引发的絮凝特性变化是否影响酵母菌应对环境胁迫的能力目前还不清楚。本研究将完整基因与内重复单元C缺失的衍生基因在工业酿酒酵母中进行表达,分析比较其对工业酿酒酵母胁迫耐受性及发酵性能的影响。
1 材料与方法
1.1 菌株、质粒和培养基
本研究所用菌株和质粒见表1。
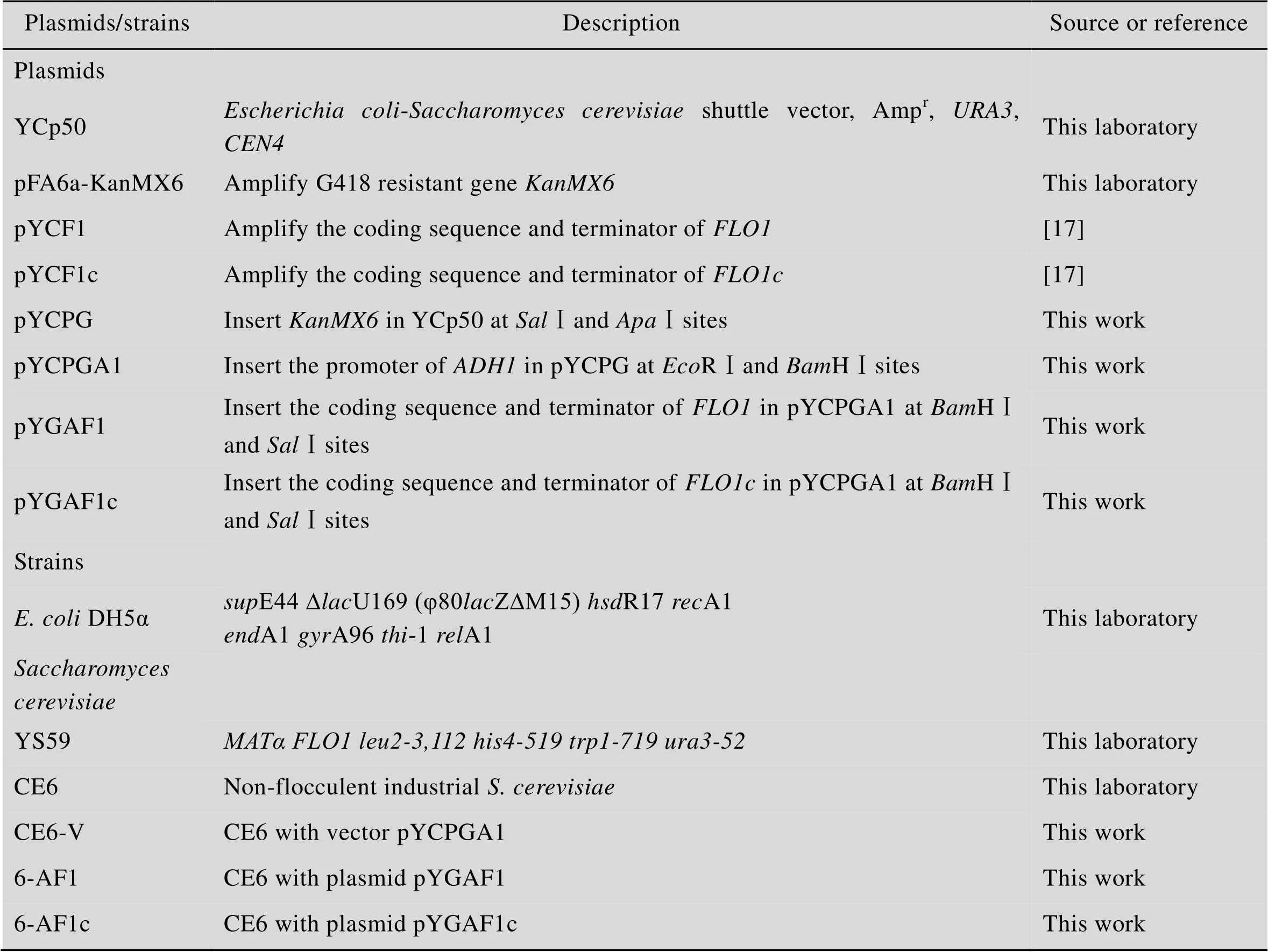
表1 本研究所用菌株及质粒
大肠杆菌保存和培养用LB培养基[19],筛选大肠杆菌转化子用含100 μg/mL氨苄青霉素的LB培养基;酵母菌常规培养用YPD培养基[20],筛选酿酒酵母转化子用含500 μg/mL G418的YPD培养基,比较不同乙酸浓度下细胞生长时,将YPD培养基pH调到4.5;发酵培养基为EFM培养基(100 g/L葡萄糖,6 g/L酵母粉,10 g/L蛋白胨,5 g/L尿素,1 g/L磷酸二氢钾,15 g/L硫酸镁,0.55 g/L无水氯化钙)。
1.2 主要试剂和工具酶
高保真DNA聚合酶KOD及三磷酸脱氧核苷酸混合物(dNTPs) 购自TOYOBO公司,T4 DNA连接酶和限制性内切酶购自TaKaRa公司,DNA marker购自全式金公司,DNA胶回收试剂盒和PCR产物回收试剂盒购自Axygen公司,酵母菌质粒提取试剂盒购自Bio-tek公司,氨苄青霉素购自华北制药股份有限公司,G418购自生工生物工程 (上海) 股份有限公司,其他试剂均为国产分析纯试剂。
1.3 DNA操作和序列分析
大肠杆菌感受态细胞制备、转化及质粒DNA的提取参照文献[19]进行。酵母菌基因组 DNA提取及完整细胞转化参照文献[20]进行。使用OMEGA酵母质粒提取试剂盒(Bio-tek, 美国) 提取酵母菌质粒。絮凝基因表达水平分析参照文献[21]进行。引物合成、序列测定由Invitrogen公司完成。
1.4 重组表达质粒构建
本研究所用引物序列见表2,以质粒pFA6a- KanMX6 为模板,利用引物Kan-F和Kan-R进行PCR扩增,获得约1.5 kb的,经Ⅰ和Ⅰ酶切后的插入到载体YCp50上,获得重组表达质粒pYCPG。以酿酒酵母YS59的基因组为模板,利用引物ADH-F和ADH-R克隆启动子序列,经RⅠ和HⅠ酶切后,插入到质粒pYCPG获得重组质粒pYCPGA1。分别以质粒pYCF1和pYCF1c为模板,利用引物FLO1-F和FLO1-R分别克隆到完整及其衍生基因的编码序列和终止子序列,将其连接到载体pYCPGA1的HⅠ和Ⅰ酶切位点之间,分别获得重组表达质粒pYGAF1和pYGAF1c。

表2 本文所用引物
aRestriction sites are underlined.
1.5 酵母菌絮凝能力测定
絮凝能力的常规测定参照文献[17]进行,所用非絮凝缓冲液为50 mmol/L乙酸钠 (pH 4.5),絮凝缓冲液为含6.8 mmol/L氯化钙的 50 mmol/L乙酸钠(pH 4.5)。测定乙酸对酵母菌絮凝影响时,在菌悬液中分别添加不同浓度乙酸。
1.6 酵母菌胁迫耐受性分析
活化后的酵母菌接种于2 mL YPD培养基中,30 ℃、200 r/min培养16 h,离心收集细胞,经无菌水洗涤两次后,细胞重悬于2 mL无菌水中,并进行梯度稀释,室温下静置2 h。将5 μL稀释度分别为10–2–10–5的菌悬液接种于含不同浓度乙酸、乙醇或糠醛的YPD平板上,30 ℃培养2 d,记录各菌株生长情况。
参照文献[22]分析比较各菌株在液体培养基中的乙酸胁迫耐受性。将活化后的酵母菌接种于50 mL YPD培养基中,30 ℃、200 r/min培养18 h,以初始接种600为0.15的接种量分别转接到50 mL含有不同浓度乙酸的YPD培养基(pH 4.5) 中,30 ℃、200 r/min培养,定时取样测定细胞干重,绘制生长曲线。分别取对数早期、中期和后期的数据进行分析,以(AM/AW)/(BM/BW) 的比值表示不同菌株的乙酸胁迫耐受性,其中AM是重组菌株在乙酸胁迫条件下的细胞干重,AW是对照菌株在乙酸胁迫条件下的细胞干重,BM是重组菌株在无乙酸胁迫时的细胞干重,而BW是对照菌株在无乙酸胁迫时的细胞干重。
1.7 酵母菌发酵性能分析
将活化后的酵母菌接种于50 mL YPD培养基中,30 ℃、200 r/min培养18 h,以初始接种600为1.0的接种量分别转接到100 mL含有0,0.6%,0.8%或1.0% (/) 乙酸的EFM培养基(pH 4.5) 中。添加乙酸后,培养基pH明显降低,具体为3.70 (0.6%乙酸)、3.61 (0.8%乙酸) 和3.56 (1.0%乙酸)。30 ℃、150 r/min培养6 h后,进行厌氧发酵,定时取样检测各项发酵性能指标。实验重复3次,每次每个条件设3个重复。细胞生物量、发酵液中葡萄糖和乙醇含量测定参照文献[23]进行。
2 结果与分析
2.1 絮凝基因在工业酿酒酵母中的表达
分别用空载体pYCPG、带有完整絮凝基因及重复序列单元C缺失衍生基因的重组表达质粒pYGAF1和pYGAF1c转化工业酿酒酵母CE6,在含500 μg/mL G418的YPD培养基上筛选转化子。对转化子进行G418抗性比较、絮凝能力目测、酵母菌质粒提取和PCR分析,以及絮凝基因表达水平分析,获得具有相同G418抗性和絮凝基因、表达水平的重组菌株6-AF1和6-AF1c各6株,以及3株带有空载体的对照菌株CE6-V。
絮凝能力分析结果表明,宿主菌CE6及空载体转化菌株CE6-V均没有表现出絮凝特性,而重组菌株6-AF1和6-AF1c均表现出明显的絮凝特性,絮凝能力约为酵母菌株YS59的1.5倍(图1)。检测的6株6-AF1之间絮凝能力没有明显差异,6株6-AF1c之间絮凝能力也没有明显差异。其中表达内重复序列单元C完全缺失的衍生基因的工业酿酒酵母6-AF1c的絮凝能力是表达完整絮凝基因的工业酿酒酵母6-AF1絮凝能力的96.4%。与和在实验室单倍体酵母菌株中表达的结果基本一致[17]。
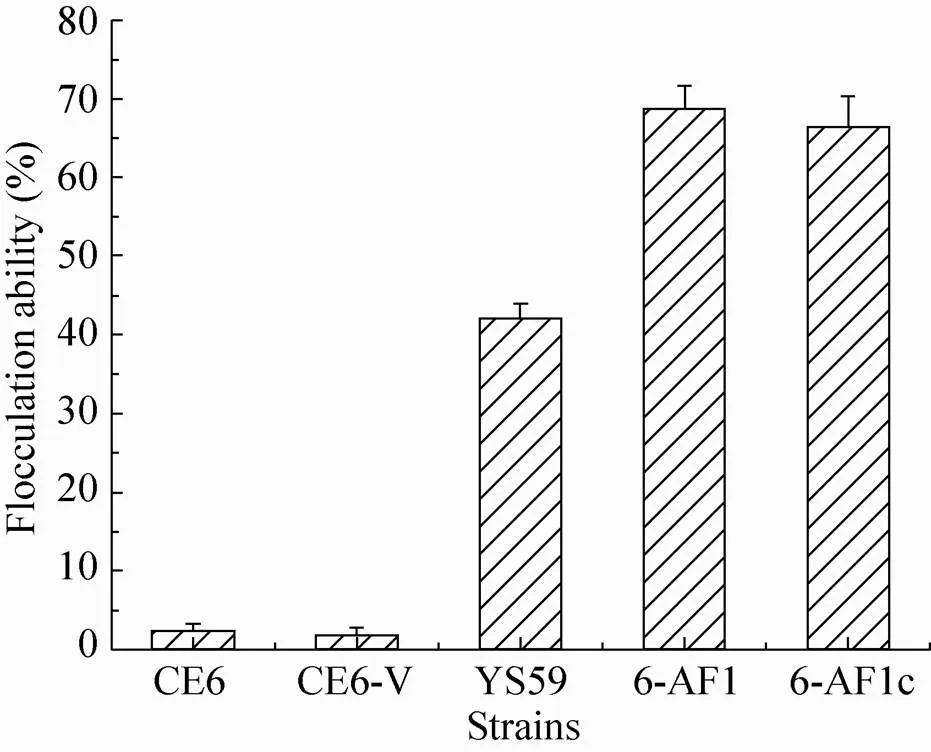
图1 不同酵母菌株絮凝能力比较
2.2 絮凝基因表达对酵母菌胁迫耐受性影响
在含不同浓度乙醇、糠醛及乙酸的YPD固体培养基上比较不同酵母菌株的生长情况,发现在乙醇和糠醛胁迫条件下,对照菌株CE6-V与重组菌株6-AF1和6-AF1c之间没有表现出明显的生长差异,但表达絮凝基因的工业酿酒酵母在乙酸胁迫条件下的细胞生长明显优于对照菌株(图2)。检测的所有6-AF1和6-AF1c菌株均表现出对乙酸胁迫的耐受性。表明絮凝基因的表达对工业酿酒酵母CE6的乙醇和糠醛胁迫耐受性没有明显影响,但提高了酵母菌应对乙酸胁迫的耐受性。
进一步在含不同浓度乙酸的YPD液体培养基中比较不同酵母菌株的生长情况。结果发现在0.6%–1.0% (/) 乙酸胁迫下,重组菌株6-AF1和6-AF1c的乙酸胁迫耐受性分别是对照菌株的1.3–2.5倍和1.5–2.9倍(图3),说明通过表达絮凝基因赋予工业酿酒酵母絮凝特性可以明显提高酵母菌应对乙酸胁迫的耐受性,而且絮凝基因内重复序列单元C缺失使工业酿酒酵母表现出更高的乙酸胁迫耐受性。
2.3 乙酸胁迫下的发酵性能比较
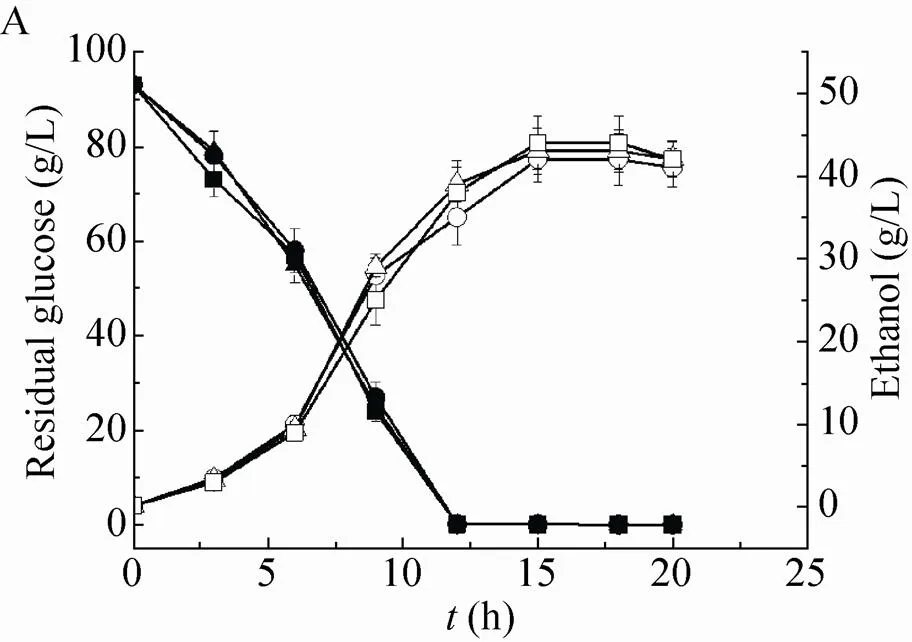
乙醇发酵实验结果表明,在无乙酸胁迫条件下,对照菌株CE6-V与重组菌株6-AF1和6-AF1c表现出非常相似的发酵性能,发酵12 h 后葡萄糖消耗完,乙醇浓度在15 h达到最高(图4A)。在乙酸胁迫条件下,对照菌株和重组菌株的细胞生长和发酵速率均受到明显抑制,但絮凝型的重组菌株表现出了更高的乙醇产率。在0.6% (/) 乙酸胁迫条件下(pH 3.70),酵母菌株CE6-V、6-AF1和6-AF1c的乙醇产率分别为1.6,2.5和2.6 g/(L·h) (图4B);当乙酸浓度为0.8% (/) 时(pH 3.61),酵母菌株CE6-V、6-AF1和6-AF1c乙醇产率分别为0.9,1.2 和2.5 g/(L·h) (图4C);乙酸浓度增加到1.0% (/) 时(pH 3.56),对照菌株CE6-V、重组菌株6-AF1和6-AF1c的乙醇产量分别在100 h、70 h和60 h时达最高值,其中6-AF1和6-AF1c的乙醇产率分别是对照菌株CE6-V的1.21倍和1.78倍 (图4D)。在所有实验条件下,带有空载体的对照菌株CE6-V表现出与宿主菌CE6相同的发酵性能。检测的所有6-AF1 菌株之间或6-AF1c菌株之间发酵性能没有明显差异。添加乙酸使发酵培养基的pH有所降低,增强了乙酸的细胞毒性。在乙酸毒性增加的条件下,絮凝型重组菌株6-AF1和6-AF1c表现出明显优于对照菌株的发酵性能。可见絮凝基因的表达可以明显提高工业酿酒酵母的乙酸胁迫耐受性,缩短乙酸胁迫条件下的发酵周期;特别是内重复序列单元C缺失后使这种效果更加明显,使酵母菌株在乙酸胁迫条件下表现出更高的乙醇生产速率。

图2 空载体转化菌株CE6-V及絮凝型重组酵母菌6-AF1和6-AF1c在不同胁迫条件下的生长情况

发酵结束后收集酵母细胞,检测各酵母菌株的絮凝能力(图5)。宿主菌CE6及空载体转化菌株CE6-V没有表现出絮凝特性,6-AF1和6-AF1c均表现出明显的絮凝特性。在无乙酸胁迫条件下发酵结束后,6-AF1和6-AF1c的絮凝能力是在常规YPD培养基中培养细胞絮凝能力的1.4倍。一方面发酵液中较高浓度乙醇可能增强以p为启动子的絮凝基因的表达,另一方面发酵后期酵母细胞表面特性 (细胞壁构象、细胞表面电荷及疏水性等)发生不同于常规YPD培养的变化,从而影响细胞之间相互作用的强度[24]。在乙酸胁迫条件下发酵结束后,酵母细胞的絮凝能力明显降低;而且与菌株6-AF1c相比,乙酸对菌株6-AF1的絮凝表现出更强的抑制作用。一方面乙酸可能影响絮凝基因的表达,另一方面乙酸影响絮凝蛋白的构象。将无乙酸胁迫条件下发酵结束收集到的6-AF1和6-AF1c细胞重新悬浮于含不同浓度乙酸的絮凝缓冲液中,测定絮凝能力,结果发现不同浓度乙酸对絮凝能力的影响与相应乙酸浓度下发酵结束时菌株的絮凝能力变化趋势基本一致。说明不同乙酸胁迫下絮凝能力的变化可能主要来源于乙酸对絮凝蛋白功能的影响。而且与完整的絮凝蛋白Flo1相比,Flo1c在乙酸胁迫压力下的空间构象更稳定。这使得在高浓度乙酸胁迫条件下,6-AF1c表现出了比6-AF1更高的絮凝能力,这可能是菌株6-AF1c在乙酸胁迫条件下具有更高乙醇生产速率的重要原因。
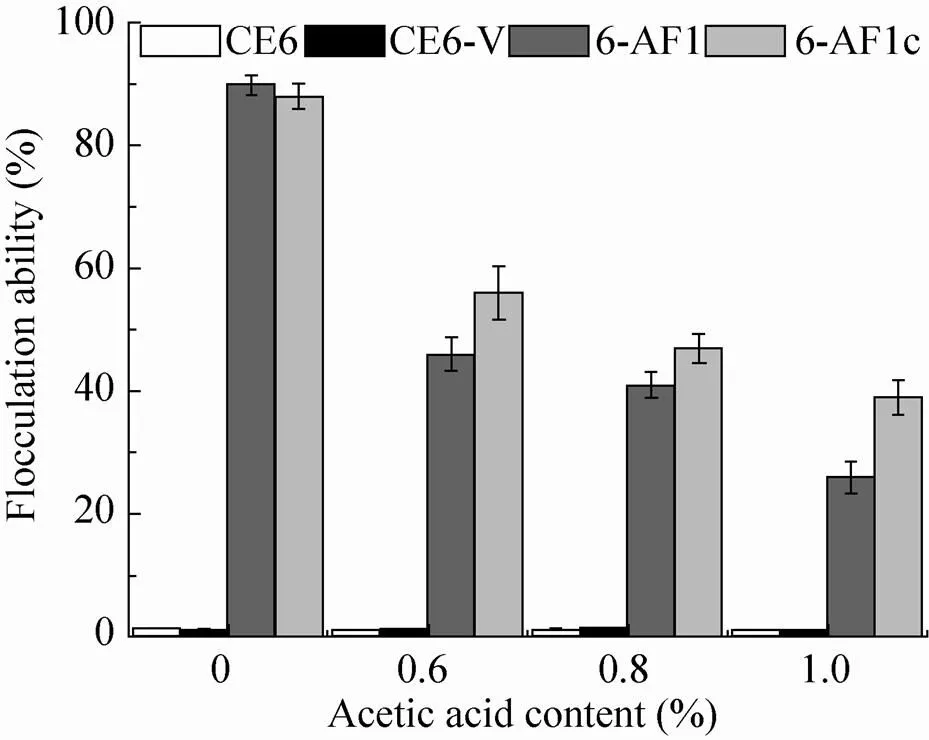
图5 不同酵母菌株乙酸胁迫发酵结束时絮凝能力比较
3 讨论
酵母菌在发酵过程中常常面临多种环境胁迫,严重地制约着发酵工业的生产效率。增强发酵菌种的工业环境适应性和鲁棒性对提高生产效率、降低生产成本具有重要意义。絮凝,作为细胞之间粘附的一种方式,不仅是工业发酵过程提供细胞分离及产品澄清的有效方法,同时也是细胞应对环境胁迫的一种保护机制。一方面通过絮凝形成细胞团,外层细胞可以为内层细胞提供保护屏障,另一方面絮凝过程的发生可能激发细胞内环境的重构,从而产生对外环境的适应性。Smukalla等的研究发现絮凝可以使酵母细胞在乙醇压力下的细胞存活率提高2倍[18]。在本研究中,絮凝型重组菌株及其非絮凝原始菌株在乙醇胁迫下的细胞生长没有明显的差异,这种与Smukalla等的研究结果的不一致性可能与宿主菌的遗传背景有关[18]。然而,本研究首次发现在工业酿酒酵母中表达絮凝基因可以明显提高酵母菌应对乙酸胁迫的耐受性,从而缩短乙酸胁迫条件下的发酵周期,提高产物生成速率。而且,絮凝基因中重复序列单元C发生缺失使酵母菌表现出更强的乙酸胁迫耐受性和胁迫条件下更高的乙醇产率,这与重复序列单元C缺失的絮凝蛋白Flo1cp比絮凝蛋白Flo1p具有更高的构象稳定性有 关[17]。乙酸胁迫条件下发酵结束后,菌株6-AF1c表现出比6-AF1高的絮凝能力也说明了这一点。表达重复序列单元C缺失衍生基因在提高工业酿酒酵母乙酸胁迫耐受性上的有效性,不但为提高生物质乙醇发酵效率提供了技术途径,也将为提升酵母菌所参与的其他发酵工业过程效率提供重要思路。在对酿酒酵母遗传修饰中,宿主菌遗传背景有时对遗传修饰效果产生一定影响[25-26]。通过对酵母菌絮凝能力的遗传改造增强酵母细胞对乙酸胁迫的耐受性是否受宿主菌遗传背景影响还需进一步研究,以便更好地指导絮凝特性在发酵工业中的应用。
REFERENCES
[1] Tan K, Lee K, Mohamed A. Role of energy policy in renewable energy accomplishment: the case of second-generation bioethanol. Energ Policy, 2008, 36(9): 3360–3365.
[2] Benjaphokee S, Hasegawa D, Yokota D, et al. Highly efficient bioethanol production by astrain with multiple stress tolerance to high temperature, acid and ethanol. Nat Biotechnol, 2012, 29(3): 379–386.
[3] Keating JD, Panganiban C, Mansfield SD. Tolerance and adaptation of ethanologenic yeasts to lignocellulosic inhibitory compounds. Biotechnol Bioeng, 2006, 93(6): 1196–1206.
[4] Almeida JRM, Modig T, Petersson A, et al. Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates by. J Chem Technol Biotechnol, 2007, 82(4): 340–349.
[5] Palmqvist E, Hahn-Hägerdal B. Fermentation of lignocellulosic hydrolysates. II: inhibitors and mechamisms of inhibition. Bioresour Technol, 2000, 74(1): 25–33.
[6] Ferrari MD, Neirotti E, Albornoz C, et al. Ethanol production from eucalyptus wood hemicellulose hydrolysate by. Biotechnol Bioeng, 1992, 40(7): 753–759.
[7] Phowchinda O, Delia-Dupuy ML, Strehaiano P. Effects of acetic acid on growth and fermenting activity of. Biotechnol Lett, 1995, 17(2): 237–242.
[8] Zhang JG, Liu XY, He XP, et al. Improvement of acetic acid tolerance and fermentation performance ofby disruption of theaquaglyceroporin gene. Biotechnol Lett, 2011, 33(2): 277–284.
[9] Zheng DQ, Wu XC, Wang PM, et al. Drug resistance marker-aided genome shuffling to improve acetic acid tolerance in. J Int Microbiol Biotechnol, 2011, 38(3): 415–422.
[10] Bauer FF, Govender P, Bester MC. Yeast flocculation and its biotechnological relevance. Appl Microbiol Biotechnol, 2010, 88(1): 31–39.
[11] Cunha AF, Missawa SK, Gomes LH, et al. Control by sugar offlocculation for industrial ethanol production. FEMS Yeast Res, 2006, 6(2): 280–287.
[12] Ma K, Wakisaka M, Sakai K, et al. Flocculation characteristics of an isolated mutant flocculentstrain and its application for fuel ethanol production from kitchen refuse. Bioresour Technol, 2009, 100(7): 2289–2292.
[13] Li Q, Zhao XQ, Chang AK, et al. Ethanol-induced yeast flocculation directed by the promoter ofencoding trehalose-6-phosphate synthase 1 for efficient ethanol production. Metab Eng, 2012, 14(1): 1–8.
[14] Verstrepen KJ, Jansen A, Lewitter F, et al. Intragenic tandem repeats generate functional variability. Nat Genet, 2005, 37(9): 986–990.
[15] Sato M, Watari J, Shinotsuka K. Genetic instability in flocculation of bottom-fermenting yeast. J Am Soc Brew Chem, 2001, 59(3): 130–134.
[16] Li EE, Chang Q, Guo XN, et al. Regulation of tandem repeats on the function of flocculation protein in. Acta Microbiol Sin, 2012, 52(1): 69–76 (in Chinese).李娥娥, 常琦, 郭雪娜, 等. 衔接重复序列对酵母菌絮凝蛋白功能的调控作用. 微生物学报, 2012, 52(1): 69–76.
[17] Li E, Yue F, Chang Q, et al. Deletion of intragenic tandem repeats in unit C ofofincreases the conformational stability of flocculin under acidic and alkaline conditions. PLoS ONE, 2013, 8(1): e53428
[18] Smukalla S, Caldara M, Pochet N, et al.is a variable green beard gene that drives biofilm-like cooperation in budding yeast. Cell, 2008, 135(4): 726–737.
[19] Sambrook J, Russell D. Molecular Cloning: A Laboratory Manual. New York: Cold Spring Harbor Laboratory Press, 2001.
[20] Adams A, Gottschling DE, Kaiser CA, et al. Methods in Yeast Genetics//A Cold Spring Harbor Laboratory Course Manual. New York: Cold Spring Harbor Laboratory Press, 1997.
[21] Yue F, Du ZL, Guo XN, et al. Effect of tandem repeats adjacent to 3′-ternminal ofon the flocculation function of. Acta Microbiol Sin, 2013, 53(12): 1276–1284 (in Chinese).岳峰, 杜昭励, 郭雪娜, 等.基因靠近3′端重复序列对酵母菌絮凝蛋白功能的调控. 微生物学报, 2013, 53(12): 1276–1284.
[22] Ando A, Nakamura T, Murata Y, et al. Identification and classification of genes required for tolerance to freeze-thaw stress revealed by genome-wide screening ofdeletion strains. FEMS Yeast Res, 2007, 7(2): 244–253.
[23] Lu Y, Cheng YF, He XP, et al. Improvement of robustness and ethanol production of ethanologenicunder co-stress of heat and inhibitors. J Ind Microbiol Biotechnol, 2012, 39(1): 73–80.
[24] Verstrepen KJ, Derdelinckx G, Verachtert H, et al. Yeast flocculation: what brewers should know. Appl Microbiol Biotechnol, 2003, 61(3): 197–205.
[25] Matsushika A, Inoue H, Murakami K, et al. Bioethanol production performance of five recombinant strains of laboratory and industrial xylose-fermenting. Bioresour Technol, 2009, 100(8): 2392–2398.
[26] Feng X, Zhao H. Investigating host dependence of xylose utilization in recombinantstrains using RNA-seq analysis. Biotechnol Biofuels, 2013, 6(1): 1–17.
(本文责编 郝丽芳)
Improvement of acetic acid tolerance and fermentation performance of industrialby overexpression of flocculent geneand
Zhaoli Du1,2, Yanfei Cheng1, Hui Zhu1,2, Xiuping He1, and Borun Zhang1
1,,,100101,2,100049,
Flocculent geneand its truncated formwith complete deletion of repeat unit C were expressed in a non-flocculent industrial strainCE6 to generate recombinant flocculent strains 6-AF1 and 6-AF1c respectively. Both strains of 6-AF1 and 6-AF1c displayed strong flocculation and better cell growth than the control strain CE6-V carrying the empty vector under acetic acid stress. Moreover, the flocculent strains converted glucose to ethanol at much higher rates than the control strain CE6-V under acetic acid stress. In the presence of 0.6% (/) acetic acid, the average ethanol production rates of 6-AF1 and 6-AF1c were 1.56 and 1.62 times of that of strain CE6-V, while the ethanol production rates of 6-AF1 and 6-AF1c were 1.21 and 1.78 times of that of strain CE6-V under 1.0% acetic acid stress. Results in this study indicate that acetic acid tolerance and fermentation performance of industrialunder acetic acid stress can be improved largely by flocculation endowed by expression of flocculent genes, especially.
industrial,flocculen gene, acetic acid tolerance, fermentationperformance
May 9, 2014; Accepted: May 23, 2014
Xiuping He. Tel: +86-10-64807356; E-mail: hexp@im.ac.cn
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2012AA022106).
国家高技术研究发展计划 (863计划) (No. 2012AA022106) 资助。

