邻苯二甲酸二辛酯和砷联合暴露对小鼠的神经毒性及其机制
吴雪山,赵婷,茆广华,吴向阳,周兆祥,邹艳敏,邹烨,Samuel Jerry Cobbina,刘红阳,仰榴青
(江苏大学1.化学化工学院,2.环境与安全工程学院,3.药学院,4.食品与生物工程学院,江苏镇江212013)
邻苯二甲酸二辛酯和砷联合暴露对小鼠的神经毒性及其机制
吴雪山1,赵婷1,茆广华2,吴向阳2,周兆祥1,邹艳敏3,邹烨4,Samuel Jerry Cobbina2,刘红阳2,仰榴青1
(江苏大学1.化学化工学院,2.环境与安全工程学院,3.药学院,4.食品与生物工程学院,江苏镇江212013)
目的:研究邻苯二甲酸二辛酯(DOP)和砷(As)联合暴露对小鼠的神经毒性及其初步作用机制。方法:将40只清洁级雄性3周龄ICR小鼠随机分为4组,即空白对照组、DOP组(1 000 mg/kg,灌胃)、As组(10 mg/L,饮用)和DOP+As组(DOP 1 000mg/kg,As10mg/L)。各组暴露8周后,采用Morris水迷宫实验测试小鼠学习记忆能力,原子吸收法检测脑组织As含量,采用蛋白质印迹法检测小鼠海马组织中Bax、Bcl-2和Caspase-3蛋白的表达,采用试剂盒检测超氧化物歧化酶(SOD)、乙酰胆碱酯酶(AChE)、一氧化氮合酶(NOS)活性以及丙二醛含量。结果:与空白对照组比较,各暴露组小鼠逃避潜伏期均明显升高,平均穿越平台的次数明显减少(P<0.05),小鼠脑组织As含量显著增加(P<0.05),脑SOD和AChE活性显著降低,NOS活性和丙二醛含量明显升高(P<0.05);海马组织Bax和Caspase-3蛋白表达量明显升高,Bcl-2蛋白表达量明显减少(P<0.05),Bax/Bcl-2值显著提高。结论:As和DOP均可引起机体氧化损伤,导致细胞凋亡,从而产生神经毒性;而两者联合暴露毒性复杂,协同作用、拮抗作用和无交互作用并存,其联合作用的机制有待进一步研究。
邻苯二甲酸二辛酯;砷;联合暴露;神经毒性;小鼠
邻苯二甲酸酯(PAEs)也称酞酸酯,常作为工业生产中塑料、树脂和橡胶类制品的增塑剂[1-2],其中邻苯二甲酸二辛酯(dioctyl phthalate,DOP)是用量较大的增塑剂。同时,DOP也是一种环境激素类化合物,可转移至环境中,从而危害人类健康。2001年,我国把DOP列为优先控制污染物之一[3]。砷(As)是广泛分布于自然界中的重金属污染物,可通过多种途径进入人体,产生毒性作用,如生殖毒性、神经毒性等[4-5]。因此,DOP和As同时暴露往往危害人类健康。本文采用行为学、酶学和蛋白质印迹法等方法,研究DOP和As联合暴露对小鼠的神经毒性及初步作用机制,并采用析因分析方法评价其联合毒性作用。
1 材料与方法
1.1 仪器和试剂
TU1800紫外 可见分光光度计(北京普析通用仪器公司);BS124S电子天平(赛多利斯工业称重设备有限公司);Synergy HT酶标仪(美国Bio-Tek公司)。
DOP和NaAsO2购自国药集团化学试剂有限公司;超氧化物歧化酶(SOD)试剂盒、丙二醛试剂盒、乙酰胆碱酯酶(AChE)试剂盒和一氧化氮合酶(NOS)试剂盒均购自南京建成生物工程研究所;兔抗鼠Bax、Bcl-2、Caspase-3和β-肌动蛋白单克隆抗体(山羊抗兔)均购自上海优宁维生物科技有限公司。
1.2 动物
清洁级雄性3周龄ICR小鼠40只,体质量(13.00±2.00)g,购于江苏大学动物实验中心,合格证编号:SYXK(SU)2013-0036。实验前适应性喂养3 d,饲养温度为(24±1)℃,湿度为55%~60 %,光照周期为12~12 h。
1.3 方法
1.3.1 实验设计 将小鼠随机分为4组,即空白对照组、DOP组(1 000 mg/kg)[6]、As组(10 mg/L)[7]和DOP+As组(DOP 1 000 mg/kg,As 10 mg/L)。DOP灌胃暴露,每天1次,As饮用水暴露,并记录各组饮水量,各组暴露时间均为8周,隔天称重并记录。
暴露结束后,进行水迷宫行为学测试。测试结束后,摘眼球取血后处死,迅速取脑、肝脏、肾脏和海马组织,-18℃保存,备用。
1.3.2 水迷宫实验 采用Morris水迷宫测试法[8]测定各暴露组对小鼠学习记忆能力的影响。其中,定位航行实验测定小鼠学习能力,空间探索实验测定小鼠记忆能力。
1.3.3 小鼠脑组织As含量的测定 取小鼠脑组织0.1 g,分别加入8 mL浓硝酸和2 mL高氯酸,硝化,稀硝酸定容至10 mL。采用原子吸收法[9]测定小鼠脑组织的As含量。
1.3.4 组织病理学观察 取小鼠海马组织,制成切片,将切片经过苏木精和伊红染色液染色后,于光学显微镜(Axioskop 40,Zeiss,德国)下观察海马组织的结构形态。
1.3.5 酶活性测定 取小鼠脑组织,冰浴条件下制成10%脑组织匀浆液,备用。采用4种酶检测试剂盒分别测定小鼠脑组织SOD、NOS、AChE的活性和丙二醛含量(具体操作步骤严格按照试剂盒说明书进行)。
1.3.6 蛋白质印迹法检测Bax,Bcl-2和Caspase-3的表达 取100 mg海马组织,加入制好的总蛋白提取液1 mL,将脑组织制成匀浆后14 000 r/min离心5 min,取上清;制备分离胶和积层胶,根据蛋白浓度的测定结果,每孔加20μg蛋白,电泳,封闭,孵一抗、二抗,显色,曝光。采用Quantity One图像分析软件对图像进行分析。
1.4 统计学处理
2 结果
2.1 DOP和As联合暴露对小鼠体质量的影响
DOP和As联合暴露对小鼠体质量的影响见表1。与对照组比较,DOP和As单独暴露对小鼠体质量均无明显影响(P>0.05)。从第4周开始,与空白组、DOP组和As组比较,DOP+As暴露组小鼠的体质量明显降低(P均<0.05)。可见,DOP和As联合暴露可在一定程度上抑制小鼠的生长。析因分析表明,DOP和As联合暴露对小鼠体质量存在交互作用(协同作用,P<0.05)。
表1 DOP和As联合暴露对小鼠体质量的影响n=10,±s,g
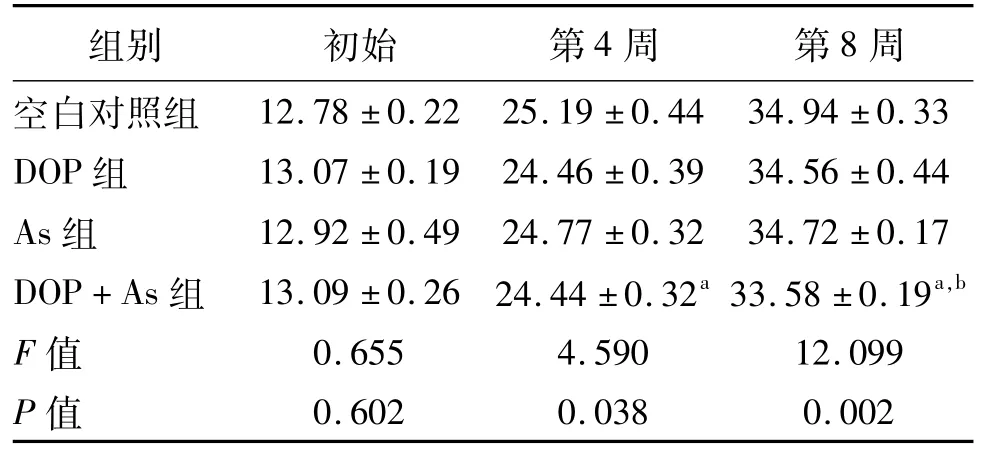
表1 DOP和As联合暴露对小鼠体质量的影响n=10,±s,g
a:P<0.05,与其他3组比较,b:P<0.05,联合暴露存在交互作用
组别 初始 第4周 第8周空白对照组12.78±0.22 25.19±0.44 34.94±0.33 DOP组 13.07±0.19 24.46±0.39 34.56±0.44 As组 12.92±0.49 24.77±0.32 34.72±0.17 DOP+As组 13.09±0.26 24.44±0.32a 33.58±0.19a,b F值 0.655 4.590 12.099 P值0.602 0.038 0.002
2.2 DOP和As联合暴露对小鼠学习记忆能力的影响
与对照组比较,DOP组、As组和DOP+As组小鼠逃避潜伏期明显增加(P<0.05),平均穿越平台的次数明显减少(P<0.05);与As组比较,DOP+ As组小鼠逃避潜伏期明显增加,平均穿越平台的次数明显减少;DOP+As组与DOP组小鼠逃避潜伏期和平均穿越平台的次数间的差异无统计学意义。见图1。可见,DOP和As联合暴露可影响小鼠学习记忆能力。析因分析表明,DOP和As联合暴露对小鼠逃避潜伏期和平均穿越平台的次数均无交互作用(P>0.05)。
2.3 DOP和As联合暴露对小鼠脑组织As含量的影响
原子吸收法检测结果显示,DOP+As组与As组As含量分别为(5.93±0.26)μg/g,(5.92± 0.28)μg/g,均明显高于DOP组[(1.14±0.25)μg/g]和空白对照组[(1.53±0.30)μg/g],差异有统计学意义(P<0.05)。析因分析表明,DOP和As联合暴露对小鼠脑组织As含量不存在交互作用(P>0.05)。

图1 各组小鼠水迷宫测试结果
2.4 小鼠海马组织病理学变化
HE染色显示,与空白对照组比较,DOP组、As组和DOP+As组小鼠海马区发生了明显的病理学改变,如CA1区的锥体细胞和齿状回区的颗粒细胞排列松散,形态不规则且细胞边缘不清晰。见图2。

图2 DOP和As联合暴露对小鼠海马组织齿状回和CA1区的影响(HE染色×20)
2.5 小鼠脑组织SOD、NOS、AChE活性和丙二醛的含量
与对照组比较,DOP、As和DOP+As暴露组小鼠脑组织总NOS和诱导型NOS(iNOS)活性明显升高,丙二醛含量明显增加(P均<0.05),而SOD活性明显降低(P<0.05),DOP和DOP+As暴露组AChE活性明显降低(P<0.05);DOP+As组丙二醛、AchE含量和总NOS活性均明显高于As组(P均<0.05),丙二醛含量和总NOS活性显著高于DOP组(P<0.05)。可见DOP和As单独及联合暴露均可致小鼠产生氧化应激。析因分析表明,DOP和As联合暴露对小鼠脑组织AChE活性存在交互作用(拮抗作用,P<0.05),而对小鼠脑组织SOD、NOS活性和丙二醛含量均无交互作用(P>0.05)。见表3。
表3 各组小鼠脑组织SOD、NOS、AChE活性和丙二醛含量的比较 n=10,±s

表3 各组小鼠脑组织SOD、NOS、AChE活性和丙二醛含量的比较 n=10,±s
a:P<0.05,与空白对照组比较;b:P<0.05,与DOP组比较;c:P<0.05,与As组比较;d:P<0.05,联合暴露存在交互作用
组别 SOD(U/mg) 丙二醛(μg/mg) AChE(μg/mg) 总NOS(U/mg) iNOS(U/mg )空白对照组 26.05±0.60 9.81±0.56 0.305±0.021 10.91±0.7 0.002 0.000 0.000 0.000 0.010 5.02±0.55 DOP组 22.18±0.97a 12.31±0.42a 0.251±0.014a 13.56±1.45a 6.87±1.67a As组 23.23±0.95a 12.29±0.70a 0.299±0.018 13.10±0.55a 6.78±0.51a DOP+As组 20.34±1.40a 13.92±0.33a,b,c 0.243±0.014a,c,d 14.79±1.31a,b,c 7.51±0.54a F值 13.409 31.898 32.005 28.743 7.634 P值
2.6 小鼠海马组织Bax、Bcl-2和Caspase-3表达的变化
蛋白质印迹检测结果显示,与对照组比较,DOP、As和DOP+As暴露组小鼠海马组织Bax蛋白和Caspase-3蛋白的表达量均明显上调(P<0.05),而Bcl-2表达量显著下调(P<0.05),Bax/Bcl-2值显著提高(P<0.05);DOP+As组Bax和Bcl-2蛋白的表达与DOP组间的差异均有统计学意义,与As组间则无明显差异(图3、4)。析因分析表明,DOP和As联合暴露对小鼠海马组织Bax、Bcl-2和Caspase-3的表达不存在交互作用。

图3 DOP和As联合暴露对Bax和Bcl-2表达的影响及Bax/Bcl-2的变化

图4 DOP和As联合暴露对小鼠海马组织Caspase-3表达的影响
3 讨论
DOP和As单独暴露对人体健康均有害,且DOP和As同时摄入的概率非常高,比如饮水、食物摄取等,因此,研究DOP和As的联合毒性对人类健康具有重要的现实意义。
砷化合物进入血液以后,主要与血红蛋白中的珠蛋白和血浆蛋白结合,通过血液循环转运至体内各组织。本文结果表明,与对照组比较,As暴露组小鼠脑组织As含量显著升高(P<0.05),DOP和As联合暴露对小鼠脑组织As含量不存在交互作用。可见,As可蓄积于脑组织中,研究结果与王晓旭[10]的报道一致。
氧化应激可影响神经突触的可塑性,枝蔓状结构和神经的形成,可导致神经类疾病,如血管性痴呆、阿尔茨海默病等[11]。As暴露可致抗氧化损伤,从而引发神经细胞凋亡。SOD是一种重要的抗氧化酶,可催化超氧化物通过歧化反应转化为氧气和过氧化氢酶,抗氧化应激[12]。丙二醛是自由基氧化分解的终极产物,是氧化应激产生的指示器[13]。Shila等[14]研究发现As暴露能引起小鼠体内抗氧化酶活性下降,脂质过氧化水平及丙二醛含量升高,同时脑组织内的自由基介质变性,小脑、海马回和大脑皮质层等部位的SOD、过氧化氢酶均呈下降趋势。在本实验中,与对照组相比,DOP、As和DOP+ As暴露组小鼠脑组织SOD活性均显著降低(P<0.05),丙二醛含量显著增加(P<0.05);与As组相比,DOP+As组丙二醛含量显著增加,与DOP组相比,差异无统计学意义。可见,DOP和As单独及联合暴露可致小鼠氧化应激增强,从而损伤其抗氧化系统。析因分析表明,DOP和As联合暴露对小鼠脑SOD活性和丙二醛含量无交互作用。
中枢神经递质是调节机体生理活动的重要物质基础。AChE是一种参与乙酰胆碱代谢且具有调节胆碱突触功能的酶,在学习记忆方面具有重要作用[15],其活性是As神经毒性的重要指标。研究表明[16],NO过多会致神经元损伤,甚至出现局部出血。NOS分布在脑组织,其活性被认为是产生NO的一种指示器。在本实验中,与对照组相比,DOP、As和DOP+As暴露组小鼠脑组织AChE活性显著降低(P<0.05),总NOS和iNOS活性显著升高(P<0.05);与As组相比,DOP+As组AchE含量和总NOS活性均显著增加,与DOP组相比,差异无统计学意义。神经递质的变化可为神经系统毒性提供实验依据,这种变化可影响小鼠神经行为,即学习记忆能力。本研究中水迷宫实验结果表明,暴露组小鼠学习记忆能力明显低于空白对照组(P<0.05)。因此,抗氧化系统的损伤和神经递质的变化可能是导致小鼠学习记忆能力下降的原因。此外,析因结果说明DOP和As联合暴露对小鼠脑AchE含量存在拮抗作用,对NOS活性不存在交互作用。
细胞凋亡不仅具有重要的生物学意义,而且具有复杂的分子生物学机制。Bcl-2家族是调节凋亡的蛋白,由促进细胞凋亡的蛋白(如Bax)和抑制细胞凋亡的蛋白(如Bcl-2)构成,其中Bax/Bcl-2的比值可反映细胞凋亡的程度[17]。Caspase家族在细胞凋亡过程中起着重要的作用,其中Caspase-3是哺乳动物体内细胞凋亡的关键蛋白酶。当细胞凋亡时,Caspase-3会被激活,因此检测Caspase-3的表达可以反映出细胞凋亡情况。本研究结果发现,与对照组相比,As、DOP和As+DOP暴露组Bax的表达量显著上调,Bcl-2显著下调,Bax/Bcl-2值显著升高,且Caspase-3表达量显著增加。可见,暴露后小鼠海马组织内Caspase-3被激活,神经细胞开始凋亡。此外,析因结果说明DOP和As联合暴露对小鼠海马Bax、Bcl-2和Caspase-3的表达均无交互作用。
应用析因分析进行联合毒性研究降低了分析工作量,且可有效评价两种污染物联合毒性,通过析因分析可容易分析出两种污染物产生的毒性是协同,拮抗还是可以简单相加。然而文中产生联合作用的类型复杂,有协同作用、拮抗作用和无交互作用,因此,产生这种联合作用的机制还有待进一步研究。
[1] Kam rin MA.Phthalate risks,phthalate regulation,and public health:a review[J].JToxicol Environ Health B Crit Rev,2009,12(2):157-174.
[2] 李幸.聚醚酯增塑剂的合成及在橡胶中应用研究[D].广州:华南理工大学,2012.
[3] 史辛斌.城市污水中环境内分泌干扰物分布特征及其处理特性[D].西安:西安建筑科技大学,2007.
[4] Kile ML,Mazumdar M.Arsenic and development toxicity and reproductive disorders[M]//Flora SJS.Handbook of Arsenic Toxicology.Amsterdam:Elsevier Inc,2015:521-532.
[5] Tolins M,Ruchirawat M,Landrigan P.The development neurotoxicity of arsenic:cognitive and behavioral consequences of early life exposure[J].Ann Glob Health,2014,80(4):303-314.
[6] 王明霞,赵淑华,李雪,等.邻苯二甲酸二辛酯与氯仿联合染毒对雄性小鼠的神经毒性[J].环境与健康杂志,2011,28(9):782-784.
[7] 孙宝飞,康朝胜,余资江,等.慢性砷中毒对小鼠齿状回caspase-3表达的影响[J].环境与健康杂志,2011,28(7):579-582.
[8] 宿艳敏.Morris水迷宫实验中三种小鼠的学习能力及其性别差异[D].石家庄:河北医科大学,2013.
[9] Habibi E,Ghanemi K,Fallah-Mehrjardi M,et al.A novel digestionmethod based on a choline chloride-oxalic acid deep eutectic solvent for determining Cu,Fe,and Zn in fish samples[J].Anal Chim Acta,2013,762:61-67.
[10] 王晓旭.亚慢性砷暴露对小鼠脑组织多种必需微量元素浓度的影响[D].大连:大连医科大学,2013.
[11] 陈罕.SIRT1信号通路通过氧化应激参与大鼠慢性脑缺血致认知损伤的研究[D].长春:吉林大学,2013.
[12] Fang Y,Yang H,Liu B,etal.Transcriptional response of lysozyme,metallothionein,and superoxide dismutase to combined exposure to heavy metals and bacteria in Mactra veneriformis[J].Comp Biochem Physiol C Toxicol Pharmacol,2013,157(1):54-62.
[13] Yang TC,Chen YJ,Chang SF,et al.Malondialdehyde mediates oxidized LDL-induced coronary toxicity through the Akt-FGF2 pathway via DNA methylation[J].JBiomed Sci,2014,21:11.
[14] Shila S,Kokilavani V,Subathra M,etal.Brain regional responses in antioxidant system toα-lipoic acid in arsenic intoxicated rat[J].Toxicology,2005,210(1):25-36.
[15] 余锋,徐波,孙立岩,等.跑台运动缓解D-半乳糖AD大鼠学习记忆能力下降及其与海马ChAT,AchE的关系[J].北京体育大学学报,2013,36(3):62 -66.
[16] Wang CH,Hsiao CK,Chen CL,et al.A review of the epidemiologic literature on the role of environmentalarsenic exposure and cardiovascular diseases[J].Toxicol Appl Pharm,2007,222(3):315-326.
[17] Xu J,Lian LJ,Wu C,et al.Lead induces oxidative stress,DNA damage and alteration of p53,Bax and Bcl-2 expressions in mice[J].Food Chem Toxicol,2008,46(5):1488-1494.
Neurological effects of co-exposure of dioctyl phthalate and arsenic in m ice and associated mechanism
WU Xue-shan1,ZHAO Ting1,MAO Guang-hua2,WU Xiang-yang2,ZHOU Zhao-xiang1,ZOU Yan-min3,ZOU Ye4,Samuel Jerry Cobbina2,LIU Hong-yang2,YANG Liu-qing1
(1.School of Chemistry and Chemical Engineering,2.School of the Environment and Safety Engineering,3.School of Pharmacy,4.School of Food and Biological Engineering,Jiangsu University,Zhenjiang Jiangsu 212013,China)
Objective:To investigate the neurological effect of exposure to individual and mixtures of dioctyl phthalate(DOP)and arsenic(As)inmice and to discuss resultant preliminarymechanisms associated with the effects.M ethodsDOP(1 000 mg/kg,i.g.)and As(10 mg/L,p.o.)were administered individually and asmixtures to 4 groups ofmice.After 8 weeks of exposure,the enzyme activity,learning and memory abilities and As content in brain ofmice were assessed by commercial kits,Morriswatermase test and Vista-MPX Simultaneous ICP-OES.The expression of Bax,Bcl-2 and Caspase-3 were performed by Western blot.Results:Mice demonstrated poorer learning and memory performance in exposure groups compared to control.The As level of brain in exposure groups were significantly increased(P<0.05).AChE and SOD activities decreased,however,MDA and NOS showed an increase in exposure groups compared to control.The expression of caspase-3 and Bax were significantly increased but Bcl-2 expression was inhibited in the hippocampus,and Bax/Bcl-2 increased.Conclusion:Both DOP and As can induce neurotoxicity inmice associated with hippocampal apoptosiswhich caused by oxidative stress.The joint toxicity of DOP and As was complicated.Effect of antagonism,synergistic or without interaction were all observed.Themechanism needs to be further studied.
book=295,ebook=24
dioctyl phthalate;arsenic;co-exposure;neurotoxicity;mice
X503.22
A
1671-7783(2015)04-0294-05
10.13312/j.issn.1671-7783.y150095
吴雪山(1989—),男,硕士研究生;仰榴青(通讯作者),教授,博士生导师,E-mail:yangliuqing@ujs.edu.cn
2015-04-28 [编辑] 陈海林

