BTLA与HVEM相互作用对T细胞活化的影响
王芸芸,蒋玉平,张标,顾宗江
(1.苏州大学基础医学与生物科学学院免疫学系,江苏苏州215007;2.盐城市产品质量监督检验所,江苏盐城224005)
BTLA与HVEM相互作用对T细胞活化的影响
王芸芸1,蒋玉平2,张标1,顾宗江1
(1.苏州大学基础医学与生物科学学院免疫学系,江苏苏州215007;2.盐城市产品质量监督检验所,江苏盐城224005)
目的:探讨小鼠髓系树突状细胞(BMDC)上HVEM与T细胞上BTLA相互作用对T细胞活化的影响。方法:C57BL/6小鼠的BMDC与T细胞混合培养,HVEM抗体封闭BMDC上的HVEM后,采用MTT法检测T细胞的活化增殖,ELISA试剂盒检测IL-2的分泌。结果:混合培养的启动和早期(0~48 h)、中晚期(48~96 h)以及全程(0~96 h),加入HVEM抗体实验组的T细胞增殖效应均明显高于对照组(P<0.05),同时CD3+T细胞组和CD4+T细胞组IL-2的分泌明显高于对照组(P<0.05)。结论:BTLA-HVEM相互作用产生的负性信号对T细胞的活化起抑制作用,特别是在BMDC与T细胞混合培养的启动和早期(0~48 h),BTLA负性信号就有抑制T细胞活化的作用,有别于传统的负反馈调节抑制,提示T细胞的活化可能存在多种负性调节模式。
BTLA;T细胞;免疫调节
BTLA(B and T lymphocyte attenuator)是进行基因筛选时,在T细胞上发现的第3个负性共分子,属于Ⅰ型跨膜糖蛋白,相对分子质量为34.5×103,具有免疫球蛋白可变区(IgV)样结构域的胞外段、跨膜区和100个氨基酸组成的胞内段。其中胞内段具有3个重要的含酪氨酸残基的基序,分别为Grb2结合基序、免疫受体酪氨酸抑制基序和免疫受体酪氨酸转化基序,表明BTLA具有与CTLA和PD-1相似的结构[1-4]。最初推测B7x可能是BTLA的配体,然而缺乏两者结合的直接证据。以后研究证实,TNF受体超家族成员HVEM(herpesvirus entrymediator)是BTLA的配体。HVEM与BTLA结合,可以诱导BTLA胞内酪氨酸磷酸化,进而招募磷酸酶SHP-1和SHP-2,抑制T细胞的活化[5-9]。HVEM作为受体又可结合TNF超家族成员LIGHT,传递促进T细胞活化的正向信号[10-12]。BTLA、HVEM和LIGHT表达在多种免疫细胞上,同时又受到细胞活化状态的调节[13-14]。这种复杂的表达方式和正负信号交织使得T细胞的免疫应答受到更精确的调节。因此,对BTLA在T细胞上的负性调节作用的研究具有重要的意义。
1 材料与方法
1.1 材料与试剂
抗小鼠HVEM多抗、rmGM-CSF和rm IL-4(R&D公司);RPMI 1640培养基(Gibco公司);胎牛血清(FCS,杭州四季青公司);CD11c-FITC抗体(eBioscience公司);淋巴细胞分离液(Ficoll,上海生化试剂二厂);CD11c、CD3、CD4和CD8小鼠阳性磁珠分选试剂盒(Stemcell公司);流式细胞仪(Altra,Beckman-Coulter公司);全自动酶标仪(Bio-Rad公司)。6~8周龄的C57BL/6小鼠购自中国科学院上海实验动物中心,由苏州大学动物实验中心饲养。
1.2 方法
1.2.1 小鼠髓系树突状细胞(BMDC)的诱导及纯化 无菌取6~8周C57BL/6小鼠骨髓细胞,经Tris-NH4Cl低渗溶解红细胞,PBS洗涤2遍后调整细胞密度至5×105/mL,于含10 ng/mL rmGM-CSF和4 ng/mL rm IL-4的RPMI 1640完全培养基(含10%胎牛血清,2mmol/L谷氨酰胺,100 U/mL青霉素和100 U/mL链霉素)的24孔培养板中培养,培养第3天半量换液,再培养2~3 d,收集非贴壁细胞,用CD11c-FITC抗体标记后进行流式细胞仪检测,然后按照磁珠分选试剂盒的说明,以CD11c阳性分选磁珠进行分选并获取BMDC,简称DC。
1.2.2 小鼠脾脏T细胞的获取与纯化 无菌取6~8周C57BL/6小鼠脾脏,使用5 mL注射器冲洗出脾脏细胞,PBS洗2遍。Tris-NH4Cl低渗溶解红细胞后,用Ficoll分离出淋巴细胞,按照磁珠分选试剂盒的说明,分别以CD3、CD4和CD8磁珠进行阳性分选,获得CD3+、CD4+和CD8+T细胞。
1.2.3 混合淋巴细胞培养 将纯化后的DC以1× 104/孔、T细胞以1.5×105/孔密度加入96孔板。加HVEM抗体的DC与T细胞混合培养实验分为3组:一组加入HVEM抗体后培养4 d;一组加入HVEM抗体后培养2 d;最后一组不加抗体培养2 d,再加入HVEM抗体继续培养2 d。各组HVEM抗体的质量浓度为10 ng/mL。同时设置加同型IgG的DC与T细胞混合培养对照组。以上各组根据T细胞的不同,每组又细分为CD3+T细胞组、CD4+T细胞组和CD8+T细胞组,各组均设置单独DC和T细胞对照组。
1.2.4 T细胞增殖和细胞因子IL-2检测 以上各组按规定时间培养后,离心吸取上清用于IL-2的检测,然后各组加入20μL MTT溶液(5 mg/mL)继续培养4 h,离心并吸弃上清,每孔用PBS洗涤2次后,加入100μL DMSO彻底溶解结晶,酶标仪上于570 nm波长比色。IL-2的检测采用ELISA检测试剂盒,按照说明书进行操作,不同组别待检上清均设复孔进行检测。
1.3 统计学分析
应用SPSS 13.0软件进行统计学分析,实验组与对照组的比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 DC的诱导与培养结果
C57BL/6小鼠骨髓细胞经过rmGM-CSF和rm IL-4诱导培养5 d后,细胞体积变大,出现成团现象,部分细胞出现树突状突起,吸取非贴壁细胞经流式细胞仪检测,CD11c+的细胞可达50%~68%。经磁珠阳性选择法分选纯化后,所得细胞在镜下观察呈典型的DC形态特征。
2.2 HVEM抗体阻断BTLA-HVEM相互作用,增强T细胞的活化增殖
实验结果表明,当T细胞与DC相互作用时,加入HVEM抗体培养4 d、加入HVEM抗体培养2 d、先不加抗体培养2 d后再加入HVEM抗体继续培养2 d的各实验组的MTT光密度(D)值均高于同组对照组的D值(图1、2、3),差异均有统计学意义(P<0.05),表明加入HVEM抗体阻断了BTLA-HVEM相互作用向T细胞传导的负性抑制信号,使得T细胞的活化增殖加强。加入HVEM抗体培养2 d的实验组实验结果(图2)表明,BTLA-HVEM相互作用产生的负性抑制信号在T细胞活化的启动和早期阶段(0~48 h)即可发挥效应。与对照组相比,先不加抗体培养2 d后再加入HVEM抗体继续培养2 d的实验组也出现了T细胞活化增殖的加强(图3),说明T细胞活化的中晚期(48~96 h)也受到BTLAHVEM相互作用的负性信号影响。与加HVEM抗体只培养2天的实验组相比(图1,2),加HVEM抗体培养4 d的实验组T细胞的增殖效应更强,显示出BTLA-HVEM的负性信号在T细胞活化的全程都发挥作用,包括启动和早期活化阶段。

图1 加入HVEM抗体培养4 d后,T细胞的活化增殖

图2 加入HVEM抗体培养2 d后,T细胞的活化增殖

图3 培养2 d后加入HVEM抗体继续培养2 d,T细胞的活化增殖
2.3 HVEM抗体阻断BTLA-HVEM相互作用,增加IL-2的分泌
在T细胞与DC混合培养时,CD3+T细胞组和CD4+T细胞组中加入HVEM抗体的实验组上清中的IL-2分泌量均高于同组对照组(图4、5、6),差异有统计学意义(P<0.05),上述结果说明,阻断BTLA负性信号可减弱对IL-2分泌的抑制,导致活化T细胞IL-2分泌增加。但CD8+T细胞组分泌的IL-2很低,即使阻断BTLA负性信号,实验组与对照组间IL-2的差异也无统计学意义。
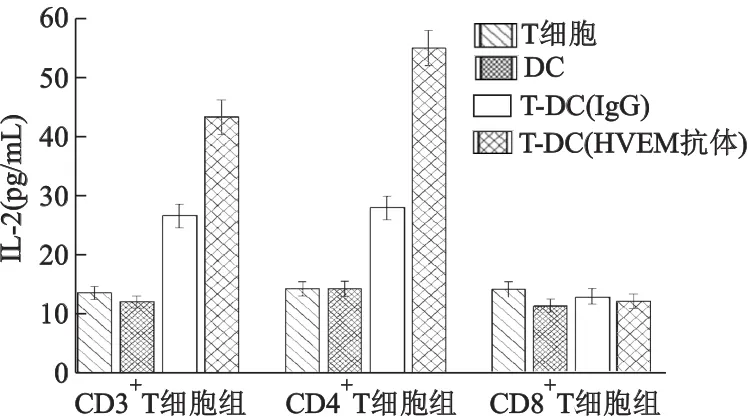
图4 加入HVEM抗体培养4 d后,培养上清中IL-2的含量

图5 加入HVEM抗体培养2 d后,培养上清中IL-2的含量

图6 培养2 d后加入HVEM抗体继续培养2 d,培养上清中IL-2的含量
3 讨论
BTLA是B7-CD28家族中发现的第3个抑制性分子,具有与CTLA-4和PD-1相似的结构。经典的观点认为,CTLA-4和PD-1在静止T细胞上不表达,在双信号的作用下,T细胞被激活并在活化的中晚期表达CTLA-4和PD-1分子,从而通过负反馈调节T细胞的活化,收缩免疫应答,防止T细胞应答过强和过度,因此T细胞活化的负反馈调节被公认为免疫系统自稳的重要机制。BTLA组成性高表达在静止T细胞并且活化后继续表达,BTLA分子的发现者Murphy根据这一特点在2006年提出[13],BTLA可能在T细胞活化的各个阶段(包括启动和早期阶段)发挥负性调节作用,这是一个重要的理论命题,也是一个重要的科学问题,因为现有关于T细胞活化调节的理论,仅有负反馈调节理论,是否存在其他负性调节模式,尚无相关文献报道。2009年Miller等[15]证实BTLA信号可以在免疫应答的早期抑制NKT细胞释放细胞因子和对肝脏组织的损伤。NKT细胞是T细胞中的一个小的亚群,主要参与固有免疫应答。对于主要参与适应性免疫应答的大量其他T细胞群体,仍然没有见到BTLA信号是否在启动和早期阶段对这些T细胞免疫应答进行负性调节的文献报道,这一科学问题仍然没有解决。因此,Murphy等[14]于2010年再次提出BTLA信号可能在T细胞活化的各个阶段均可发挥负性调节作用。但时至今日,在国际上仍然没有学者涉足这一重要科学问题。我们以前在人T细胞上的研究结果,初步证实了BTLA信号可在T细胞活化起始和早期阶段发挥负性调节作用[16],本文结果初步证实了BTLA信号也可在小鼠T细胞活化起始和早期阶段发挥负性调节作用,说明在T细胞活化启动时,不仅有正向的第一、第二信号参与,也有BTLA相关的负性信号参与,对第一、第二信号发挥拮抗作用。上述现象实质上是T细胞活化(或者说T细胞免疫应答)的经典负反馈调节模式之外的另一崭新的负性调节模式,即提高T细胞活化启动阈值来抑制T细胞活化。如果这种崭新的负性调节模式最终得到确证,提示经典的T细胞活化的双信号学说理论存在缺陷,需要修正和完善。
[1] Watanabe N,Gavrieli M,Sedy JR,et al.BTLA is a lymphocyte inhibitory receptor with similarities to CTLA-4 and PD-1[J].Nat Immunol,2003,4(7):670-679.
[2] Han P,Goularte OD,Rufner K,etal.An inhibitory Ig superfamily protein expressed by lymphocytes and APCs is also an early marker of thymocyte positive selection[J].J Immunol,2004,172(10):5931-5939.
[3] Gavrieli M,Sedy JR,Nelson CA,et al.BTLA and HVEM cross talk regulates inhibition and costimulation[J].Adv Immunol,2006,92:157-185.
[4] Croft M.The evolving crosstalk between co-stimulatory and co-inhibitory receptors:HVEM-BTLA[J].Trends in Immunol,2005,26(6):292-294.
[5] Sedy JR,Gavrieli M,Potter KG,et al.B and T lymphocyte attenuator regulates T cell activation through interaction with herpesvirus entry mediator[J].Nat Immunol,2005,6(1):90-98.
[6] Gonzalez LC,Loyet KM,Calemine-Fenaux J,et al.A coreceptor interaction between the CD28 and TNF receptor family members B and T lymphocyte attenuator and herpesvirus entrymediator[J].PNAS,2005,102(4):1116-1121.
[7] Cheung TC,Humphreys LR,Potter KG,et al.Evolutionarily divergent herpesvirusesmodulate T cell activation by targeting the herpesvirus entrymediator cosignaling pathway[J].PNAS,2005,102(37):13218-13223.
[8] Gavrieli M,Murphy KM.Association of Grb-2 and PI3Kp85 with phosphotyrosile peptides derived from BTLA[J].Biochem Biophys Res Commun,2006,345(4):1440-1445.
[9] Gavrieli M,Watanabe N,Loftin SK,et al.Characterization of phosphotyrosine bindingmotifs in the cytoplasmic domain of B and T lymphocyte attenuator required for association with protein tyrosine phosphatases SHP-1 and SHP-2[J].Biochem Biophys Res Commun,2003,312(4):1236-1243.
[10] Kwon BS,Tan K,Ni J,et al.A newly identified member of the tumor necrosis factor receptor superfamily with a wide tissue distribution and involvement in lymphocyte activation[J].JBiol Chem,1997,272(22):14272-14276.
[11] Morel Y,Truneh A,Sweet RW,et al.The TNF superfamilymembers LIGHT and CD154(CD40 ligand)costimulate induction of dendritic cellmaturation and elicit specific CTL activity[J].J Immunol,2001,167(5):2479-2486.
[12] Hsu H,Solovyev I,Colombero A,et al.ATAR,a novel tumor necrosis factor receptor family member,signals through TRAF2 and TRAF5[J].J Biol Chem,1997,272(21):13471-13474.
[13] Murphy KM,Nelson CA,Sedy JR.Balancing co-stimulation and inhibition with BTLA and HVEM[J].Nat Rev Immunol,2006,6(9):671-681.
[14] Murphy TL,Murphy KM.Slow down and survive:enigmatic immunoregulation by BTLA and HVEM[J].Annu Rev Immunol,2010,28:389-411.
[15] Miller ML,Sun Y,Fu YX.B and T lymphocyte attenuator signaling on NKT cells inhibits cytokine release and tissue injury in early immune response[J].J Immunol,2009,183(1):32-36.
[16] 王月颖,张世杰,邵毅,等.BTLA信号对T细胞活化的起始和早期阶段的调节作用[J].中国免疫学杂志,2010,26(4):304-308.
Effect of interaction between BTLA and HVEM on T cell activation
WANG Yun-yun1,JIANG Yu-ping2,ZHANG Biao1,GU Zong-jiang1
(Department of Immunology,School of Biology and Basic Medical Science,Soochow University,Suzhou Jiangsu 215007;2.Yancheng Products Quality Supervision and Test Institute,Yancheng Jiangsu 224005,China)
Objective:To investigate the effect of interaction between B and T lymphocyte attenuator(BTLA)and HVEM ofmouse bonemarrow-derived dendritic cells(BMDC)on T cell activation.M ethods:T cells and BMDC from C57BL/6 mouse weremixed and cultured.After blocking HVEM on BMDC by antibodies against HVEM,MTTmethod was used to examine T cell proliferation and the secretion of IL-2 was tested by ELISA kit.Results:In the priming and early phase(0-48 h),ormiddle and later phase(48-96 h),or all phase(0-96 h)ofmixing culture,the proliferation of T cells from experimental groupswith addition of HVEM antibodieswas higher compared with control groups(P<0.05),and the secretion of IL-2 from CD3+T cell and CD4+T cell groups was also higher compared with control groups(P<0.05).Conclusion:The negative signal produced by interaction between BTLA and HVEM played the inhibition role in T cell activation.Especially in the priming and early phase(0-48 h)ofmixing culture of T cells and BMDC,the negative signal from BTLA already played such inhibition role,exhibiting another negative regulation mode different from traditional negative feedback regulation mode and suggesting the existence of multiple negative regulation for T cell activation.
B and T lymphocyte attenuator;T cell;immune regulation
R392
A
1671-7783(2015)04-0290-04
10.13312/j.issn.1671-7783.y150106
王芸芸(1988—),女,硕士研究生;顾宗江(通讯作者),教授,博士生导师,E-mail:suguzj@163.com
2015-05-12 [编辑] 何承志

