HMGB1 RNAi抑制TGF-β1诱导的A549细胞系EMT
蔡 琳,阮志燕,徐 军
(1.广东食品药品职业学院 国际学院 健康管理教研室,广东 广州 510520;2.呼吸疾病国家重点实验室 广州医学院 第一附属医院 呼吸内科 广州呼吸疾病研究所,广东 广州 510120)
HMGB1 RNAi抑制TGF-β1诱导的A549细胞系EMT
蔡 琳1*,阮志燕1,徐 军2
(1.广东食品药品职业学院 国际学院 健康管理教研室,广东 广州 510520;2.呼吸疾病国家重点实验室 广州医学院 第一附属医院 呼吸内科 广州呼吸疾病研究所,广东 广州 510120)
目的探讨HMGB1在肺泡上皮细胞间质转分化中的作用。方法设计并合成针对HMGB1的小干扰RNA(siRNA),体外培养Ⅱ型肺泡上皮细胞系细胞-A549细胞,将细胞分为4组:1)对照组,2)TGF-β1刺激组,3)RNAi组(TGF-β1+ HMGB1 siRNA),4)RNAi阴性对照组(TGF-β1+ siRNA阴性对照);倒置相差显微镜观察细胞形态学;RT-PCR法检测HMGB1和α平滑肌肌动蛋白(α-SMA)的mRNA表达;Western blot法检测α-SMA和HMGB1蛋白表达。结果TGF-β1刺激组细胞HMGB1和α-SMA 的mRNA和蛋白表达均较对照组显著增加(P<0.01);RNAi组HMGB1、α-SMA mRNA和蛋白表达均较正常对照组显著下降(P<0.01)。结论HMGB1可能参与了TGFβ1 诱导的肺泡上皮细胞转分化。
RNA干扰;高迁移率族蛋白B1;α平滑肌肌动蛋白;上皮间质转分化
肺纤维化是以肺实质炎症和进行性肺间质纤维化为特征的疾病,其发病机制尚不明确。目前较多资料提示上皮细胞损伤后的修复失调是导致纤维化的重要环节,其中上皮细胞-间质转分化 (epithelial
to mesenchymal transition, EMT)是肺间质纤维化关键的病理改变。
高迁移率族蛋白(high mobility group B1,HMGB1)是存在于真核细胞系内的非组蛋白染色体结合蛋白,对调节染色体功能具有重要作用,该分子在胞质和细胞外能调节免疫和炎性反应[1]。最近的研究发现HMGB1与组织纤维化有密切的关系[2- 3]。转化生长因子β1(transforming growth factorβ1,TGFβ1)是促EMT作用最强的细胞因子。目前尚无TGFβ1诱导肺泡上皮细胞转分化与HMGB1相互关系的报道。
1 材料与方法
1.1 主要试剂和细胞
A549细胞系由广州医学院实验中心保存;TGFβ1 (PeproTech公司);反转录试剂盒(Takara 公司);鼠抗人α-SMA单克隆抗体(Sigma公司);鼠抗人HMGB1单克隆抗体(Abnova公司);HMGB1 siRNA, siRNA阴性对照(Invitrogen公司)。
1.2 细胞培养
A549细胞用含10%胎牛血清的低糖DMEM培养基,常规培养于5%的CO2,37℃ 人工培养箱中,细胞呈贴壁增殖,每周传代2次。
1.3 细胞分组和处理
当细胞增殖汇合至70%~80%,用无血清培养基饥饿24 h使细胞静止于同步期。采用随机化的原则将细胞分为对照组,TGFβ1刺激组,RNAi组和RNAi阴性对照组。对照组未加刺激剂,加入与其他组等量PBS,静置72 h;转化生长因子β1(TGFβ1)刺激组加入TGFβ1 (终浓度为10 μg/L) 刺激72 h;RNAi组在培养液中用脂质体(Lipofectanmine2000)转染25 μL siRNA(20 μmol/L)至细胞内,静置1 h后更换无血清必需培养基(MEM),加入TGFβ1刺激72 h;RNAi阴性对照组用脂质体转染25 μL siRNA阴性对照(20 μmol/L)至细胞内,静置1 h后更换无血清MEM,加入TGFβ1刺激72 h。
1.4 倒置相差显微镜观察细胞形态
当细胞分组处理72 h后,使用倒置相差显微镜观察细胞形态学并拍照。
1.5细胞mRNA的提取和RT-PCR检测HMGB1和α-SMA
于72 h后从6孔板中离心收集细胞,加入1 mL Trizol Reagent,按其说明书操作步骤提取总RNA,紫外分光光度计定量,按反转录试剂盒说明书提供的方法进行反转录。以cDNA为模板进行PCR扩增,设计引物序列, 分别为: HMGB1引物:上游5′-ATG GGCAAAGGAGATCCTA-3′,下游5′-CCTCATCATCT TCCTCTTC-3′,长度575 bp;α-SMA引物:上游5′-A CCCAGATTATGTTTGAGACC-3′,下游5′-CCGTCAG GCAGTTCGTAG-3′,长度377 bp;GAPDH引物:上游5′-GGTGAAGGTCGGAGTCAACG-3′,下游5′-CAAAG TTGTCATGGATGACC-3′,长度497 bp。所有引物序列均采用序列局部相似性查询系统(BLAST)软件分析,并由上海生工生物工程技术服务有限公司合成。PCR反应条件:94 ℃预变性5 min, 94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸40 s, 72 ℃最后延伸10 min, 30 个循环。PCR 产物4 μL琼脂糖凝胶电泳,采用KONDA2000凝胶成像系统成像。用图像分析软件进行分析,以管家基因GAPDH条带为内参照,计算目的基因与相应内参基因条带吸光度的相对比值。
1.6Westernblot法检测细胞HMGB1和α-SMA蛋白表达
TGFβ1处理后收集各组细胞,按试剂盒说明书提取细胞总蛋白。各组标本加入蛋白上样缓冲液行SDS-PAGE电泳,转膜,封闭,一抗孵育,二抗孵育, ECL发光显色。采用KONDA2000凝胶成像系统成像,图像分析软件进行分析,以GAPDH为内参照,计算目的基因与内参照吸光度的相对比值。
1.7 统计学分析
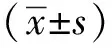
2 结果
2.1 细胞形态学观察
对照组A549细胞呈铺路石样生长,细胞间连接紧密。TGFβ1刺激组细胞间隙略变大,离散成单个,形态呈梭形,呈现出间质细胞样形态。RNAi阴性对照组细胞形态与TGFβ1刺激组无明显差异。RNAi组绝大部分细胞形态恢复铺路石样,细胞间连接显著增加 (图1)。
2.2RT-PCR检测HMGB1和α-SMAmRNA表达
与对照组相比,TGFβ1刺激组细胞HMGB1和α-SMA mRNA表达明显增加(P<0.01),RNAi组与TGFβ1刺激组比较HMGB1 mRNA表达较明显减少(P<0.01)(图2)。
2.3Westernblot检测HMGB1和α-SMA蛋白表达
TGFβ1刺激组和RNAi组阴性对照组细胞α-SMA和HMGB1蛋白表达量均较对照组明显增多(P<0.01)(图3)。与TGFβ1刺激组相比,RNAi组α-SMA和HMGB1蛋白表达量明显减少(P<0.01)(图3)。
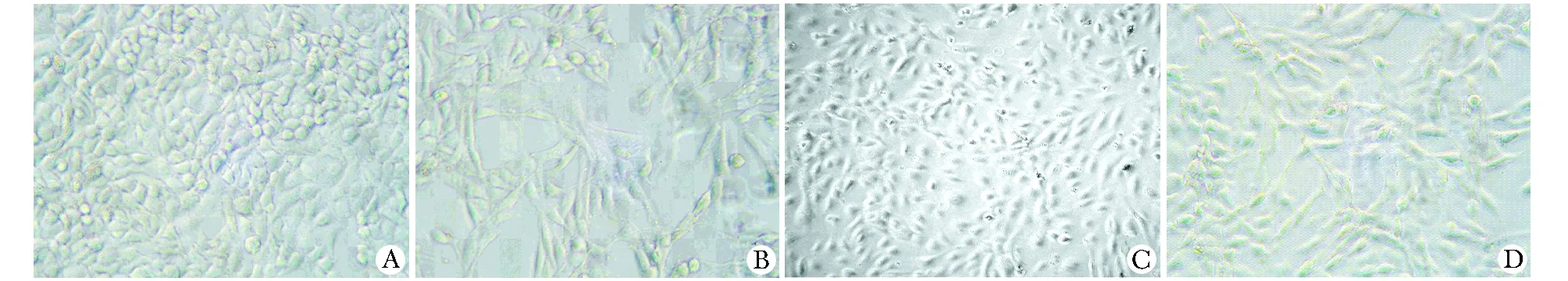
A.normal control group; B.TGFβ1 group; C.RNAi group; D.RNAi negative control group图1 各组细胞的形态学改变Fig 1 Morphological changes of each group cells (×200)
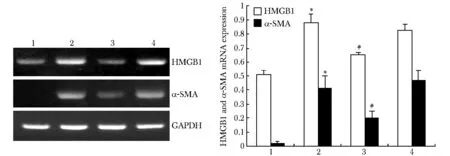
1.control group; 2.TGFβ1 group; 3.RNAi group; 4.RNAi negative control group; *P<0.01 compared with control group; #P<0.01 compared with TGFβ1 group
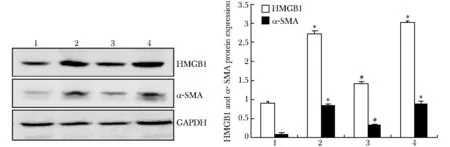
1.control group; 2.TGFβ1 group; 3.RNAi group; 4.RNAi negative control group; *P<0.01 compared with control group; #P<0.01 compared with TGFβ1 group
3 讨论
EMT是上皮细胞在与周围间质的相互作用过程中逐渐获得了某些间质细胞特有性状的现象。有研究表明,HMGB1能诱导人肾小管上皮细胞发生EMT, 从上皮细胞向肌成纤维细胞转化并且表达α-SMA[4]。本研究在前期实验中发现,异常活化的HMGB1参与了博莱霉素诱导的小鼠肺纤维化中EMT的发生,在转分化的气道上皮中观察到HMGB1的异常高表达[5]。通过RNAi抑制HMGB1的表达之后,纤维化程度减轻,α-SMA的表达明显减少[6]。
TGFβ是促EMT作用最强和最经典的细胞因子,除直接诱导EMT外TGFβ还介导其他细胞因子诱导EMT的作用[7]。本研究显示,在TGFβ1刺激细胞72 h后,A549细胞发生转分化,HMGB1表达亦显著上调。通过RNAi抑制HMGB1表达后,α-SMA表达随之明显下调。表明TGFβ1诱导的EMT过程中存在HMGB1的活化表达,抑制HMGB1的表达能够减轻TGF-β1诱导的A549细胞转分化,HMGB1可能参与了TGFβ1诱导肺泡上皮细胞转分化。
胞外的HMGB1通过与晚期糖基化受体(receptor of advanced glycation end-product, RAGE)和Toll样受体(TLR)2/4结合激活细胞内信号传导[8], RAGE是HMGB1的主要受体[9],HMGB1与RAGE结合以后能活化CDC42/Rac和MAPKs信号通路,最终导致活化NF-κB通路[9]。RAGE的活化除了能活化其本身的信号通路以后,还能同时诱导TGFβ1信号通路活化[10],而TGFβ1亦可介导RAGE的活化表达, 在肝脏星状细胞中TGFβ1能时间依赖性的提高RAGE蛋白的合成,给予RAGE抗体能减少间皮下纤维化过程中TGFβ1的表达[11],因此HMGB1-RAGE通路和TGFβ1可能存在信号通路交叉活化。本实验首次发现在TGFβ1诱导的肺泡上皮细胞转分化中,抑制HMGB1的表达能够减轻TGFβ1 诱导的EMT。但这一过程中HMGB1如何影响TGFβ1诱导的EMT过程,HMGB1-RAGE通路和TGFβ1如何产生信号通路的交叉活化,还有待进一步探讨。
综上所述,本研究结果表明,HMGB1可能参与了TGFβ1 诱导的肺泡上皮细胞转分化。然而,TGF-β1活化HMGB1的途径如何,特异性抑制HMGB1是否可以作为肺纤维化治疗过程中的一个共同靶点还需进一步实验研究。
[1] Lotze MT, Tracey KJ. High-mobility group box 1 protein (HMGB10: Nuclear weapon in theimmune arsenal[J]. Nat Rev Immunol, 2005, 5:331- 342.
[2] Wang WK, Wang B, Lu QH,etal. Inhibition of high-mobility group box 1 improves myocardial fibrosis and dysfunction in diabetic cardiomyopathy [J]. Int J Cardiol, 2014, 172:202-212.
[3] Alisi A, Nobili V, Ceccarelli S,etal. Plasma high mobility group box 1 protein reflects fibrosis in pediatric nonalcoholic fatty liver disease [J]. Expert Rev Mol Diagn, 2014,14:763-771
[4] Lynch J, Nolan S, Slattery C,etal. High-mobility group box protein 1: a novel mediator of inflammatory-induced renal epithelial-mesenchymal transition[J]. Am J Nephrol, 2010, 32:590-602.
[5] 蔡琳,李理, 徐军. 高迁移率族蛋白B1和α平滑肌肌动蛋白活化在博来霉素诱导肺纤维化中的表达[J]. 中国呼吸与危重监护杂志, 2009, 8:181-185.
[6] 蔡琳,徐军. HMGB1 RNA干扰对博莱霉素诱导肺纤维化小鼠α平滑肌肌动蛋白的抑制作用[J]. 免疫学杂志,2013, 293:22-326.
[7] Andre R, Pinteaux E, Kimber I,etal. Differential actions of IL-1 alpha and IL-1 beta in glial cells share common IL-1 s ignalling pathways [J]. Neuroreport 2005, 16: 153-157.
[8] Van Beijnum JR, Buurman WA, Griffioen AW. Convergence and amplification of toll-like receptor (TLR) and receptor for advanced glycation end products (RAGE) signaling pathways via high mobility group B1 (HMGB1)[J]. Angiogenesis, 2008, 11: 91-99.
[9] Demarco RA, Fink MP, Lotze MT. Monocytes promote natural killer cell interferon gamma production in response to the endogenous danger signal HMGB1 [J]. Mol Immunol 2005, 42: 433-444.
[10] Simm A, Bartling B, Silber RE. Rage: A new pleiotropic antagonistic gene? [J] Ann N Y Acad Sci, 2004, 1019: 228-231.
[11] Kao YH, Lin YC, Tsai MS,etal. Involvement of the nuclear high mobility group B1 peptides released from injured hepatocytes in murine hepatic fibrogenesis [J]. Biochim Biophys Acta, 2014, 23:182-183.
HMGB1 RNAi inhibits TGF-β1 induced epithelial-mesenchymal transition in A549 cells
CAI Lin1*, RUAN Zhi-yan1, XU Jun2
(1.Dept. of Health Management, International School, Guangdong Food and Drug Vocational College, Guangzhou 510520; 2.Institute of Respiratory Disease, the First Affiliated Hospital, Guangzhou Medical College, Guangzhou 510520, China)
ObjectiveTo investigate the role of HMGB1 in epithelial-mesenchymal transition.MethodsSpecific siRNA of HMGB1 was designed and synthesized. Cultured typeⅡ alveolar epithelial cell line-A549 cells were divided into 4 groups:1)control group, 2)model group induced by TGF-β1, 3)HMGB1 RNAi group, 4)RNAi negative control group. Cellular morphology changes were observed by phase-contrast microscope. HMGB1 and α-SMA expression in A549 cells was detected by RT-PCR and Western blotting respectively.ResultsmRNA and protein expression of HMGB1 and α-SMA in TGF-β1 group increased significantly than that in control group(P<0.01). HMGB1, α-SMA mRNA and protein expression in siRNA-treated cells decreased significantly as compared with that in TGF-β1 group(P<0.01).ConclusionsHMGB1 may be involved in the TGF-β 1 induced EMT.
RNAi; high mobility group B1; α-smooth muscle actin; epithelial-mesenchymal transition
2014- 06- 12
:2014- 10- 08
广东省医学科研基金(B2013068);广东食品药品职业学院自然科学研究项目(2012YZ006)
*通信作者(correspondingauthor):lin_cai@126.com
1001-6325(2015)02-0183-04
研究论文
R 563
:A

