布加综合征患者纤维化相关细胞因子的表达
宁 欣,陆召军,丁晓帆,桂 迩,高修银
布加综合征 (BCS)统指肝小叶静脉到下腔静脉与右心房入口处的肝静脉流出道任何部位、任何性质的阻塞而引起的肝后性门静脉高压和/或下腔静脉高压综合征[1]。患者肝静脉回流受阻,可发生不同程度的肝纤维化、淤血性肝硬化甚至肝癌。据Shrestha[2]统计,BCS患者中肝硬化发生率为71%~100%,原发性肝癌发生率为4.6% ~47.0%。多项研究表明,纤维化相关细胞因子转化生长因子β1(TGF-β1)、血管内皮生长因子(VEGF)、缺氧诱导因子1α(HIF-1α)在肝纤维化、肝硬化、肝癌的转归中扮演了重要角色,而国内外在此方面对BCS的研究鲜有报道。本研究通过对BCS患者血清 TGF-β1、VEGF、HIF-1α的检测,了解其在BCS中的表达情况,进一步探讨其在单纯BCS发展至淤血性肝硬化、肝癌转归中的作用,可对BCS患者发生淤血性肝硬化、肝癌的原因行进一步的补充,对了解BCS患者肝脏损伤情况有重要意义。
1 对象与方法
1.1 研究对象 选取2013年11月—2014年4月徐州医学院附属医院介入科收治的BCS患者47例作为BCS组。患者均经下腔静脉和/或肝静脉造影 (金标准)确诊;排除标准:(1)病毒性肝炎、酒精性肝病等其他肝病者或其他纤维化病变者;(2)肝癌以外的其他恶性肿瘤者。另选取同期肝硬化患者29例作为肝硬化组,患者均有病毒性肝炎、长期大量饮酒史,B超和/或CT等影像学检查示肝硬化。同时在本院普外科中选取35例患者作为普外科组,排除纤维化相关疾病、肿瘤等,患者肝、肾功能等血清学指标检查均正常。
1.2 试剂与方法 3组患者在治疗前均采集静脉血5 ml,置于5 ml分离胶-促凝管中,室温静置30 min,在4℃条件下以3 000 r/min离心15 min,将上层血清装入1.5 ml EP管中,置于-80℃冰箱中冷藏。冷藏过程中避免血清反复冻融。采用酶联免疫吸附法 (ELISA)检测TGF-β1、VEGF、HIF-1α水平,检测过程严格按照试剂盒说明书操作。
1.3 统计学方法 采用SPSS 16.0软件进行统计学分析,计量资料以 (±s)表示,进行方差齐性检验,方差不齐的资料采用Welch法进行校正,多组间比较采用方差分析,组间两两比较应用SNK-q检验;相关性分析采用Pearson直线相关。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 BCS组中男23例,女24例;年龄28~71岁,平均年龄46.2岁;单纯BCS者26例,BCS合并淤血性肝硬化14例,BCS合并肝癌7例。肝硬化组中男16例,女13例;年龄25~73岁,平均年龄48.6岁。普外科组中男18例,女17例;年龄28~77岁,平均年龄46.2岁。3组性别、年龄间具有可比性。
2.2 3 组血清TGF-β1、VEGF、HIF-1α水平比较 3组血清TGF-β1、VEGF、HIF-1α水平比较,差异均有统计学意义 (P<0.05);其中肝硬化组和BCS组血清TGF-β1、VEGF、HIF-1α水平均高于普外科组,BCS组血清TGF-β1水平低于肝硬化组,VEGF、HIF-1α水平高于肝硬化组,差异均有统计学意义 (P<0.05,见表 1)。
表1 3组患者血清TGF-β1、VEGF、HIF-1α水平比较(±s,ng/L)Table 1 Comparison of serum TGF-β1,VEGF and HIF-1α among the 3 groups

表1 3组患者血清TGF-β1、VEGF、HIF-1α水平比较(±s,ng/L)Table 1 Comparison of serum TGF-β1,VEGF and HIF-1α among the 3 groups
注:与普外科组比较,*P<0.05;与肝硬化组比较,△P<0.05;BCS=布加综合征,TGF-β1=转化生长因子β1,VEGF=血管内皮生长因子,HIF-1α=缺氧诱导因子1α
组别 例数 TGF-β1 VEGF HIF-1α普外科组 35 458±47 674± 84 25±3肝硬化组 29 695±64* 867± 71* 53±5*BCS组 47 650±68*△ 1 023±119*△ 56±5*△F 159.72 591.98 110.35 P值值<0.001 <0.001 <0.001
2.3 单纯BCS与BCS合并肝疾病患者血清TGF-β1、VEGF、HIF-1α水平比较 单纯BCS、BCS合并肝硬化、BCS合并肝癌患者血清TGF-β1、VEGF、HIF-1α水平比较,差异均有统计学意义 (P<0.05);其中BCS合并肝硬化、BCS合并肝癌患者血清TGF-β1、VEGF、HIF-1α水平均高于单纯BCS患者,BCS合并肝癌患者血清TGF-β1、VEGF、HIF-1α水平均高于BCS合并肝硬化患者,差异均有统计学意义 (P<0.05,见表2)。
2.4 相关性分析 对BCS患者血清 TGF-β1、VEGF、HIF-1α水平进行相关性分析,结果显示,HIF-1α与VEGF呈正相关 (r=0.773,P<0.05,见图1);HIF-1α 与 TGF-β1 呈正相关 (r=0.793,P<0.05,见图2);TGF-β1与 VEGF呈正相关 (r=0.582,P<0.05,见图3)。
表2 单纯BCS、BCS合并肝硬化、BCS合并肝癌患者血清TGF-β1、VEGF、HIF-1α 水平比较 (±s,ng/L)Table 2 Comparison of serum TGF- β1,VEGF and HIF-1α among patients with pure BCS,BCS complicated by hepatic cirrhosis and BCS complicated by HCC
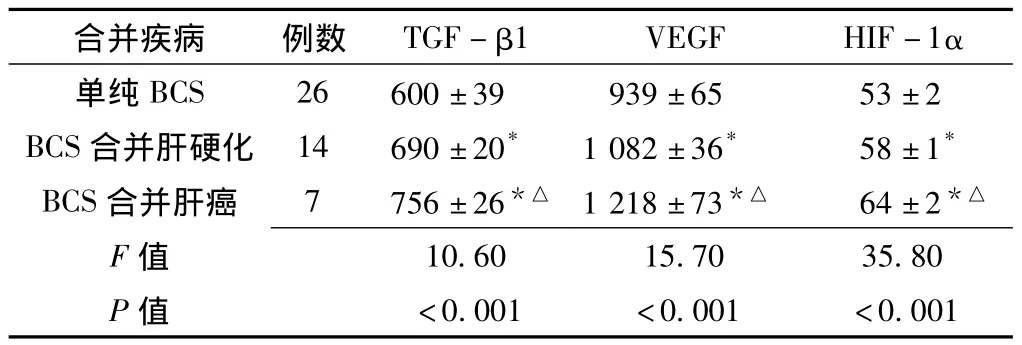
表2 单纯BCS、BCS合并肝硬化、BCS合并肝癌患者血清TGF-β1、VEGF、HIF-1α 水平比较 (±s,ng/L)Table 2 Comparison of serum TGF- β1,VEGF and HIF-1α among patients with pure BCS,BCS complicated by hepatic cirrhosis and BCS complicated by HCC
注:与单纯 BCS比较,*P<0.05;与 BCS合并肝硬化比较,△P<0.05
合并疾病 例数 TGF-β1 VEGF HIF-1α单纯BCS 26 600±39 939±65 53±2 BCS合并肝硬化 14 690±20* 1 082±36* 58±1*BCS合并肝癌 7 756±26*△ 1 218±73*△ 64±2*△F 10.60 15.70 35.80 P值值<0.001 <0.001 <0.001

图1 BCS患者HIF-1α与VEGF关系的散点图Figure 1 Scatter plot of relationship between HIF-1α and VEGF in BCS patients

图2 BCS患者HIF-1α与TGF-β1关系的散点图Figure 2 Scatter plot of relationship between HIF-1α and TGF-β1 in BCS patients

图3 BCS患者TGF-β1与VEGF关系的散点图Figure 3 Scatter plot of relationship between TGF-β1 and VEGF in BCS patients
3 讨论
BCS患者由于肝静脉血液回流障碍,肝脏长期处于淤血状态,可导致肝纤维化、肝硬化甚至原发性肝癌[3-4],其基本的病理表现与肝炎后肝硬化相似,但两者预后有较大的差别。
有研究表明,TGF-β1是肝纤维化最重要的始动因子之一[5],可能参与了肝纤维化形成及向肝硬化发展的过程[6]。文献分析表明,检测血清TGF-β1水平有助于了解肝细胞受损情况[7]。BCS患者肝脏慢性缺血缺氧,损伤肝细胞,肝脏损伤或炎症可导致肝星状细胞(HSC)、Kupffer细胞产生大量TGF-β1。本研究结果显示,BCS组、肝硬化组血清TGF-β1水平高于普外科组。值得关注的是,BCS组TGF-β1水平低于肝硬化组,这主要与BCS肝功能损害较轻有关,与常见的肝炎、肝硬化不同的是,BCS肝功能损害与门脉高压症状并不平行,肝损害轻而门脉高压重[8]。BCS组中随着单纯BCS、BCS合并淤血性肝硬化、BCS合并肝癌的不断发展,患者血清TGF-β1水平逐渐升高。随着BCS患者病情进展,肝组织的持续缺血缺氧,可促使存活的肝细胞和HSC合成分泌更多的TGF-β1,激发HSC持续活化,细胞外基质 (ECM)成分不断沉积,最终促进向肝硬化、肝癌发展。
VEGF是目前所知最重要的直接作用于血管内皮细胞的生长因子,可特异性地促进内皮细胞分裂、增殖和移动,增加血管通透性,在血管形成中起重要作用[9]。自1983年Senger等首先从肿瘤腹腔积液中发现VEGF[10],多项研究表明VEGF水平反映肝细胞的再生能力。本研究结果显示,BCS组、肝硬化组血清VEGF水平高于普外科组,其中BCS患者血清VEGF高于肝硬化患者,BCS患者的肝脏中往往有广泛的侧支形成,甚至形成非常粗大的侧支或交通支,VEGF作为血管内皮细胞的生长因子,会高水平表达。此外,BCS患者广泛的侧支可缓解肝脏的淤血状态,减慢纤维化进程,这也正是BCS患者若尽早进行肝纤维化治疗,长期预后较肝硬化效果好的原因所在。BCS组中随着单纯BCS、BCS合并肝硬化、BCS合并肝癌的不断发展,患者血清VEGF水平逐渐升高,BCS患者随着肝脏缺氧时间的延长,肝细胞坏死进一步增多,释放出更多的炎性递质刺激活化肝细胞、HSC,通过自分泌和旁分泌的方式产生细胞因子,从而导致VEGF水平增高。因此,从纤维化病变到淤血性肝硬化再到肝癌的发生,VEGF起着推进作用。
HIF-1α是缺氧刺激的特异感受性转录因子,是联系低氧和低氧反应基因的重要物质基础[11]。本研究结果显示,BCS组、肝硬化组血清HIF-1α水平高于普外科组,其中BCS患者血清HIF-1α水平高于肝硬化患者,分析原因为,与肝硬化患者相比,BCS患者由于肝静脉和/或脾动脉狭窄或闭塞导致肝脏长期处于淤血状态,导致慢性缺血缺氧,使得肝细胞中HIF-1α蓄积。BCS组中随着单纯BCS、BCS合并淤血性肝硬化、BCS合并肝癌的不断发展,患者血清HIF-1α水平逐渐升高,分析原因为,缺氧可导致肝窦内皮细胞、HSC及Kupffer细胞中HIF-1α的活化并调控其下游靶基因产生各种炎性因子,这些炎性因子可损伤肝细胞,激活HSC产生ECM以及产生新生血管,这种病理反应反复长期存在可引起肝脏发生纤维化,最终导致淤血性肝硬化、肝癌的形成。
TGF-β1、VEGF、HIF-1α相关分析显示,三者之间呈正相关,说明随着BCS患者病程进展,肝脏缺氧程度增加,导致HIF-1α的表达增加,并促进其下游细胞因子TGF-β1、VEGF的转录。三者相互作用,最终推进淤血性肝硬化、肝癌的形成。
本研究表明,TGF-β1、VEGF、HIF-1α参与了单纯BCS发展为淤血性肝硬化、肝癌的进程。Shin等[12]认为,BCS合并肝癌患者较乙肝合并肝癌患者和单纯的肝癌患者生存期要长,但是相比于单纯的BCS患者其生存期要短。因此,对BCS患者进行介入治疗的同时尽早结合肝纤维化治疗,对延缓甚至逆转患者肝脏的损伤,减少淤血性肝硬化甚至肝癌的发生有重要意义。TGF-β1信号通路、HIF-1α信号通路与肝纤维化发生发展密切相关[13-14],针对 TGF-β1、HIF-1α 的治疗方案将有助于肝纤维化防治水平的进一步提高。
[1] Valla DC.Primary Budd-Chiari syndrome [J].J Hepatol,2009,50(1):195-203.
[2] Shrestha SM.Liver cirrhosis and hepatocellular carcinoma in hepatic vena cava disease,a liver disease caused by obstruction of inferior vena cava [J].Hepatol Int,2009,3(2):392-402.
[3] Zhang QQ,Zu MH,Xu H,et al.Interventional treatment of hepatocellular carcinoma complicated by Budd-Chiari syndrome[J].Chinese Journal of Radiology,2010,44(8):852-855.(in Chinese)
张庆桥,祖茂衡,徐浩,等.布加综合征合并肝细胞癌的介入治疗[J].中华放射学杂志,2010,44(8):852-855.
[4] Gwon D 2nd,Ko GY,Yoon HK,et al.Hepatocellular carcinoma associated with membranous obstruction of the inferior vena cava:incidence,characteristics,and risk factors and clinical efficacy of TACE [J].Radiology,2010,254(2):617-626.
[5] Shek FW,Benyon RC.How can transforming growth factor beta be targeted usefully to combat liver fibrosis? [J].Eur J Gastroenterol Hepatol,2004,16(2):123-126.
[6] Li XH,Yang PF,Qi HX,et al.The changes and significance of serum TGF- β1,VEGF in patients with chronic hepatitis B,liver fibrosisand livercirrhosis[J].Chinese JournalofClinical Gastroenterology,2011,23(3):144-145.(in Chinese)
李晓红,杨蒲芳,戚红霞,等.血清TGF-β1及VEGF在慢性乙肝、肝纤维化、肝硬化患者的临床变化及其意义[J].临床消化病杂志,2011,23(3):144-145.
[7] Sun Y,Xuan SY,Xin YN,et al.Relationship between serum TGF β1 with chronic hepatitis B involving in liver cell function and liver biopsy fibrosis[J].Chinese Journal of Hepatology,2002,10(3):221-222.(in Chinese)
孙樱,宣世英,辛永宁,等.慢性乙型肝炎患者血清TGFβ1与肝组织纤维化及肝功能相关性的研究 [J].中华肝脏病杂志,2002,10(3):221-222.
[8] Han XW,Ma B,Wu G,et al.Budd-Chiari syndrome:the study of pathological features of liver with bilpsy[J].Journal of Interventional Radiology,2006,15(9):527-529.(in Chinese)
韩新巍,马波,吴刚,等.Budd-Chiari综合征:肝脏病理学改变 [J].介入放射学杂志,2006,15(9):527-529.
[9] Yoshiji H,Kuriyama S,Yoshii J,et al.Vascular endothelial growth factor and receptor interaction is a prerequisite for murine hepatic fibrogenesis [J].Gut,2003,52(9):1347-1354.
[10] Ankoma-Sey V,Matli M,Chang KB,et al.Coordinated induction of VEGF receptors in mesenchymal cell types during rat hepatic wound healing [J].Oncogene,1998,17(1):115-121.
[11] Jiang BH,Rue E,Wang GL,et al.Dimerization,DNA binding,and transactivation properties of hypoxia-inducible factor 1 [J].J Biol Chem,1996,271(30):17771-17778.
[12] Shin SH,Chung YH,Suh DD.Characteristic clinical features of hepatocellular carcinoma associated with Budd-Chiari syndrome:evidence of different carcinogenic process from hepatitis B virusassociated hepatocellularcarcinoma[J].EurJ Gastroenterol Hepatol,2004,16(3):319-324.
[13]王岩,李芳丽.TGF-β/Smad信号通路与肝纤维化研究进展[J].科技信息,2009(29):54.
[14] Cheng DL,Xu H,Hua R,et al.Analysis of the expression of hypoxia inducible factor-1α,nuclear factor-kappaB and tumor necrosis factor-α in stasis cirrhosis caused by Budd-Charri syndrome [J].Chinese Journal of Experimental Surgery,2013,30(4):836-838.(in Chinese)
成德雷,徐浩,华容,等.缺氧诱导因子-1α、核因子-κB及肿瘤坏死因子-α在布加综合征导致淤血性肝硬化的表达及其意义[J].中华实验外科杂志,2013,30(4):836-838.

